肥胖对2型糖尿病患者临床特征及心脏结构功能的影响
丁娇 雍永宏 马向华 沈捷
糖尿病和肥胖都是引起心血管并发症的重要因素。肥胖患者多存在血脂紊乱、胰岛素抵抗等心血管疾病危险因素,肥胖2型糖尿病患者的并发症包括心血管并发症,较非肥胖糖尿病患者更多。为了解肥胖对2型糖尿病患者临床特征及心脏功能的影响,对肥胖和非肥胖2型糖尿病患者进行对比研究。
1 对象与方法
1.1 研究对象符合WHO1999年糖尿病诊断标准的住院2型糖尿病患者270例,其中男147例,女123例,根据体质量指数(BMI)不同,按2000年亚太地区肥胖诊断标准分为非肥胖组(BMI为18.5~25)116例,男70例,女46例,年龄为31~93岁,平均(62±12)岁,合并高血压51例,冠心病12例;肥胖组(BMI>25)154例,男77例,女77例,年龄为36~87岁,平均(63±11)岁,合并高血压93例,合并冠心病25例。无心绞痛、心肌梗死发作,患者均采用口服降糖药或者胰岛素治疗。
1.2 研究方法患者均于清晨8点抽血检测生化指标,同时测量血压、身高、体质量,计算出BMI。采用Olympus AU5400全自动生化分析仪测定患者血液生化指标。胰岛素抵抗指数(HOMA-IR)=空腹血糖(mmol/L)×空腹胰岛素(FINS)(mU/L)/22.5。
采用超声心动仪检测升主动脉内径(AOD)、左房内径(LAD)、左室收缩期内径(LVDs)、左室舒张期内径(LVDd)、室间隔厚度(IVS)、左室后壁厚度(LVPW)、左室短轴缩短率(FS)、射血分数(EF),多普勒检测二尖瓣E峰与A峰比值(E/A)。体表面积(BSA)采用许文生氏公式BSA=0.006×H+0.0128×W-0.1529 m2。[H:身高(cm);W:体质量(kg)]。左室质量(LVM)采用Derereux公式计算,LVM=1.04×[(LVDd+IVSd+LPWd)3-LVDd5]-13.6 g。左室质量指数(LVMI)=LVM/BSA。相对室壁厚度(RWT)=(IVS+LVPW)/LVDd。左室舒张功能欠佳以E/A<1表示。
1.3 统计学方法采用Excel 2003及SPSS 17.0软件。所测数据以均数±标准差(¯x±s)表示,2组间各相应连续变量间差别分析采用独立样本t检验,构成比间差别分析采用χ2检验。在肥胖和非肥胖组中,以EF为因变量,BMI、年龄、收缩压(SBP)、舒张压(DBP)、糖尿病病程、糖化血红蛋白(HbA1c)、尿白蛋白与肌酐比值(Alb/Cr)、血尿酸(UA)、总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDLC)、高密度脂蛋白胆固醇(HDL-C)、FINS、餐后胰岛素(PINS)、空腹C肽(FC-P)、餐后C肽(PC-P)、HOMAIR、LVM等为自变量进行多元逐步回归分析。
2 结果
2.1 一般资料比较肥胖组DBP、FINS、PINS、FC-C、HOMA-IR及TG高于非肥胖组,非肥胖组HbA1c及空腹血糖高于肥胖组,差异均有显著性意义(P<0.05或P<0.01)。见表1。
2.2 心脏结构与功能比较肥胖组LAD、IVS、LVPW及LVM高于非肥胖组,差异均有显著性意义(P<0.05或P<0.01)。见表2。
2.3 多元逐步回归分析非肥胖组EF与BMI呈负相关,回归方程:EF=87.273-0.847BMI。肥胖组EF与SBP呈正相关,与TC、LVM、FINS呈负相关,回归方程为:EF=59.787+0.104SBP-0.846TC-0.02LVM-0.074FINS。
表1 肥胖组和非肥胖糖尿病患者一般资料比较(±s)
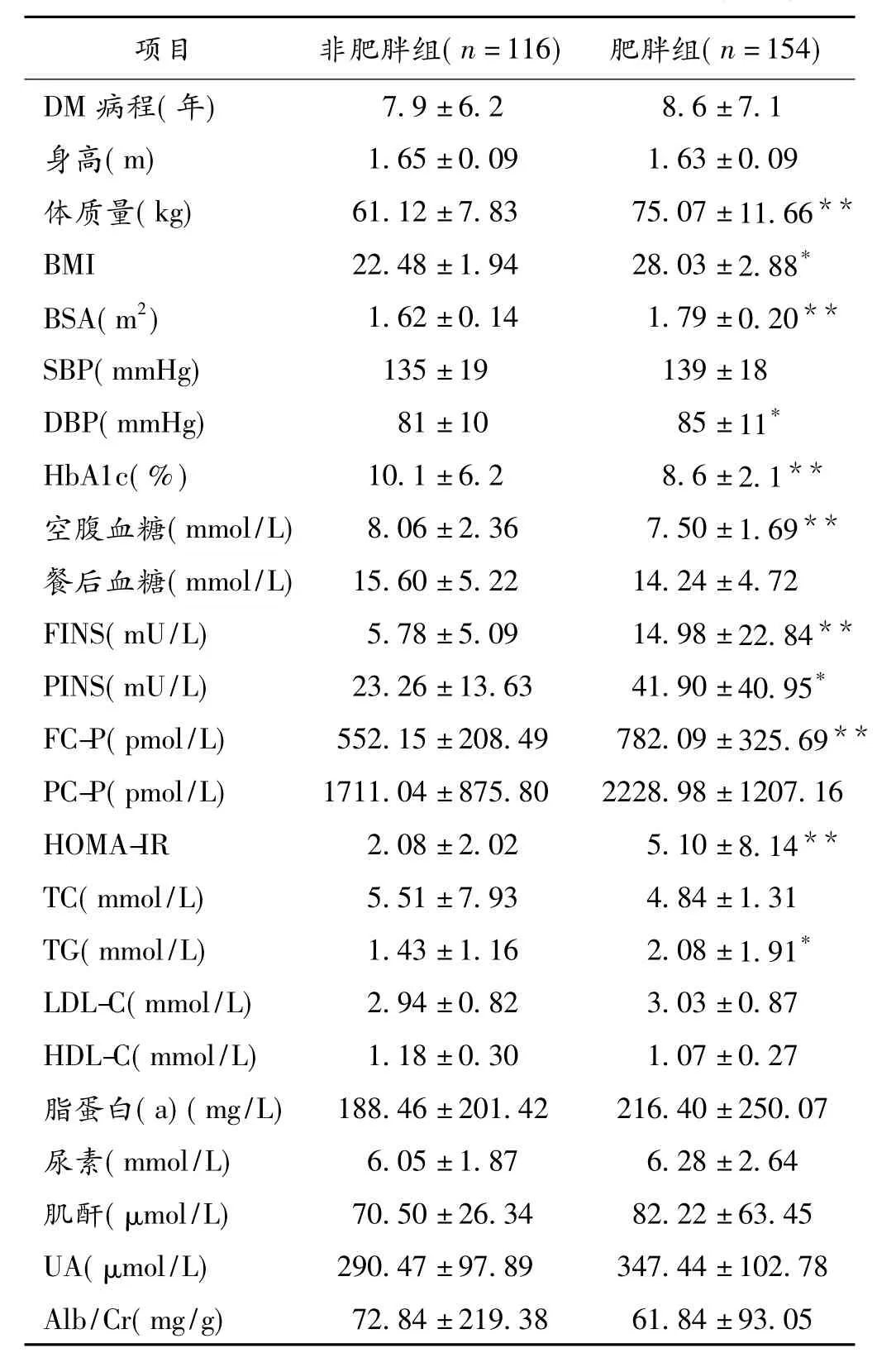
表1 肥胖组和非肥胖糖尿病患者一般资料比较(±s)
注:与非肥胖组比较,*P<0.05,**P<0.01
项目非肥胖组(n=116)肥胖组(n=154)DM病程(年)7.9±6.28.6±7.1身高(m)1.65±0.091.63±0.09体质量(kg)61.12±7.8375.07±11.66**BMI22.48±1.9428.03±2.88*BSA(m2)1.62±0.141.79±0.20**SBP(mmHg)135±19139±18 DBP(mmHg)81±1085±11*HbA1c(%)10.1±6.28.6±2.1**空腹血糖(mmol/L)8.06±2.367.50±1.69**餐后血糖(mmol/L)15.60±5.2214.24±4.72 FINS(mU/L)5.78±5.0914.98±22.84**PINS(mU/L)23.26±13.6341.90±40.95*FC-P(pmol/L)552.15±208.49782.09±325.69**PC-P(pmol/L)1711.04±875.802228.98±1207.16 HOMA-IR2.08±2.025.10±8.14**TC(mmol/L)5.51±7.934.84±1.31 TG(mmol/L)1.43±1.162.08±1.91*LDL-C(mmol/L)2.94±0.823.03±0.87 HDL-C(mmol/L)1.18±0.301.07±0.27脂蛋白(a)(mg/L)188.46±201.42216.40±250.07尿素(mmol/L)6.05±1.876.28±2.64肌酐(μmol/L)70.50±26.3482.22±63.45 UA(μmol/L)290.47±97.89347.44±102.78 Alb/Cr(mg/g)72.84±219.3861.84±93.05
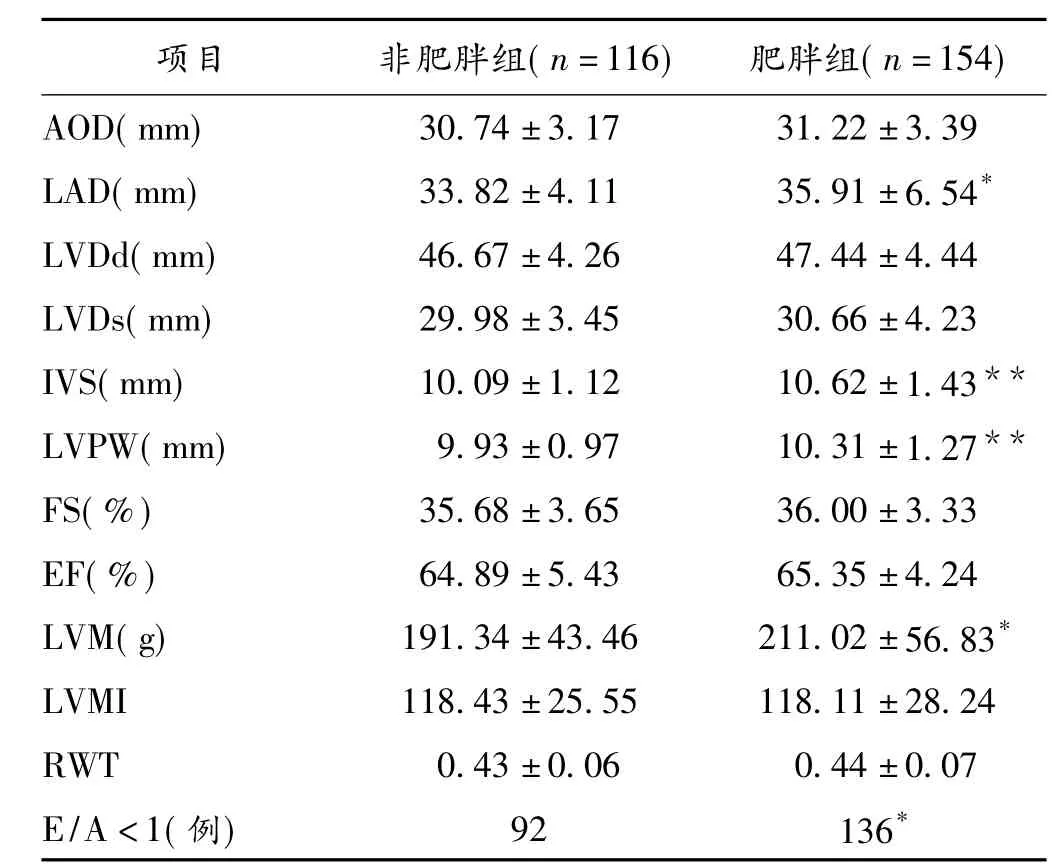
表2 肥胖组和非肥胖糖尿病患者心脏结构与功能比较
3 讨论
左心室肥厚是众多心脏疾病的共同病理改变,引起左心室肥厚及左心室功能改变的因素较多。近年来发现糖尿病与左室肥厚也有密切关系,国外研究显示青少年2型糖尿病患者即出现心血管风险的增加,同时该研究发现肥胖患者心脏容积和质量有所增加,当伴随糖尿病时,这种改变更为显著[1]。Ayer发现BMI是左心房大小的独立决定因素,有研究数据表明BMI与亚临床左室舒张功能障碍相关[2-3]。本研究2组间性别、年龄、高血压及冠心病患病率差异无显著性,因此肥胖以外的干预因素较小。研究结果显示:2组2型糖尿病患者均存在不同程度的左室舒张功能异常,但肥胖组DBP、LAD、IVS、LVPW及LVM较非肥胖组明显增大,肥胖组左室舒张功能异常比率亦明显高于非肥胖组,收缩功能2组无明显差异。研究结果表明肥胖2型糖尿病心脏功能早期改变以舒张功能异常为主,这与肥胖引起左房、室间隔、室壁肥大相使心室顺应性下降有关,与国外相关研究结果一致。肥胖组DBP较非肥胖组高,可能是肥胖患者血容量增大,交感神经兴奋性增加、肾素-血管紧张素系统(RAS)激活,使外周血管阻力增高所致,也是引起心脏舒张功能下降的原因之一。
肥胖2型糖尿病患者心脏结构及功能改变的机制尚不十分明确,可能与肥胖及糖尿病导致的糖脂代谢改变相关,也可能与心脏负荷状态有关。在动物实验中发现糖尿病鼠胰岛素作用缺陷引起心肌细胞热休克蛋白60(Hsp60)和胰岛素样生长因子1(IGF-1)表达下降使心肌保护能力减弱,高糖状态激活凋亡途径使心肌细胞凋亡增加[4-5]。Saito等曾提出“肥胖型心肌病”的概念。肥胖对心脏的影响是复杂的,肥胖所伴随的高游离脂肪酸水平可以激活心脏炎症、氧化应激通路,并可引起脂质异位沉积增加RAS活性损害心脏收缩及舒张功能,肥胖者充血性心力衰竭的危险性显著增加[6-7]。肥胖组FINS、PINS、FC-P、HOMA-IR及TG均高于非肥胖组,肥胖组回归方程中,心脏收缩功能与血清TC、FINS呈负相关,提示肥胖患者心脏收缩功能与胰岛素抵抗及血脂异常相关。高胰岛素水平使心脏胰岛素信号通路过度激活促进心肌硬化及病理性心肌重塑,损害心脏收缩功能[8]。本研究中非肥胖组空腹血糖及HbA1c水平较肥胖组高,可能与非肥胖病人胰岛素分泌缺陷,且较多使用口服降糖药相关。
综上所述,肥胖和2型糖尿病均能损害心脏结构及功能,两者并存加速心脏功能恶化。心脏舒张功能降低是心脏受损的早期表现,收缩功能降低可能与高胰岛素血症及血脂代谢异常相关。因此在糖尿病发现早期临床上减轻体质量,控制糖尿病有助于心脏功能改善。此外,改善高胰岛素血症,减轻胰岛素抵抗,改善血脂水平,全面控制代谢综合征各个组分有利于保护心脏结构及功能。
[1]Whalley GA,Gusso S,Hofman P,et al.Structural and functional cardiac abnormalities in adolescent girls with poorly controlled type 2 diabetes[J].Diabetes Care,2009,32(5):883-888.
[2]Ayer JG,Almafragy HS,Patel AA,et al.Body mass index is an independent determinant of left atrial size[J].Heart Lung Circ,2008,17(1):19-24.
[3]Kathrotia RG,Paralikar SJ,Rao PV,et al.Impact of different grades of body mass index on left ventricular structure and function[J].Indian J Physiol Pharmacol,2010,54(2):149-156.
[4]Chen HS,Shan YX,Yang TL,et al.Insulin deficiency downregulated heat shock protein 60 and IGF-1 receptor signaling in diabetic myocardium[J].Diabetes,2005,54(1):175-181.
[5]Cai L,Li W,Wang G,et al.Hyperglycemia-induced apoptosis in mouse myocardium:mitochondrial cytochrome C-mediated caspase-3 activation pathway[J].Diabetes,2002,51(6):1938-1948.
[6]柯柳,余叶蓉,张玄娥,等.高游离脂肪酸血症对心肌结构与功能的影响及其机制[J].四川大学学报:医学版,2009,40(1):24-28.
[7]Pan H,Yu Y,Tan H.Elevated circulating NEFA concentration are related to cardiac dysfunction of obese rats[J].Diabetologia,2009,52(S1):S494-S495.
[8]Shimizu I,Minamino T,Toko H,et al.Excessive cardiac insulin signaling exacerbates systolic dysfunction induced by pressure overload in rodents[J].J Clin Invest,2010,120(5):1506-1514.

