胆红素对新生儿脐血单核细胞分泌趋化蛋白-1和白细胞介素-12的影响
陈昌辉,陈 敏,刘会领,牛会琴,李茂军,吴 青
(四川省医学科学院·四川省人民医院儿科,四川 成都 610072)
黄疸是新生儿期常见的临床现象,低水平的血清胆红素是人体内自由基清除剂之一,对机体具有保护作用[1]。但胆红素水平显著升高时,则产生明显的毒性作用[2]。单核巨噬细胞是人体免疫系统的重要组成部分。本课题组前期研究表明,高浓度胆红素可抑制单核巨噬细胞的免疫功能。本研究采用不同浓度胆红素孵育新生儿脐血单核细胞(cord blood monocyte,CBMC),观察CBMC单核细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1)和白细胞介素-12(interleukin-12,IL-12)水平的变化,旨在进一步探讨胆红素对单核细胞免疫功能的影响。
1 资料与方法
1.1 一般资料 选择在成都市妇产科医院剖宫分娩、胎龄37~42周、出生体重2500~4000 g、Apgar评分正常的新生儿10例作为研究对象,并取得家长知情同意,其母孕期无特殊疾病史。在无菌操作条件下,用一次性采血袋采集新生儿的脐血80~150 ml,在4 h内分离细胞。
1.2 方法
1.2.1 主要试剂 淋巴细胞分离液为天津灏洋生物制品科技有限公司,RPMI-1640基础培养基为Gibco公司产品,脂多糖(LPS)为Solarbio公司产品,胆红素为Fluka公司产品,白蛋白和明胶为Sigma公司产品,FITC标记的鼠抗人CD14单克隆抗体为Caltag公司产品,MCP-1和IL-12酶联免疫吸附试验(ELISA)试剂盒由深圳晶美公司提供。
1.2.2 CBMC的分离与鉴定 先通过密度梯度离心法分离得到脐血单个核细胞(cord blood mononuclear cell,CB-MNC),用含20%小牛血清的RPMI-1640完全培养基把CB-MNC配制成浓度为(2~5) ×106/ml的细胞悬液。再参照Freundlich[3]的方法,将细胞悬液接种于2%明胶和自体血浆包被过的塑料培养瓶中孵育1 h,贴壁细胞即为CBMC。洗去未贴壁细胞,加入5mM的EDTA溶液消化得到贴壁细胞。台盼兰检测其活性,流式细胞仪分析其纯度。用RPMI-1640完全培养基调整活细胞数为1×107/ ml备用。
1.2.3 胆红素和LPS孵育脐血单核细胞 将分离得到的CBMC接种于24孔塑料培养板中,每例分为8个组:空白对照组(A组)、LPS对照组(B组)、6 mg/dl胆红素对照组(C组)及5个不同浓度的胆红素干预组[2.5 mg/dl胆红素+LPS组(D1组)、6 mg/dl胆红素+LPS组(D2组)、9 mg/dl胆红素+ LPS组(D3组)、12.9 mg/dl胆红素+LPS组(D4组)和18 mg/dl胆红素+LPS组(D5组)]。细胞先经不同浓度胆红素溶液(内含有牛血清白蛋白30 mg/L)避光孵育1 h后(反应体系为1 ml),吸出孵育液,再加入LPS溶液(100 μg/ml),其中A组和C组加入完全培养基2 ml,B组和D组加入1.98 ml完全培养基和0.02 ml LPS溶液(反应体系为2 ml,LPS最终浓度1 μg/ml),混匀。在37℃、5%CO2条件下培养24 h后,收集上清液备用。
1.2.4 MCP-1和IL-12水平的测定 采用双抗体夹心的ELISA法检测上清液中MCP-1和IL-12水平,严格按照说明书进行操作。
1.3 统计学方法 所得数据采用PEMS 3.0 for Windows软件进行统计学处理。原始数据经方差齐性检验,各组方差齐,采用q'检验;各组方差不齐,则采用秩和检验。两变量间相关分析采用Spearman法。P<0.05为差异有统计学意义。
2 结果
2.1 单核细胞的鉴定及活性检测 流式细胞仪分析结果显示,CD14阳性细胞率为(93.99±2.48)%; 0.4%台盼兰检测细胞活性为(93.86±1.79)%,表明所得到的单核细胞纯度及活性均可满足试验需要。
2.2CBMC分泌MCP-1水平的比较
2.2.1 不同浓度胆红素与LPS共同作用后CBMC分泌MCP-1水平比较 表1显示,LPS可促进CBMC MCP-1的分泌。6 mg/dl浓度的胆红素单独即可抑制CBMC MCP-1的分泌。先经不同浓度(2.5、6、9、12.9和18 mg/dl)胆红素孵育,CBMC MCP-1的分泌受到不同程度的抑制,再接受LPS刺激,不能纠正胆红素的这种抑制作用。
2.2.2 CBMC分泌MCP-1水平与胆红素浓度的直线相关分析 CBMC分泌MCP-1水平与胆红素浓度呈负相关(r=-0.761,P<0.05);即随胆红素浓度升高,胆红素对CBMC分泌MCP-1水平的抑制作用越明显。
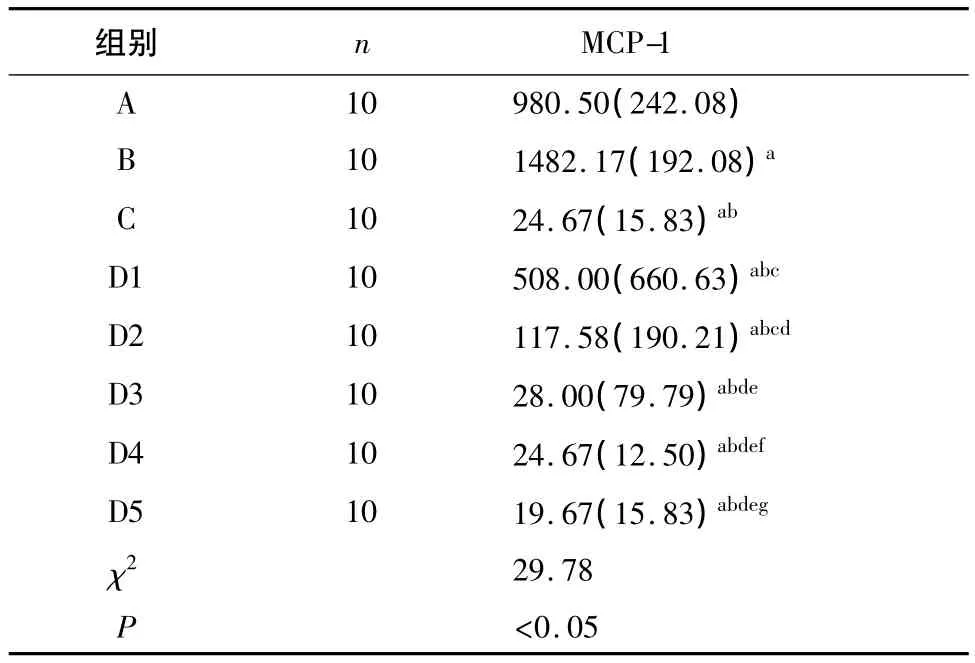
表1 不同浓度胆红素与LPS共同作用后CBMC分泌MCP-1水平比较 [pg/ml(%)]
2.3 CBMC分泌IL-12水平的比较
2.3.1 不同浓度胆红素与LPS共同作用后CBMC分泌IL-12水平比较 表2显示,LPS单独作用可促进CBMC IL-12的分泌。胆红素单独作用可抑制其分泌IL-12,当胆红素为6 mg/dl时,这种抑制作用已经存在。先经不同浓度(2.5 mg/dl、6 mg/dl、9 mg/dl、12.9 mg/dl、18 mg/dl)胆红素孵育,CBMC IL-12的分泌受到不同程度的抑制;再接受LPS刺激,可促进低浓度(2.5 mg/d和6 mg/dl)胆红素孵育后的CBMC IL-12的活化恢复,高浓度(12.9 mg/ dl和18 mg/dl)胆红素孵育后的CBMC IL-12的活化仍然受抑制,当胆红素浓度由12.9 mg/dl上升至18 mg/dl时,IL-12的分泌受抑制程度的差异,差异无统计学意义(P>0.05)。

表2 不同浓度胆红素与LPS共同作用后CBMC分泌IL-12水平比较 (pg/ml)
2.3.2 CBMC分泌IL-12水平与胆红素浓度的直线相关分析 CBMC分泌IL-12水平与胆红素浓度呈负相关(r=-0.748,P<0.01)。结合D1~D5组区组的秩和检验结果可知,随胆红素浓度升高,对CBMC分泌IL-12的抑制作用越强。
2.4 CBMC分泌MCP-1和IL-12水平的相关分析 结果显示,CBMC分泌MCP-1和IL-12水平呈正相关(r=0.653,P<0.05),即在相同浓度的胆红素作用下,CBMC分泌MCP-1的水平随IL-12水平的增高而增多。
3 讨论
MCP-1是趋化因子CC亚家族中的一员,由不同类型的免疫和非免疫细胞分泌而成,对多种细胞均有趋化作用,可以引起单核巨噬细胞胞浆内游离钙水平升高、呼吸暴发、粘附分子的表达、溶酶体酶及超氧阴离子的释放并促使组织因子和促炎细胞因子的生成[4,5]。单核巨噬细胞是产生IL-12的主要细胞,IL-12能够促进幼稚辅助性T淋巴细胞(Th0)向Th1细胞发展,促进Th1细胞IL-12Rβ2链的表达,促进Th细胞因子特别是干扰素-γ(IFN-γ)的合成和分泌,介导细胞免疫应答。IFN-γ又可诱导巨噬细胞的活化,这样就产生以细胞因子 IL-12和IFN-γ为代表的细胞因子与免疫细胞之间以免疫增强循环,在保持机体的免疫功能方面发挥重要作用[6]。胆红素的结构及理化性质是其产生细胞毒性的基础。未结合胆红素具有亲脂性,分子量小,呈可超滤性,容易透过不同组织的脂性细胞及细胞内细胞器的膜相结构,导致质膜脆性增加、膜磷脂损失和膜脂成分改变,进而引起细胞损伤[7]。
本研究通过体外培养CBMC,经胆红素和LPS孵育处理后,采用ELISA检测MCP-1和IL-12的水平。结果表明:LPS可促进CBMC分泌MCP-1和IL-12。胆红素可抑制CBMC分泌MCP-1和IL-12,随胆红素浓度的升高,这种抑制作用越明显。其中低浓度(2.5 mg/d和6 mg/dl)胆红素孵育后,再接受LPS的刺激,CBMC IL-12的分泌能力可以部分恢复,MCP-1的分泌水平恢复不明显。当胆红素浓度≥12.9 mg/dl时,MCP-1和IL-12的水平均不能恢复。
胆红素抑制CBMC分泌MCP-1和IL-12的机制可能为:①胆红素在生物膜积聚与沉积,扰乱膜结构,通过抑制线粒体酶(如苹果酸脱氢酶)随后影响线粒体功能,引起能量代谢紊乱,导致细胞损伤,从而引起分泌的减少[8,9]。②有研究表明,机体可以通过活化Toll样受体4(TLR4)信号转导通路并以NF-κB依赖的途径促进黏附分子ICAM-1等,分泌趋化因子MCP-1,IL-8等,还可以通过活化该途径活化单核巨噬细胞,促进其分泌IL-12,肿瘤坏死因子-2、TNF-α等炎症性因子和细胞因子[10]。本课题组前期研究表明,高浓度胆红素可抑制单核细胞NF-κB活化,降低单核细胞表面分子TLRs的表达,故胆红素可能通过抑制单核细胞NF-κB活化[11],降低TLRs的表达[12],从而影响MCP-1和IL-12的分泌。③电镜下,胆红素孵育的单核细胞变为黄色锯齿状,细胞内细胞器肿胀,形成空泡,引起核浓缩、核碎裂、核溶解等细胞坏死性改变[13]。推测胆红素抑制MCP-1和IL-12分泌的机制为其破坏细胞膜及细胞核,引起细胞坏死,抑制信号传导通路,最终导致其合成受阻,分泌减少。④胆红素可引起细胞凋亡增多[14],最终导致细胞因子分泌减少。
研究提示,胆红素进入细胞后,可通过线粒体膜上氧化酶氧化而被清除[15],这就说明,当细胞处于低浓度胆红素中时,虽线粒体有一定程度抑制,但功能尚存在,仍能清除部分胆红素。然而当胆红素浓度升高到一定程度(12.9 mg/dl),对细胞的毒性作用已经很明显,表现为细胞膜、核膜被破坏、细胞核碎裂[13],严重影响了细胞功能,导致线粒体功能障碍,无法清除,故由12.9 mg/dl上升至18 mg/dl时,对CBMC的活化抑制作用并没有进一步增强。
综上所述,胆红素的细胞毒性显而易见,浓度过高可显著抑制免疫系统,可能是高胆红素血症患儿易并发感染的原因之一。究竟在哪一个浓度范围内的胆红素会在人体中发生毒性作用,目前尚无明确的界限。因此,临床工作者应在积极降低血中胆红素水平的同时,如何阻止胆红素损伤细胞功能,是有待进一步深入研究的课题。
[1]Shahab MS,Kumar P,Sharma N,et al.Evaluation of oxidant and antioxidant status in term neonates:a plausible protective role of bilirubin[J].Mol Cell Biochem,2008,317(1-2):51-59.
[2]Vaz AR,Delgado-Esteban M,Brito MA,et al.Bilirubin selectively inhibits cytochrome coxidase activity and induces apoptosis in immature cortical neurons:assessment of the protective effects of glycoursodeoxycholic acid[J].J Neurochem,2010,112:56-65.
[3]Freundlich B,Avdalovic N.Use of gelatin/plasma coated flasks for isolating human peripheral blood monocytes[J].Immunol Methods,1983,62(1):31-37.
[4]Mukaida N,Harada A,Matsushima K.Interleukin-8(IL-8)and monocyte chemotactic and activating factor(MCAF/MCP-1),chemokines essentially involved in inflammatory and immune reactions[J].Cytokine Growth Factor Rev,1998,9(1):9-23.
[5]Meng L,Wu Z,Wang Y,et al.Differential impact of CD154 costim ulation blockade on alloreactive effector and regulatory T cells in murine renal transplant recipients[J].Transplantation,2008,85(9):1332-1338.
[6]Elif Arioglu Oral,Edward D Javor,Li Ding,et al.Leptin replacement therapy modulates circulating lymphocyte subsets and cytokine responsiveness in severe lipodystrophy[J].J Clin Endocrinol Metab,2006,91:621-628.
[7]Falcao AS,Silva RF,Pancadas S,et al.Apoptosis and impairment of neurite network by short exposure of immature rat cortical neurons to unconjugated bilirubin increase with cell differentiation and are additionally enhanced by an inflammatory stimulus[J].J Neurosci Res,2007,85(6):1229-1239.
[8]Watchko JF.Kernicterus and the molecular mechanisms of bilirubininduced CNS injury in newborns[J].Neuromolecular Med,2006,8 (4):513-529.
[9]Oakes GH,Bend JR.Early steps in bilirubin-mediated apoptoses in murine hepatoma(Hepa 1c1c7)cells are characterized by aryl hydrocarbon receptor-independent oxidative stress and activation of the mitochondrial pathway[J].J Biochem Mol Toxicol,2005,19(4):244-255.
[10]Ma Y,Temkin V,Liu H,et al.NF-κB protects macrophages from lipopolysaccharide-induced cell death:the role of caspase8 and receptor-interacting protein[J].J Bio Chem,2005,280(51):41827-41834.
[11]陈敏,陈昌辉,刘会领,等.胆红素对新生儿脐血单核细胞NF-κB表达的影响[J].中华临床医师杂志,2012,6(3):635-638.
[12]刘会领,陈昌辉,陈敏,等.胆红素对新生儿脐血单核细胞表面分子Toll样受体4的影响[J].中国当代儿科杂志,2011,13(2): 153-156.
[13]裴雪梅,陈昌辉,牛会琴,等.不同浓度胆红素对新生儿脐血单核细胞形态结构的影响[J].医学研究生学报,2009,22(5):496-499.
[14]牛会琴,陈昌辉,裴雪梅,等.胆红素对新生儿脐血单核细胞凋亡的影响[J].中国小儿急救医学,2009,16(3):1-3.
[15]Ghersi-Eqea JF,Gazzin S,Strazielle N.Blood-brain interfaces and bilirubin induced neurological diseases[J].Curr Pharm Des,2009,15:2893-2907.

