蛙腿骨骼肌电机械兴奋的超声标测
孟庆国,尹立雪,郭智宇,岳文胜,白 艳,刘会若
(1.四川省医学科学院·四川省人民医院超声医学中心,四川 成都 610072;2.GE公司,四川 成都 610016; 3.川北医学院,四川 南充 637007;4.四川省妇幼保健院,四川 成都 610072;5.河南中医学院附属医院,河南 郑州 450003)
目前,心脏起搏再同步化治疗已成为心力衰竭非药物治疗的主要技术方法。国内外学者[1,2]已经对心脏单腔、双腔起搏、同步化起搏治疗效果进行了系列评价。各种起搏治疗均存在各自的不足之处,其原因主要是:起搏电刺激介导的电机械传导在时间和空间上与心脏生理性或基础状态最佳电机械传导时空顺序的不匹配,导致心脏电机械传导不恰当的重构,从而造成各种临床起搏治疗效果不佳或失败。因此,优化起搏位点、寻找最佳的起搏治疗方式以达到最接近生理状态心脏电机械兴奋过程依然是亟待解决的重要临床问题。本研究应用M型组织多普勒超声观测离体蛙腿骨骼肌在不同电刺激方式下电传导时间、电机械延迟时间和机械收缩传导时间的变化差异及其相关关系,旨在深入揭示电刺激与机械兴奋和电传导的时空变化规律,为临床优化心脏起搏治疗提供相关基础实验数据。
1 材料与方法
1.1 材料与仪器 实验材料:132只重量0.25~0.35 kg牛蛙,[(0.28±0.03)kg]。设备仪器:Acuson512彩色多普勒超声诊断仪,7v3c型心脏探头,发射频率为7 MHz;Lead2000多通道电生理仪(成都锦江电子,实际刺激电压范围为1~8V;刺激频率范围为1~999 ms);本实验电刺激参数分别设为电压1~5V,频率:电刺激间期为900 ms。
1.2 实验方法 室温下,将牛蛙断髓去皮、上肢和头后用大头钉固定躯干及下肢足部于干燥平面木板上。超声诊断仪心电信号导联线与固定躯干和下肢足部处的金属大头钉相连,记录电脉冲刺激信号;将自制电刺激导线(内径1 mm绝缘铜线)一端连接电生理仪发放电脉冲刺激信号线源,另一端刺入蛙大腿腹侧肌内(本实验中电极置入位置为蛙大腿中外侧,刺激肌群为股三头肌和缝匠肌。见图1)。发放电脉冲刺激前用手上下、左右微动电刺激导线,通过二维灰阶超声及彩色组织多普勒显像准确观察并确定导线头端位置。将超声探头通过支架固定于蛙大腿上方约1 cm(用轻薄纸巾围合医用耦合剂使超声探头与蛙腿保持稳定距离避免直接接触)以防止因操作者手疲劳抖动造成的图像采集失真。实验过程中,用生理盐水间断湿润蛙大腿骨胳肌,以延缓其生理功能丧失的速度。组织多普勒超声速度量程分别设定为0.009 m/s和0.11 m/s两级。采用M型组织多普勒采集图像时,目标扫描速度设为100 m/s。 Lead2000电生理仪发放电压以1 V为间距,从1 V开始逐步提高到5 V为止(改变刺激电压幅度采集图像,中间没有设定时间间隔)。参数设定后,进行单点单极电极和双点单极电极电脉冲刺激。M型组织多普勒超声分别取样刺激点1~2点和/或接收点3~4点(图2、图3),采集连续4个电脉冲刺激周期的图像,获取并测量以下参数:电机械延迟时间(t1)(图2)、机械收缩传导时间(t2)(图3)、机械收缩持续时间(Tm)及两电极点间电传导时间差(T) (图4)等,为减少测量误差,所有分析参数均为4个电脉冲刺激周期测量参数的均数。实验流程:①单点单极电极刺激,两电极位点相距2 cm。电刺激位点和探头置于1~2点时,观测电与机械传导延迟(t1)。探头移到3~4点,观测机械传导时间(t2)。②单点单极电极刺激,两电极位点相距2 cm,在两电极位点中间位点注入0.2 ml浓度75%的酒精,观察蛙大腿肌局部注射酒精部位颜色变白后,观测t2、T和Tm(图5)。③双点单极电极刺激,两电极位点相距3 cm,将探头固定于两电极点中点位置。于1~2位点和3~4位点同时发放电脉冲刺激,观测双点单极电极刺激方式下,t2以及Tm变化(图6)。

图1 a.箭头所指为超声确定电极头的位置;b.可以清楚观察到红色电脉冲信号从电极头处开始,M型组织多普勒取样线通过电极头处,获取所需时间测量参数同图7。

图2 单点单极电极刺激示意图 两电极点间距2 cm,(+)(1~2)点为电极脉冲发射点和探头位置,(-)(3~4)为电极脉冲接收点。t1:电机械延迟时间,Tm:组织多普勒M型纪录1~2点机械收缩持续时间。

图3 单点单极电极刺激示意图 两电极点间距2 cm,探头置于3~4点。t2:机械收缩传导时间,Tm:组织多普勒M型纪录3~4点机械收缩持续时间。

图4 电生理仪测量两电极点间时间(T) 黄色线为1~2点电脉冲发放点电位记录,绿色线为3~4点接收点电位记录:所测即为T值。 图5 注射酒精电机械传导阻滞后重复图3试验两电极位点中间位注射酒精后,1-2点发放电脉冲刺激信号,超声探头置于3~4点(接收点),观测t2和Tm

图6 双点单极电极刺激方式示意图 两电极位点分别距探头1.5 cm,两实线电极同时发放电脉冲刺激,观测t2和Tm。
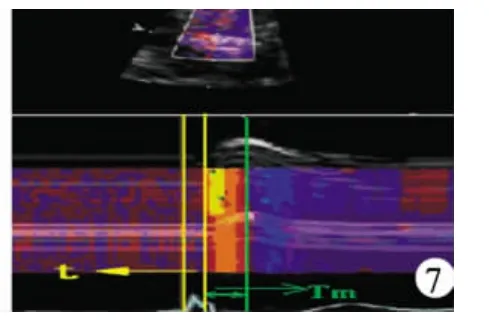
图7 实际测量t1、t2及Tm:黄色线为1~2点电脉冲发放点和接收点测量t1、t2方法;绿色箭头:Tm的测量方法
1.3 统计学方法 应用SPSS 13.0统计分析软件。所有参数均经过正态检验,计量资料以均数±标准差表示,各组组内各参数进行配对t检验,分析电、机械传导与刺激电压幅度改变间的差异及关联关系;各组组间采用独立样本t检验,比较刺激方式、刺激电压幅度改变对各时间参数的影响;同时对T、t1、t2及Tm进行Pearson双变量相关性分析,以确立电、机械收缩在时间和空间的关联关系。以上参数分析P<0.05为有统计学意义。
2 结果
2.1 单点单极电极组、双点单极电极组t1、t2的比较 各组组内:不同刺激电压,单点单极电极组和双点单极电极组刺激,t2差异无统计学意义 (P>0.05);t1总体趋势差异无统计学意义 (P>0.05),见表1,保持刺激距离、电压不变单纯把组织多普勒速度量程由低到高改变,t2差异有统计学意义(P<0.05)。各组组间:相同刺激电压,单点单极电极组和双点单极电极组刺激,t2总体上差异无统计学意义(P>0.05),见表2。①相同组织多普勒速度标尺且刺激电压幅度相同时,单点单极电极刺激t2与双点单极电极刺激t2之间比较,差异无统计学意义(P>0.05);不同组织多普勒速度标尺、相同刺激电压时,t1、t2差异均有统计学意义,表现为:降低组织多普勒速度标尺,t1和t2均明显延长(P<0.05),见表2。②相同组织多普勒速度标尺、刺激电极距探头相同距离情况下,单点单极刺激电压为1V和2V时,二者分别与不同电压的双点单极电极刺激相比较,双点单极刺激组随着刺激电压升高,t2相对单点单极组明显缩短(P<0.05),见表3。
2.2 Tm的比较 各组组内:生理状态下,Tm没有随着刺激电压幅度改变而出现明显的变化(P>0.05);各组组间:1~2点(刺激点)和3~4点(接收点)的Tm差异无统计学意义(P>0.05),见表4。
2.3 相关性分析 Tm与t1、t2间没有显著相关性(P>0.05),见表5、表6。T与t1、t2、Tm间没有显著相关性(P>0.05),见表7。
2.4 注射酒精前后对比 注射酒精前后,组织多普勒速度标尺设定为0.009 m/s时,t2出现明显统计学差异,表现为:注射酒精造成电机械传导阻滞后t2明显缩短(P<0.05),Tm没有明显的变化(P>0.05)。组织多普勒速度标尺设定为0.11 m/s时,注射酒精后t2没有明显的变化(P>0.05),Tm表现为明显延长(P<0.05),见表8、表9。

表1 单点单极电极在不同电压刺激下t1、t2比较 (ms)

表2 单点单极电极与双点单极电极刺激模式t2间比较 (ms)

表3 单点单极电极刺激与不同电压的双点单极电极刺激模式T2间比较 (ms)

表4 相同刺激电压下,刺激点和接收点间Tm的比较 (ms)

表5 不同刺激电压下,Tm与t1间的相关性分析

表6 不同刺激电压下,Tm与t2间的相关性分析
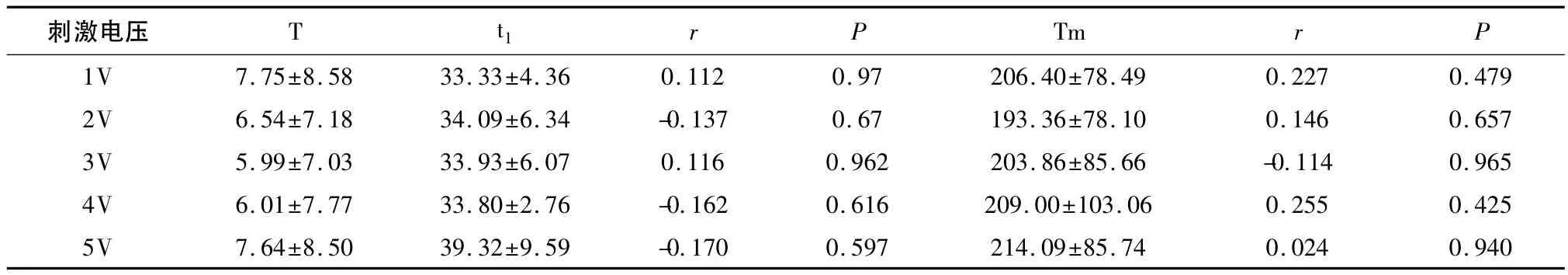
表7 T与t1、Tm的相关性分析
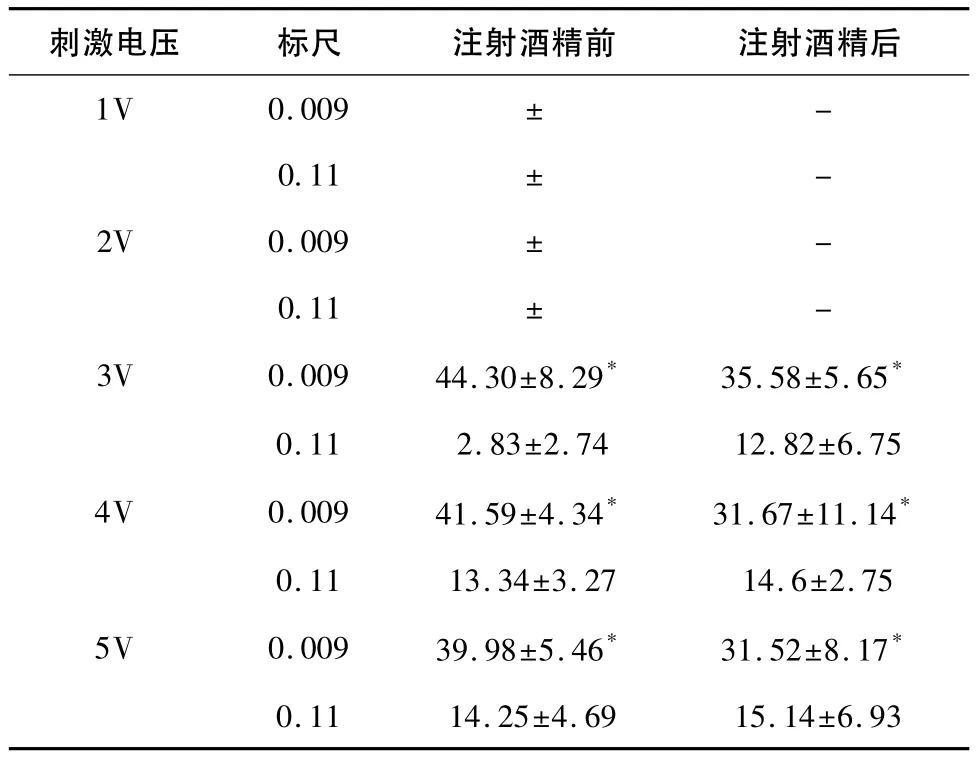
表8 t2注射酒精前、后自身对比 (ms)

表9 Tm注射酒精前、后自身对比 (ms)
3 讨论
不同类型肌纤维在收缩、电传导和收缩速度等方面存在明显差异。而不论何种肌纤维,电刺激与整体和局部肌纤维机械收缩发生和传导均必定存在着多种尚未完全认知的时空关联关系。此前,有Neher等[7~9]通过膜片钳技术、激光共聚焦技术、细胞内微电技术等方法对钙离子、膜电位变化和收缩偶联机制等微观方面进行了深入地研究。结果发现:钙火花兴奋-收缩偶联的关键环节。从钙火化产生至到达峰值,骨骼肌和心肌平均需时分别约为5 ms和10 ms。Yong-Jin[10]通过双向红外线探测器-计算机控制的电刺激与超低温快速冷冻固定同步技术发现蛙腿骨胳肌在受到电刺激后产生收缩约需时8 ms。以上研究均是在微观方面对电机械收缩加以阐释,而应用临床组织多普勒M型超声可视化技术手段观察骨骼肌电机械时空关系研究鲜有报道。
M型组织多普勒超声时间分辨率极高,每秒可达2000~4000帧以上,间期观察以个位数毫秒计,能区分和捕获组织运动时相的微小差异。本研究尝试应用可视化的M型组织多普勒超声观测离体蛙腿骨骼肌在不同方式、不同电压 电脉冲刺激下,t1、t2、T以及Tm的变化情况。试验中为了尝试剔除一些影响因素,从组织多普勒速度最低起逐步提高量程,当彩色混叠恰好和或彩色干扰消失,我们对超声仪器组织多普勒速度标尺设定了两种状态(彩色靶标标尺调为0.009和0.11)采集图像,以期捕获更多的研究信息。结果发现:组织多普勒速度标尺相同、电压相同,即使刺激电极点位置、方式改变时,电机械延迟时间、电机械传导时间以及机械传导时间等均没有明显的差异;在不同速度标尺的情况下,即使应用相同电压刺激,t1、t2也会明显出现明显差异。说明仪器参数的设定对研究观察结果有一定的影响;当组织多普勒速度标尺设为0.11时,得到的电机械延迟时间更接近10 ms,说明通过可视化组织多普勒超声技术可以观察并基本接近前面众多学者通过显微微观技术手段观测的结果。
我们首先采用单点单极电极刺激模式,并改变刺激电压幅度,结果发现:t1、t2和Tm均没有明显差异,说明骨骼肌细胞在发生动作电位后,机械收缩传导时间在一定的空间内传播没有明显的衰减,电机械传导延迟时间同样没有随着刺激电压改变而有所变化,也间接证实了细胞膜电位的全或无变化;细胞收缩传导与刺激电位强度的增加没有明显关联关系,即机械收缩传导时间并没有随着电压幅度的增大而加快。但改变电极刺激方式,采用双点单极电极刺激后,随着刺激电压的变化双点单极电极刺激导致肌纤维机械兴奋传导速度明显比单点单极电极刺激的快;说明肌纤维发生动作电位后,尽管肌肉收缩传导与刺激位点电压大小无关,但增加刺激位点(采用双点单极电极刺激模式)同时增加刺激电压幅度后,肌纤维机械兴奋收缩传导时间比单点单极刺激明显缩短。说明采用双点单极电极刺激t2明显缩短,是因为它相对于单点单极电极刺激t2是空间上矢量的叠加;但是,随着单点单极组刺激电压幅度的逐渐增大,这种差异性却又消失了。推测:这可能是因为当刺激强度过小时,不能引起肌肉发生收缩反应,此时为阈下刺激;逐渐增加刺激强度,收缩的幅度逐渐增大;当全部肌肉均发生最大收缩时,此时的最小刺激值为最适刺激;超过最适刺激之后,肌肉收缩的幅度不会再增大[11];亦可能是因为离体肌肉组织在持续电刺激下无氧做功,肌肉更容易发生疲劳,从而降低Na-K泵功能,泵功能的降低会影响肌肉的收缩峰值幅度[12,13];David等证实:机械引起的疲劳远小于电刺激引起的,所有感受器部位对刺激的反应效果不一致,1/3神经单位代谢率增加持续时间很短,刺激起始的潜伏时间的加速率与刺激强度成反比。从而出现上述在增大刺激电压t2反而没有差异性的结果。
我们采用组织多普勒加速度超声技术就已经观察了电刺激和心肌纤维收缩运动的时空关系,发现电-机械延迟时间约为7 ms[14]。这与前面所述研究[10]结果基本一致。为了更多了解当改变刺激电压后电机械的关联关系以及改变电刺激模式,电机械传导有无不同变化。结果发现:在相同刺激强度情况下,针对相同距离位置点,采用单点单极电极刺激与双点单极电极刺激并没有引起t2、Tm的明显改变。对T、t1、t2以及Tm的彼此相关性分析发现,单点单极电极组、双点单极电极组均没有建立起良好的相关性。前面我们业已证实:只要刺激引起蛙腿肌细胞发生动作电位后,即使提高刺激电压幅度,细胞间的电传导速度、电传导时间不发生改变;在传导距离不变的情况下,根据距离=速度×时间公式,得出肌肉收缩速度不发生变化(因为结果中t2和Tm没有发生明显的差异),因此也就未能在它们之间建立起良好的关联性;
在生理状态下,Tm于各组内及组间比较几乎为恒定不变,说明肌纤维细胞受到阈上刺激后,无论改变刺激电压还是刺激模式,动作电位产生的机械收缩运动产生力学效果不再发生改变;从而说明临床各种方式起搏治疗之所以没有取得预期疗效,很大程度取决于起搏器电极放置位置的不理想,未能使起搏电刺激介导的电机械传导在时间和空间上与生理性或病理状态最佳电机械传导时空顺序达到匹配。这就需要临床寻找一种刺激方式保证受损肌细胞在阈上刺激后能和周围正常肌细胞保持时间同步性,只有这样才能使电刺激产生的力学效果表现为最佳,也就是临床上所说同步性收缩。
试验中,我们亦尝试了在保证蛙腿骨骼肌新鲜状态下,在两电极点中点位置注射酒精人为造成电机械传导阻滞,采用以上同样刺激方式观察T、t1、t2和Tm。结果发现,刺激电压为1V和2V时,M型组织多普勒超声未能观察到机械收缩传导信号,提示:注射酒精后,蛙大腿肌细胞内环境被改变或破坏,甚至导致部分肌细胞丧失了动作电位,结果电产生机械传导信号敏感性降低或者被阻断;当刺激电压升高到3V以上时,才出现机械收缩波信号。并发现:较低多普勒速度标尺下的t2与未施加干预条件下前的蛙腿肌纤维电刺激比较出现明显差异,表现为注射酒精造成电机械传导阻滞后t2明显比注射酒精前生理状态下的要缩短。有实验[15]表明只要处于恒流源所形成的电场下,有肌肉收缩就一定有肌组织的阻抗变化,二者同步发生,收缩越强,阻抗变化亦越大;各单元的收缩越同步,阻抗变化越大。当局部肌组织损伤后,首先直接破坏了兴奋得传递,因而影响了整体肌收缩的同步性。同步性降低,阻抗变化越小,那么相同距离情况下电传导时间就相对长。而提高多普勒速度标尺后,这种差异性又消失了。这个现象通过Wood等[16]提出的假说似乎可以解释:除了细胞外钙离子内流以外,细胞内贮存点相结合的和动作电位释放的钙离子量,是收缩力的主要决定者。在动作电位复极化的当时和以后,钙离子再结合到细胞内贮存点的过程按指数速率下降。结合的钙离子量决定着细胞收缩幅度的变化,随着不断的刺激再结合的钙离子减少就越明显,收缩幅度降低就会明显。那么在收缩幅度降低的情况下提高多普勒速度标尺,低速信息是否就会被漏掉,结果造成缩短的t2没有表现出来,这还需要进一步实验证实。同时,实验中发现Tm和t2出现完全相反的状况:在较高多普勒速度标尺的情况下,注射酒精后Tm明显比注射前延长。这可能是因为正常肌细胞在传导电兴奋产生收缩时逐步、逐个兴奋临近细胞的,注射酒精前两个电极点间是没有“障碍”存在的,兴奋可以沿细胞间连接直线直接传导过去;而注射酒精后,电传导兴奋产生收缩则不能直接通过,它要使接收点观察到电机械兴奋则只能绕过“障碍”,从旁边正常细胞传导过去;再有部分细胞功能受到影响后,除极时钙离子较慢地释放至收缩结构(引起缓慢激活)和复极时钙离子下降速度缓慢(引起缓慢舒张)[17]。故注射酒精后Tm出现延长。还有一种可能是因为蛙腿暴露时间相对较长,在持续电刺激下,肌肉出现疲劳,导致骨骼肌收缩和舒张能力的下降。代谢产物在肌细胞内大量堆积,从而导致运动单位动作电位的传导速度减慢[18,19]。当然这只是推测,尚需今后进一步试验研究证实。
本研究的不足之处:为了在探头与蛙腿肌肉表面间排除空气干扰,人为增加的耦合剂具有一定重量,可能造成骨骼肌前负荷的差异;每次选择刺激点与蛙腿骨骼肌纤维走向可能存在差异等。
总之,本研究只是初步对蛙腿肌纤维在电刺激下,通过高帧频M型组织多普勒超声观察电、机械收缩传导和机械收缩功能在时间上的一些差异以及二者的相关性,为今后临床进一步改进心脏起搏治疗研究提供了基础实验数据。
[1]LecLercq C,VicTor F,Alonso C,et al.Comparative effects of permanent biventricular pacing for refractory heart failure in patients with stable sinus rhythm or chronic atrial fibrillation[J].Am J Cardiol,2000,85:1154-1159.
[2]SaKsena S,Prakash A,Madan N,et al.Prevention of atrial fibrillation by pacing in:Barold ss,M ugicu J,eds recent advances in cardiac pacing[M].New York:future publishing company,1998:101-114.
[3]Askenazi J,Alexand JH,Koenighserg DI,et al.Alteration of left ventricular performance by left bundle branch block stimulated with atrio-ventricular sequential pacing[J].Am J Cardiol,1984,53:99-104.
[4]Cirnes CL,Bashor TM,Boudoulas H,et al.Functional abnormalities in isobated left bundle branch block:the effect of inter-ventricular asynchrony[J].Circulation,1989,79:845-853.
[5]Lupi G,Brignole M,Oddone D,et al.Effects of left ventricular pacing on cardial performance and on quality of life in patients with drug refractory heart failure[J].Am J Cardiol,2000,86(11):1267-1270.
[6]Morris Thurgood JA,Turner MS,Night-Ngale AK,et al.Pacing in heart failure:improved ventricular interation in diastole rather than systolic-syschronization[J].Euro Pace,2000,2(4):271-276.
[7]Neher E.Ion channels for communication between and with in cell[J].Neuron,1992,(8):605-612.
[8]Cheng-Zhi N.Immunoblotting observation on changes of myosin degradation metabolism in toad gastrocnemius muscle electric stmulation under simulated exercise load[J].Space Medicine&Medical Engineering,1999,12(6):426-430.
[9]赵婷,魏胜,方华强.钙火花研究进展和展望[J].生物物理学报,2007,23(4):265-274.
[10]Yong-Jin Y,Chang-Hai L,Yue-W.Study on the instant changes of ultrastructural morphological during excitation-contraction coupling in skeletal muscles[J].A Cad J Sec Mil Med Univ,1999,20(3): 151-153.
[11]倪红.蛙类骨骼肌与心肌生理特性的比较研究[J].生命科学学院,2006,30(1):157.
[12]StorJnik V,Komi PV.Neuromuscular fatigue after maximal stretchshorting cycle exercise[J].J Apple physiol,1998,84:344-350.
[13]Clausen T.Na-K.Pump regulation and skeletal muscle contractility[J].Physiol,2003,83:1269-1324.
[14]Li-Xue Y,Chun-Mei L,Qin-Gue F.Ventricular excitation maps using tissue Doppler acceleration imaging:potential clinical application[J].J Am Coll Cardiol,1999,33:782-787.
[15]Zhao-Kang Y,Yi-Ming Z,Guo-Bao N.Changes of impedance during the contraction of isolated toad's gastrocnemius and its significance[J].Journal of the Fourth Military Medical University,1994,15(1):56-59.
[16]蒙卡斯尔.医学生理学[M].北京:科学出版社,1990.
[17]尹立雪.现代超声心脏电生理学[M].北京:人民军医出版社,2007.
[18]Jing-Guo ZH,Jin-Wen L.Effects of temperature on contractility of toad-gastracrmius muscle[J].Shandong TiYuKeJi(Shandong Sport Sci Technol),2002,24(3):36-37.
[19]Westerblad H,Allen DG,Lannergren J.Muscle fatigue:lactic acid or inorganic phosphate the major cause[J].News Physiol Sci,2002,17:17-21.
[20]Toru T,Jun S,Kazue M.Augmented mechanical response of muscle thin-fiber sensory receptors recorded from rat muscle-never preparations in vitro after eccentric contraction[J].J Neurophysiol,2005,94:2822-2831.
[21]David A,Joel DG.Peripheral coding of tonic mechanical cutaneous pain:comparison of nociceptor activity in rat and human phychophysics[J].J Neuraphysiol,1999,82:2641-2648.

