气相色谱法测定氨化水洗液中乙二醇的含量
朱 峰
(中国石油 化工股份有限公司 北京北化院 燕山分院,北京 102500)
对苯二胺合成氨化过程中,使用乙二醇作为悬浮剂,乙二醇兼具有催化和溶解作用。氨化液经过水洗后,除得到中间产品外,还有乙二醇的水溶液。如果将此液中的乙二醇回收利用,可使对苯二胺产品成本降低,从而提高经济效益,对工业化生产具有实际意义,所以分析氨化水洗液中乙二醇的含量是十分必要的。为此,要建立本方法为工艺提供必要的分析数据,协助判断是否值得回收利用。
有关乙二醇纯度和有机物中乙二醇分析方法报导较多,然而对水中乙二醇,或者说乙二醇与水混合物的分析方法未见报道。经过反复多次的试验探索,建立了切实可行的分析手段,并为工艺提供了可靠的分析数据。
1 实验部分
1.1 仪器及试剂
GC-14A气相色谱仪(日本岛津公司生产)。
乙二醇,乙醇均为分析纯,市售;苯(色谱纯);蒸馏水。
1.2 色谱条件
选择操作条件的原则:(1)要确保乙二醇、水两者能获得良好的分离;(2)是要使色谱柱能有较长的寿命和长期承担分析的性能[1]。更重要的是对实际样品分离分析能得到满足定量测量的色谱图,经过多次实验摸索,选择了以下操作条件进行分析。
GDX-101不锈钢色谱柱,10%聚乙二醇丁二酸酯(60~80目)长4m不锈钢色谱柱;柱温:165℃;热导检测器,检测器温度:220℃;汽化室温度:220℃,柱与检测器连接处温度:220℃,电流:140mA;H2总压:221.6kPa,H2分压(1):122.6kPa,H2分压(2):78.5kPa,进样量:0.1μL。
2 结果与讨论
2.1 色谱柱筛选
色谱柱是一根金属或玻璃管子,内装固定相(可以是表面积较大粒度较小的活性吸附剂或载体涂渍固定液)起分离作用。色谱柱是色谱仪的关键部分,混合物是否完全分离开取决于色谱柱。因此,柱子的筛选是一项重要的工作。实验初期首先选用聚乙二醇丁二酸酯色谱柱,经过进样测定,发现水和乙二醇的峰没有完全分开,并且拖尾很长,见图1。

图1 乙二醇含水样中的GDX-101柱色谱峰Fig.1 Ethylene glycol containing water sample in the GDX-101 column chromatographic peak
虽然聚乙二醇丁二酸酯色谱柱适合分析醇类,但是由于样品中水含量较大,用此柱分析大量水效果较差。于是选用GDX-101作固定相的色谱柱。GDX-101是高分子多孔微球固定相。这类固定相可以不涂固定液而直接使用,它对于含有-OH化合物皆具有相对低的亲和力[2]。另外这类固定相对水的保留值相当小,且因其分离顺序基本上是按分子量大小顺序出峰的,故分子量较小的水分子可以在一般有机物之前流出。故特别适于有机物中水的分析。
将固定相GDX-101填充入柱中,制备成色谱柱。并且,为了彻底除去填充物中的残余的、有挥发性的杂质,还需将其老化4~8h后才能进行分析工作。制备出的色谱柱是否有效,要看它是否在较短的分析时间内,将样品中所含的主要成分进行定量分离。经过进样分析,发现水和乙二醇峰完全分开,水峰不拖尾,见图2。

图2 乙二醇含水本中的GDX-101柱色谱峰Fig 2 Ethylene glycol containing water sample in the GDX-101 column chromatographic peak
由图1、2可见,GDX-101柱更适合分析乙二醇水溶液,是一根有效的色谱柱,故决定采用此柱作为分析柱。
2.2 校正因子的测定
由于定量分析的依据是被测组分的含量与响应信号成正比,但是同一种物质在不同类型的检测器上有不同的响应讯号,而不同的物质在同一种检测器上的响应值也不相同,直接用响应信号定量,必然会产生较大误差,因此,用校正因子对信号加以校正,但校正因子与检测器结构有很大关系,所以文献值在我们的仪器条件下是否适用,必须进行样品实测。
2.2.1 标准样品的配制 采用预先已经称好重量的梨形瓶,分别取0.2mL的水、0.2mL的乙二醇和0.2mL的苯(以苯为标准物)并分别称重,然后加入2mL的乙醇于瓶内待测。以同样的方法配制两个平行样 1#、2#。
用上述同样方法再分别称取0.4mL的水、0.4mL的乙二醇和0.4mL的苯(以苯为标准物)并分别称重,然后加入2mL的乙醇于瓶内待测。以同样的方法配制两个平行样3#、4#。
2.2.2 标准样品的测定和计算 在确定的操作条件下对混合样品进行测定,并按下式计算各组分的相对重量校正因子:
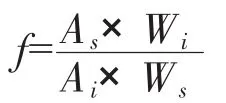
式中 f:相对重量校正因子;Wi和Ws分别为待测组分和标准物的重量;Ai、As:待测组分和标准物的色谱峰面积。将测得的水和乙二醇相对重量校正因子列于表1。

表1 乙二醇和水的重量校正因子的测定Tab.1 Ethylene glycol and water weight correction factor determination
由表1可以看出,测定的f值与文献值比较接近,故认为测得的f值是可信的。取平均值作为实验用值,即 f水=0.6,f乙二醇=1.4。
2.3 定性及定量方法
2.3.1 定性方法 采用标准物对照法进行定性分析。该方法的依据是:在一定(柱长、固定相)操作条件下组分有固定的保留时间。因此,控制条件一定,将标准物的保留时间与未知组分的保留时间进行比较,从而判定此未知物峰是否是此标准物[3]。于是分别注入乙二醇含水样品和乙二醇纯样及蒸馏水样,通过对照色谱峰的保留时间来定性,见图3、4。

图3 乙二醇样品在GDX-101柱色谱峰Fig.3 Ethylene glycol pure samples in the GDX-101 column chromatographic peak

图4 含水乙二醇的GDX-101柱色谱峰Fig.4 Ethylene glycol containing water in the GDX-101 column chromatographic peak
由图3可知,乙二醇峰的保留时间为4.655min,由图4看出2号峰的保留时间为4.65min,两峰的保留时间非常接近,故可确定2峰为乙二醇峰,峰1为水峰。
2.3.2 定量方法 面积归一化法是一种简便、准确的定量方法,其计算公式为:

式中 Wi%:i组分的百分含量;Ai:组分i的峰面积;fi:i组分的相对重量校正因子,按此公式可计算出各组分的含量。
2.4 准确度和精密度考察
在色谱分析工作中,分析人员的操作技术、进样器的质量操作条件的选择等对定量结果的准确性有影响,因此,必须进行精密度与准确度的考察。
2.4.1 精密度考察 精密度通常用标准偏差表示,公式为:

式中 ∑:总和;X拨:X的算术平均值;^2:二次方;Sqr:平方根;N:测量次数。
对配好的同一样品,在相同的操作条件下进行测定。用1μL微量注射器,每次进样0.1μL,进行测定,共测十次测得结果见表2。
由表2可以看出,标准偏差≤0.38,相对偏差≤2%。在误差允许范围内(气相色谱分析允许标准偏差小于2%~3%)。这样的精密度完全满足分析要求。
2.4.2 准确度考察 准确度取决于每一操作步骤精密度,通常用相对误差来表示。

表2 精度检验Tab.2 Precision inspection

准确称量一定量水、乙二醇、乙醇,配制成已知浓度的标准样品。用1μL微量注射器进样,每样进2次,测定相对误差见表3。

表3 精度检验结果Tab.3 Accuracy inspection results
由表3可以看出,相对误差<±0.18%,这样的准确度完全满足分析要求。
2.5 样品实测
对实际氨化水洗液中乙二醇的含量进行了测定,在GC-14A在上述色谱条件下,用面积归一化法测得1#样品和2#样品#中水和乙二醇含量,见图5、6 和表4。

图5 1#样的GDX-101柱色谱峰Fig.5 In the 1#sample GDX-101 column chromatographic peak

图6 2#样的GDX-101柱色谱峰Fig.6 In the 2#sample GDX-101 column chromatographic peak

表4 1#样和2#样中水和乙二醇的含量Tab.4 The 1#sample and 2#sample of water and ethylene glycol content
由图5、6和表4可知,乙二醇在实际氨化水洗液中所占比例是达到了30%~40%,故可以认为乙二醇具有回收价值。
3 结论
(1)采用GDX-101色谱柱对乙二醇含水样品进行测定,样品在该柱上能够得到良好的分离。两个主峰都已定性,完全能满足工艺要求。
(2)本方法简便分析速度快,重复性好,可随时为工艺提供数据。
(3)1#样品中,乙二醇含量39.37%,2#样品中乙二醇含量28.9%,工艺上认为乙二醇具有回收价值。
[1]何华倪昆仪.现代色谱分析[M].北京:化学工业出版社,2004.90-91.
[2]傅若农.色谱分析概论[M].北京:化学工业出版社,2005.45-51.
[3]史景江,马熙中,等.色谱分析法[M].北京:化学工业出版社1992.120-121.

