碱性成纤维细胞生长因子对人椎间盘细胞外基质合成及软骨调节素表达的影响①
李想,王以朋,洪毅,唐和虎,张军卫,白金柱,姜树东,王方永
碱性成纤维细胞生长因子对人椎间盘细胞外基质合成及软骨调节素表达的影响①
李想1,2,王以朋3,洪毅1,2,唐和虎1,2,张军卫1,2,白金柱1,2,姜树东1,2,王方永1,2
目的 研究碱性成纤维细胞生长因子(bFGF)对人椎间盘细胞基质合成能力以及血管生长抑制因子软骨调节素-1(ChM-1)表达的影响,为椎间盘退变的生物学治疗提供可供参考的生长因子。方法取4例因腰椎间盘退变性疾病而于本院行腰椎间盘切除手术患者的椎间盘组织,分别进行髓核和纤维环细胞培养及表型鉴定。取传代细胞继续培养1周后,向培养基中加入不同浓度的bFGF(0,0.1 ng/ml,1 ng/ml和10 ng/ml),72 h后收集细胞。采用Real-time RT-PCR检测各组细胞中Aggrecan和Ⅱ型胶原mRNA表达情况;同时利用Real-time RT-PCR和Western blot方法检测bFGF对ChM-1 mRNA和蛋白表达的影响。结果bFGF可明显抑制人椎间盘细胞外基质成分Aggrecan和Ⅱ型胶原mRNA的表达(P<0.05)。Real-time RT-PCR和Western blot方法均提示bFGF可抑制ChM-1的表达水平(P<0.05),并具有剂量依赖性。结论bFGF在发挥分解代谢功能的同时还具有潜在的促进血管生长作用。
椎间盘;碱性成纤维细胞生长因子;软骨调节素;退变;人
椎间盘退变的生物学机制较为复杂,一般认为椎间盘细胞活性的改变以及血管的浸润性生长在椎间盘退变的病理过程中发挥重要作用[1]。生物学治疗被认为是最有可能恢复椎间盘组织生物学功能的方法[2]。局部生长因子注射是近年来生物学治疗取得的最重要的进展。但如何选择合适的生长因子一直是有待解决的重要问题[2]。本研究拟通过观察碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)对人椎间盘细胞基质合成能力以及血管生长抑制因子软骨调节素-1(ChM-1)表达的影响,为椎间盘退变的生物学治疗提供可供参考的生长因子。
1 材料和方法
1.1 试剂及设备 5%FBS:GIBCO,美国;1×P/S:GIBCO,美国;DMEM/F12培养基:四环阳生,北京;Ⅱ型胶原酶:SIGMA,美国;5%CO2培养箱:Thermo,美国;Ⅱ型胶原抗体:兔抗人多克隆抗体,武汉博士德公司;bFGF:PeproTech,美国;TRIzol: Invitrogen, 美 国 ; TaKaRa SYBR®Premix Ex Taq™ II(Perfect Real Time)试剂盒(日本);ChM-1一抗:ABCOM,鼠抗人LECT-1,美国;微量加样器:Eppendorf德国;定量PCR仪:ABI7500,美国。
1.2 细胞准备及培养 腰椎间盘取材于4例因腰椎间盘退变性疾病而在本院脊柱外科行椎间盘切除手术的患者,患者30~57岁,平均45岁,术前均签署知情同意书,并经本院伦理委员会审查通过。细胞培养按Kluba等[3]的方法,具体如下:
椎间盘切除后放入装有生理盐水的无菌离心管中,冰盒内保存,立即带回实验室。在严格无菌条件下将椎间盘组织中的胶冻样结构与纤维样结构分开,利用Hank's液清洗3遍。分别将髓核和纤维环组织剪成约1 mm3小块后转移到50 ml离心管中。在离心管中加入含1×P/S、5%FBS、Ⅱ型胶原酶(消化髓核组织的浓度为0.025%,消化纤维环的浓度为0.04%)的DMEM/F12培养基50 ml,于37℃振荡消化过夜。消化后的液体经75 μm滤网过滤,除去组织残渣。过滤后的液体以1000 r/min的速度离心5 min,弃上清,加入含1×P/S、10%FBS的DMEM/F12培养基,吹打均匀后以5×103/cm2的密度将细胞转到25 cm2细胞培养瓶(Corning)中,在37℃、5%CO2培养箱中培养。纤维环细胞约3 d可大部分贴壁,髓核细胞需5 d方可大部分贴壁。贴壁后每周换液2次。
1.3 椎间盘细胞表型鉴定 将细胞制成细胞爬片,待细胞达到80%~90%融合时将细胞爬片取出,4%多聚甲醛室温固定20 min,漂洗后用3%双氧水室温30
m
in以封闭内源性过氧化物酶;每片滴加正常山羊封闭血清30 μl,37℃孵育30 min;滴加Ⅱ型胶原多克隆抗体(1∶100)4℃过夜;PBS冲洗后滴加适当比例稀释的生物素标记二抗,37℃孵育20 min;PBS冲洗后滴加辣根过氧化酶标记的链霉素,室温孵育20 min;PBS冲洗5 min,共3次,显色剂(DAB)显色,自来水冲洗,37℃烘干,梯度酒精脱水,二甲苯透明,中性树胶封片。镜下观察染色结果。
1.4 bFGF对椎间盘髓核细胞及纤维环细胞的刺激 在细胞初次培养2周后,利用0.25%的胰酶将细胞自25 cm2细胞培养瓶中消化下来,以低密度转移至6孔培养板中,每孔加入含1×P/S、10%FBS的DMEM/F12培养基进行培养。待细胞长至80%融合(约1周时间)后用不含血清的DMEM/F12培养基继续培养24 h后分成2组:对照组1孔,实验组3孔。对照组仅加入含0.5%FBS的DMEM/F12培养基,实验组3孔除加入上述培养液外还分别加入不同浓度(0.1 ng/ml,1 ng/ml和10 ng/ml)的bFGF进行刺激。72 h后收集细胞进行下一步实验。
1.5 Real-Time RT-PCR检测 RT-PCR检测基质相关蛋白的表达变化。按照TRIzol说明书提取细胞总RNA。采用TaKaRa SYBR®Premix Ex Taq™Ⅱ试剂盒,构建25 μl PCR反应体系,参照说明书推荐的反应条件,进行两步法Real-time PCR检测,以GAPDH作为内参。具体为:94℃5 min预变性,94℃30 s、60℃ 30 s、72℃ 60 s,30个循环,最后72℃延伸5 min,降温至4℃,用于琼脂糖电泳或-20℃保存。见表1。Real-Time RT-PCR结果分析采用2ΔΔCT相对定量分析方法。最终结果表示为相对于对照组(其表达量作为100%)表达水平的百分比,即实验组目的基因相对于对照组目的基因的表达倍数。
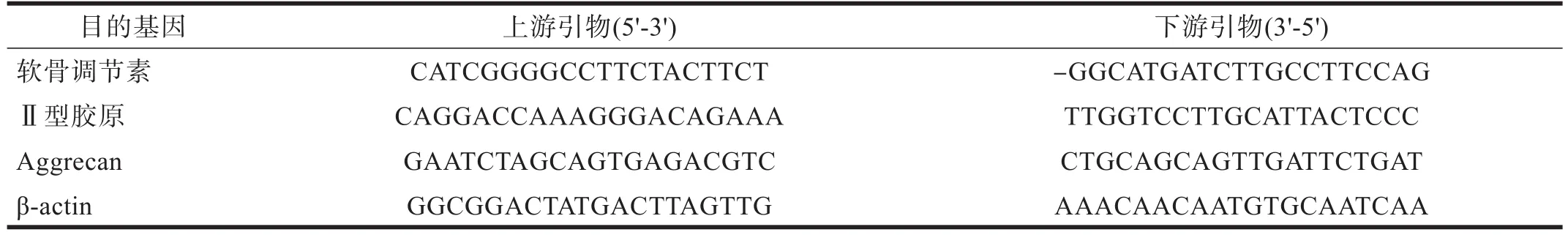
表1 引物序列
1.6 Western blot 用细胞裂解液溶解(2%SDS,2 mmol/L EDTA,2 mmol/L phenylmethylsulphony,50 mmol/L Tris-HCl,pH 6.8)处理细胞,使用改进的Lowry法测定蛋白浓度,加入上样缓冲液后煮沸4 min,取50 μg蛋白样品在含0.1%SDS的13%聚丙烯酰胺胶中进行电
泳
,将样品通过电转移的方法转移到PVDF膜上,膜用含5%低脂奶粉的TBS-Tween溶液洗涤封闭,加入ChM-1一抗(1∶50),加入HRP偶联的二抗(Santa Cruz Biotechnology),曝光,保存。用图像分析系统计算条带的灰度×面积值。各组ChM-1条带值同相应的β-actin条带值的比值表示目的蛋白的表达水平,实验重复3次。
1.7 统计学分析 用SPSS 13.0软件进行分析,各组间先进行方差齐性分析,符合方差齐性后再采用t检验
进行两两比较。显著性水平α=0.05。
2 结果

图1 椎间盘细胞体外培养及表型鉴定
2.1 椎间盘细胞体外培养及表型鉴定 镜下见细胞主要呈现两种表现,多角形和梭形。其中髓核细胞以多角形多见,而纤维环细胞以梭形多见,但两组细胞在整体上形态差别不大。Ⅱ型胶原免疫染色结果显示,髓核和纤维环细胞均可见阳性表达,胞浆呈棕黄色,胞核蓝色,髓核细胞较纤维环细胞染色稍深,但两者在整体上差别不大。见图1。
2.2 bFGF对Aggrecan、ChM-1和Ⅱ型胶原mRNA表达水平的影响 bFGF作用于椎间盘细胞可使细胞内出现明显的空泡样改变,这种变化在高浓度bFGF中表现尤为明显。说明高浓度bFGF可使细胞出现明显空泡样改变。见图2。

图2 不同浓度bFGF刺激后的椎间盘细胞形态学改变(100×)
Real-Time RT-PCR结果显示,在利用不同浓度的bFGF作用于椎间盘细胞后可明显下调Aggrecan、ChM-1和Ⅱ型胶原mRNA的表达(P<0.05),且具有浓度依赖性。见表2。
2.3 bFGF对ChM-1蛋白表达水平的影响 Western blot结果显示,各组细胞内均可发现ChM-1蛋白表达。在利用不同浓度的bFGF作用于椎间盘细胞后可明显下调椎间盘细胞中ChM-1蛋白表达水平,且具有浓度依赖性(P<0.05)。见图3和表3。

图3 bFGF对ChM-1蛋白表达影响的Western blot结果

表2 不同浓度bFGF对椎间盘基质相关蛋白mRNA表达影响的Real-Time RT-PCR结果

表3 bFGF对ChM-1蛋白表达影响的Western blot结果
3 讨论
虽然椎间盘退变的病理过程较为复杂,但一般认为椎间盘细胞增殖下降以及血管的浸润性生长在椎间盘的病理过程中发挥了重要作用[1]。
bFGF是一种肝素结合多肽,广泛存在于各种组织中。其在软骨以及椎间盘退变中所发挥的作用历来受到重视。Tolonen等利用免疫组化方法研究16例椎间盘源性腰痛患者中各种生长因子的表达情况,结果发现与正常椎间盘组织相比,bFGF表达明显增高,且其主要分布在纤维环前层软骨样细胞内[4]。Peng等通过对椎间盘源性腰痛患者的椎间盘组织进行研究后返现,与正常椎间盘组织相比,椎间盘源性腰痛患者椎间盘组织中可见新生血管肉芽组织子纤维环外层向髓核组织生长[5]。在肉芽生长区可见大量的巨噬细胞,并可见bFGF和转化生长因子(TGF)-β1以及其受体的明显表达,而非肉芽生长区上述表现并不明显,提示bFGF和TGF-β1以及其受体以及巨噬细胞可能参与纤维环损伤后的组织修复及继发的退变过程。局部产生的bFGF可刺激血管的生长和炎症因子的产生,加速基质成分的降解和椎间盘退变的发生。Pratsinis等研究发现,FGF2可通过激活ERK和Akt信号通路刺激椎间盘细胞的增殖[6]。Li等研究发现,与正常椎间盘组织相比,FGF2及其受体水平在椎间盘退变后表达升高,单层培养的髓核细胞在给予FGF2刺激后可刺激MMP-13 mRNA和蛋白的表达,具有剂量依赖性[7]。而在三维体系中培养的髓核细胞在给予FGF2刺激后可下调蛋白多糖的表达。进一步的研究显示FGF2可通过核因子(NF)-κB途径和有丝分裂原激活的蛋白激酶途径上调noggin,拮抗BMP7引起的蛋白多糖的合成。
本研究也得出了类似的结果,利用不同浓度的bFGF作用于单层培养的椎间盘髓核和纤维环细胞后可明显抑制基质相关蛋白Aggrecan和Ⅱ型胶原的合成。Aggrecan是细胞外基质中蛋白多糖的主要组成成分,具有维持椎间盘组织含水量,抑制血管、神经浸润性生长的作用[8]。其表达下降可为血管、神经的浸润性生长提供的环境,与患者椎间盘退变后腰部疼痛症状密切相关。椎间盘髓核组织中Ⅱ型胶原含量要明显高于Ⅰ型胶原,其表达下降可降低髓核组织的生物力学性能,影响椎间盘内部应力的分布,加重椎间盘退变[9]。由此可见bFGF在椎间盘退变过程中主要发挥抗合成代谢的作用。
除了椎间盘细胞活性下降外,血管的浸润性生长在椎间盘退变过程中也发挥了重要作用。伴随着血管的生长,局部会产生各种炎症介质,如IL-1、IL-6、TNF-α、CTGF等,加速椎间盘细胞的分解代谢,引起基质成分降解加速[10]。同时血管内皮细胞对感觉神经纤维的生长具有趋化和引导作用,导致退变后椎间盘组织内神经纤维的过度生长,与椎间盘源性腰痛患者的临床症状密切相关[11]。但也有研究显示,对于突出或脱出的椎间盘,血管的过度生长有利于椎间盘组织的吸收,减轻神经根的压迫[12-13]。
本研究虽未对bFGF的促血管生长作用进行直接研究,但发现bFGF可明显抑制椎间盘细胞中ChM-1的表达。ChM-1是一种Ⅱ型糖蛋白,其主要具有促进软骨细胞增殖,抑制血管内皮细胞生长的作用,在维持软骨、椎间盘、角膜等无血管组织的正常生物学功能方面发挥重要作用[14]。李想等利用免疫组化方法研究不同退变程度的椎间盘组织中ChM-1的表达情况,结果发现ChM-1在椎间盘退变后表达明显升高。考虑到血管生长在椎间盘退变中的作用,推测ChM-1可能作为一种防御机制参与了椎间盘退变的病理过程[15]。本研究结果显示,bFGF可明显抑制退变椎间盘细胞中ChM-1 mRNA和蛋白的表达,并具有剂量依赖性。提示bFGF在椎间盘组织中促进血管生长的作用可能与其抑制ChM-1的表达有关。
椎间盘退变是一种复杂的病理过程,参与其中的细胞因子众多,同时细胞因子之间的作用也是广泛而复杂。本研究结果仅说明bFGF和ChM-1之间可能存在某种程度的相互制约,而不能反应体内细胞因子间复杂网络环境下的真实情况。有关bFGF在椎间盘退变中的真正作用还需进行更为深入的研究。
[1]Leung VY,Tam V,Chan D,et al.Tissue engineering for intervertebral disk degeneration[J].Orthop Clin North Am,2011,42(4):575-583.
[2]Paesold G,Nerlich AG,Boos N.Biological treatment strategies for disc degeneration:potentials and shortcomings[J].Eur Spine J,2007,16(4):447-468.
[3]Kluba T,Niemeyer T,Gaissmaier C,et al.Human anulus fibrosis and nucleus pulposus cells of the intervertebral disc:effect of degeneration and culture system on cell phenotype[J].Spine(Phila Pa 1976),2005,30(24):2743-2748.
[4]Tolonen J,Gronblad M,Vanharanta H,et al.Growth factor expression in degenerated intervertebral disc tissue.An immunohistochemical analysis of transforming growth factor beta,fibroblast growth factor and platelet-derived growth factor[J].Eur Spine J,2006,15(5):588-596.
[5]Peng B,Hao J,Hou S,et al.Possible pathogenesis of painful intervertebral disc degeneration[J].Spine(Phila Pa 1976),2006,31(5):560-566.
[6]Pratsinis H,Kletsas D.PDGF,bFGF and IGF-I stimulate the proliferation of intervertebral disc cells in vitro via the activation of the ERK and Akt signaling pathways[J].Eur Spine J,2007,16(11):1858-1866.
[7]Li X,An HS,Ellman M,et al.Action of fibroblast growth factor-2 on the intervertebral disc[J].Arthritis Res Ther,2008,10(2):48.
[8]Johnson WE,Caterson B,Eisenstein SM,et al.Human intervertebral disc aggrecan inhibits endothelial cell adhesion and cell migration in vitro[J].Spine(Phila Pa 1976),2005,30(10):1139-1147.
[9]Roberts S,Evans H,Trivedi J,et al.Histology and pathology of the human intervertebral disc[J].J Bone Joint Surg Am,2006,88(Suppl 2):10-14.
[10]Studer RK,Vo N,Sowa G,et al.Human nucleus pulposus cells react to IL-6:independent actions and amplification of response to IL-1 and TNF-alpha[J].Spine(Phila Pa 1976),2011,36(8):593-599.
[11]Peng B,Chen J,Kuang Z,et al.Expression and role of connective tissue growth factor in painful disc fibrosis and degeneration[J].Spine(Phila Pa 1976),2009,34(5):178-182.
[12]Li X,An HS,Ellman M,et al.Action of fibroblast growth factor-2 on the intervertebral disc[J].Arthritis Res Ther,2008,10(2):48.
[13]Minamide A,Hashizume H,Yoshida M,et al.Effects of basic fibroblast growth factor on spontaneous resorption of herniated intervertebral discs.An experimental study in the rabbit[J].Spine(Phila Pa 1976),1999,24(10):940-945.
[14]Shukunami C,Hiraki Y.Chondromodulin-I and tenomodulin:the negative control of angiogenesis in connective tissue[J].Curr Pharm Des,2007,13(20):2101-2112.
[15]李想,王以朋,邱贵兴,等.软骨调节素在成人退变椎间盘中的表达[J].中华外科杂志,2011,49(7):631-635.
Effect of Basic Fibroblast Growth Factor on Synthesis of Extracellular Matrixc and Expression of Chondromodulin in Human Inter-vertebral Disc Cells
LI Xiang,WANG Yi-peng,HONG Yi,et al.Capital Medical University School of Rehabilitation Medicine,Department of Spine and Spinal Cord Surgery,Beijing Bo'ai Hospital,China Rehabilitation Research Center,Beijing 100068,China
ObjectiveTo investigate the effect of basic fibroblast growth factor(bFGF)on the synthesis of extracellular matrixc(ECM)and expression of chondromodulin in human intervertebral disc cells.Methods4 intervertebral discs(IVDs)obtained from patients in the treatment of disc degenerative disease were used for cell culture.The secondary generation of intervertebral disc cells were cultured for 7 days,then different concentration of bFGF(0,0.1 ng/ml,1 ng/ml,10 ng/ml)were added to the medium and treated for 72 hours.Real-time RT-PCR was used to detect the change of Aggrecan and typeⅡcollagen mRNA expression.The effect of FGF on the expression of ChM-1,a cartilage derived anti-angiogenic factor,was also used by means of Real-time RT-PCR and Western blot.ResultsReal-time RT-PCR showed that bFGF can significantly inhibit the expression of Aggrecan and typeⅡcollagen mRNA.Both Real-time RT-PCR and Western blot showed that the expression of ChM-1 was down-regulated by administration of bFGF with dose-dependent way.ConclusionbFGF serves primarily as a catabolic factor and induce the angiogenesis in the process of intervertebral disc degeneration.
intervertebral disc;basic fibroblast growth factor;chondromodulin;degeneration;human
[本文著录格式]李想,王以朋,洪毅,等.碱性成纤维细胞生长因子对人椎间盘细胞外基质合成及软骨调节素表达的影响[J].中国康复理论与实践,2012,18(6):539-543.
10.3969/j.issn.1006-9771.2012.06.012
1.首都医科大学康复医学院,北京市100068;2.中国康复研究中心北京博爱医院脊柱脊髓外科,北京市100068;3.中国医学科学院,北京协和医学院,北京协和医院骨科,北京市100730。作者简介:李想(1977-),男,辽宁葫芦岛市人,博士,主治医师,主要研究方向:脊柱外科、脊柱脊髓损伤。
R329.2
A
1006-9771(2012)06-0539-05
2012-02-27
2012-05-21)
·专题·

