小白菊内酯对胃癌耐药细胞株SGC-7901/DDP增殖及药物敏感性的影响
李 华,张振铭,朱志图
(1辽宁医学院附属第一医院,辽宁锦州121000;2辽河油田第二职工医院)
胃癌术后对射线治疗不敏感,化疗成为综合治疗的主要措施,但胃癌多药耐药(MDR)的存在常导致化疗有效率降低,使其5年生存率<20%。如能对胃癌的MDR进行干预甚至逆转,对提高化疗疗效、延长患者生存期有重大意义。小白菊内酯(PN)是从传统药用植物小白菊中提取的有效成分。研究证实[1~3],其在体外实验中对多种肿瘤细胞具有抑制增殖和诱导凋亡的作用,还发现其能增强某些肿瘤细胞株对药物的敏感性[4],但在此领域的研究尚不深入。2011年12月~2012年8月,我们以胃癌耐药细胞株为研究对象,探讨NP对其增殖及药物敏感性的影响。
1 材料与方法
1.1 材料 PN(美国Sigma公司),顺铂(DDP,山东德州制药厂),RPMI 1640(美国 Sigma公司),SGC-7901/DDP胃癌耐药细胞株(南京凯基生物技术有限公司),MTT(Solarbio公司,NF-κB p65转录因子检测试剂盒(美国Chemicon公司),NF-κB p65的引物(上游引物5'-GGGAAGGAACGCTGTCAGAG-3',下游引物5'-TAGCCTCAGGGTACTCCATCA-3',目的片段369 bp)和内参照β-actin的引物(上游引物5'-GCATGGAGTCCTGTGGCAT-3',下游引物5'-CTAGAAGCATTTGCGGTGG-3',目的片段239 bp)、第一链cDNA合成试剂盒、PCR扩增试剂盒购自上海生工生物有限公司。
1.2 方法
1.2.1 细胞培养 将胃癌耐药细胞 SGC-7901/ ADM接种于含10%胎牛血清的RPMI 1640培养液中,在含5%CO2、37℃孵箱中培养至对数生长期。
1.2.2 PN对细胞增殖的影响观察 取对数生长期的细胞,制成单细胞悬液,调整细胞浓度为5×104/ mL,接种于96孔板中,每孔200 μL。培养至对数生长期后,用含不同浓度PN(0、5、10、20、40 μmol/L)的培养基处理细胞,其中0 μmol/L PN为对照组。分别培养24、48、72 h后收集细胞,采用MTT法检测PN对细胞的生长抑制作用,按试剂盒说明操作。细胞增殖抑制率=(1-处理组吸光度值/对照组吸光度值)×100%。
1.2.3 PN与DDP协同性观察 从1.2.1中得知,20 μmol/L的PN作用胃癌细胞24 h时,可明显抑制细胞增殖。再以20 μmol/L PN、5 μg/L DDP、10 μg/ L DDP、20 μmol/L PN+5 μg/L DDP、20 μmol/L PN +10 μg/L DDP作用于对数生长期的胃癌细胞24 h,以培养基为对照组,以MTT法测算细胞增殖抑制率。根据公式进行协同性判定,q=E(AB)/(EA+EBEA×EB)。EAB为联合处理的抑制率,EA、EB单用A、B药处理的抑制率,q<0.85两药拮抗,在0.85~1.15为作用单纯相加,>1.15有协同作用。
1.2.4 细胞中NF-κB p65 mRNA的检测 采用RT-PCR法。将细胞接种于6孔培养板中,继续培养至对数生长期,分别以培养基、10 μg/L DDP、20 μmol/L PN、20 μmol/L PN+10 μg/L DDP处理24 h,提取各组细胞总RNA;各取1 μg总RNA,一步法扩增成cDNA;取2 μL cDNA以NF-κB p65的上下游引物和内参照β-actin的上下游引物进行PCR扩增,反应体系25 μL。循环参数:94℃ 5 min,94℃30 s。58℃ 1 min,72℃ 45 s,共25个循环;再72℃10 min。PCR产物经2%琼脂糖凝胶电泳,紫外分析仪观察、照相,并用HPlSA 1000图文分析系统进行半定量分析,用NF-κB与β-actin条带的灰度比值表示NF-κB的相对表达水平。
1.2.5 细胞中NF-κB p65蛋白的检测 用Western blot法。接种与处理同1.2.4,收集细胞提取总蛋白,每孔上样60 μg蛋白;总蛋白经聚丙烯酰胺凝胶电泳(每孔60 μg蛋白)后转至硝酸纤维素膜后,于室温条件下封闭1.5 h;再分别用一抗杂交,4℃过夜,洗膜3次,每次10 min;再与稀释过的辣根过氧化物酶标记的二抗孵育1 h,洗膜3次,每次10 min。采用HPlsA 1000图文分析系统分析胶片,进行半定量分析(计算各条带的积分光密度值,以NF-κB p65蛋白条带的积分光密度值与对应内参照β-actin的积分光密度值之比作为目的蛋白的相对表达量)。
1.2.6 统计学方法 采用SPSS13.0软件。所得数据用±s表示,用t检验。以P≤0.05为差异有统计学意义。
2 结果
2.1 PN对胃癌细胞增殖的影响 随着作用时间的延长和药物浓度的增加,PN对胃癌细胞的抑制作用逐渐增强(P均<0.05),其中以20 μmol/L PN作用24 h时的抑制效应较明显。见表1。
表1 不同浓度PN对胃癌细胞增殖抑制率的影响(%,±s)
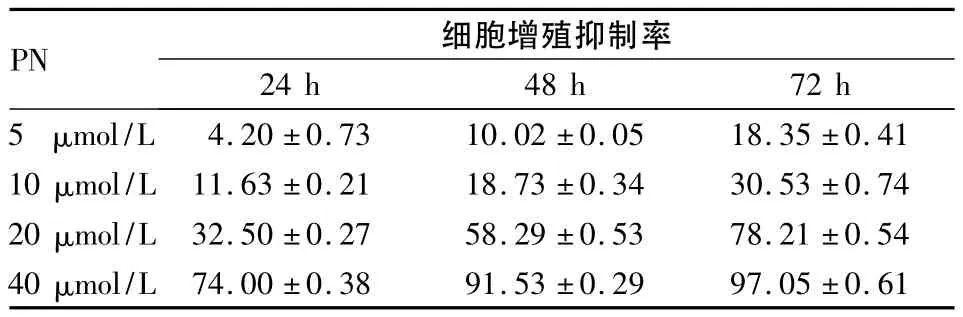
表1 不同浓度PN对胃癌细胞增殖抑制率的影响(%,±s)
24 h 48 h 72 h 5μ PN 细胞增殖抑制率mol/L 4.20±0.73 10.02±0.05 18.35±0.41 10 μmol/L 11.63±0.21 18.73±0.34 30.53±0.74 20 μmol/L 32.50±0.27 58.29±0.53 78.21±0.54 40 μmol/L 74.00±0.38 91.53±0.29 97.05±0.61
2.2 PN与DDP的协同性观察结果 20 μmol/LPN处理24 h后胃癌细胞增殖抑制率为32.50% ± 0.27%,5、10 μg/L DDP处理后分别为20.93% ± 0.15%、40.27%±1.04%20 μmol/L PN联合5、10 μg/L DDP处理后分别为 53.03% ±0.67%、77.96%±0.26%。根据公式判定 PN联合5、10 μg/L DDP的协同性,q分别为1.19、1.17,均 >1.15,表示而二者具有协同性。
2.3 胃癌细胞中NF-κB p65 mRNA及其蛋白检测结果 培养基、10 μg/L DDP、20 μmol/L PN、20 μmol/L PN+10 μg/L DDP处理24 h,胃癌细胞中NF-κB p65 mRNA分别为0.437±0.270、0.406± 0.253、0.371±0.394、0.301±0.316,NF-κB p65蛋白分别为0.695±0.115、0.672±0.067、0.452± 0.290、0.361±0.104,20 μmol/L PN+10 μg/L DDP与其他三者比较,P均<0.05。
3 讨论
MDR的存在是困扰肿瘤治疗的一个难题,也是影响肿瘤治疗疗效、甚至导致化疗失败的重要因素。目前使用的肿瘤MDR逆转化剂在体内达到有效浓度时所需的剂量过大,不良反应明显,因而限制了它们的临床应用。
目前,肿瘤MDR的研究约有30余年的历史,其中明确的途径如下:①MDR-1/P-gp的过度表达;②多药耐药相关蛋白(MRP)的过度表达;③肺耐药相关蛋白(LRP)对药物的胞吐作用;④细胞解毒系统和DNA损伤修复作用增强;⑤药物靶点在质和量上的改变,减弱药物的细胞毒性作用;⑥凋亡抑制基因(如Survivin、Bcl-2)表达提高及促凋亡基因(如Bax、Fas)表达的降低;⑦细胞外环境(pH、温度、氧浓度)的改变等;⑧其他与MDR相关的因子,如COX-2抑制剂物也产生交叉耐药。目前研究认为,肿瘤细胞的这种MDR是由多种因素综合作用造成的。
PN是从传统中药中提取的有效生物活性成分,不仅具有抗炎、抑菌、解痉作用,而且不良反应小。目前已经证实,PN在体内外实验中对多种肿瘤增殖具有抑制作用,如乳腺癌、白血病、胃癌、肝癌、胰腺癌、大肠癌、肺癌、前列腺癌、骨肉瘤等;进一步研究发现,PN的抗肿瘤作用主要是通过抑制转录因子NF-κB的活性和诱导凋亡实现的。NF-κB的激活参与了细胞生长调控、肿瘤的形成及MDR的形成,使其成为肿瘤治疗的潜在新靶点[5,6]。研究还发现,PN能增强某些肿瘤细胞株对药物的敏感性,如Riggins等[7]研究发现PN能增强乳腺癌抗雌激素耐药细胞株MCF-7对他莫昔芬、氟维司群的敏感性,其抗他莫昔芬机制与NF-κB调控AKT通路有关。Kim等研究发现,PN能通过抑制NF-κB的DNA聚集增强维甲酸对白血病HL-60细胞疗效。本实验中,PN能明显抑制胃癌耐药细胞株的增殖,抑制作用呈时间和浓度依赖性;PN与DDP联合组与单药组相比抑制作用更显著,经检验两者具有协同作用。通过RT-PCR检测证实PN可明显下调胃癌细胞的NF-κB p65 mRNA的转录水平,进一步通过Western blot检测发现PN+ DDP联合用药者组的NF-κB p65蛋白表达强度明显减少,明显少于PN、DDP单药组。本实验结果证实了小白菊内酯是NF-κB的抑制剂,能抑制胃癌细胞中NF-κB的表达;并且PN与DDP有协同抗肿瘤作用,PN能增强胃癌细胞株对DDP的敏感性,从而明显抑制肿瘤细胞的增殖,该作用可能与NP降低NF-κB的转录和蛋白表达有关。然而,小白菊内酯增强胃癌耐药细胞株对药物敏感性的分子机制还有待于进一步深入的研究。
[1]Wei W,Adachi M,Kawamura R,et al.Parthenolide induced apoptosis in multiple myeloma cells involves reactive oxygen species generation and cell sensitivity depends on catalase activity[J].Apoptosis,2006,11(12):2225-2235.
[2]LIU JW,CAI MX,XIN Y,et al.Parthenolide induces proliferation inhibition and apoptosis of pancreatic cancer cells in vitro[J].Exp Clin Cancer Res,2010,10(29):108-114.
[3]Kawasaki BT,Hurt EM,Kalathur M,et al.Effects ofthe sesquiterpene lactone parthenolide on prostate tumor-initiatingcells:an integrated molecular profiling approach[J].Prostate,2009,69(8): 827-837.
[4]Yip-Schneider MT,Nakshatri H,SweeneyCJ,et al.Parthenolide and sulindac cooperate tomediate growth suppression and inhibit the nuclear factor-kappaB pathway in pancreatic carcinoma cells[J].Mol Cancer Ther,2005,4(4):587-594.
[5]Sartelet H,Oligny LL,Vassal G.AKT parthway in neuroblastoma and its theropeutic implication[J].Expert Rev Anticancer Ther,2008,8(5):757-769.
[6]Ammann JU,Haag C,Kasperczyk H,et al.Sensitization of euroblastoma cells for TRAIL-induced apoptosis by NF-kappaB inhibition[J].Int J Cancer,2009,124(6):1301-1311.
[7]Riggins RB,Zwart A,Nehra R,et al.The nuclear factorκB inhibitorparthenolide restores ICI182,780(Faslodex;fulvestrant)-induced apoptosis inantiestrogen-resisitant breast cancer cells[J].Molecular Cancer Therapeutics,2005,4(1):33-41.

