KSRP:A Checkpoint for Inflammatory Cytokine Production in Astrocytes*
XUELIN LI,WEI-JYE LIN,CHING-YI CHEN,YING SI,XIAOWEN ZHANG,LIANG LU,5,ESTHER SUSWAM,LEI ZHENG,AND PETER H.KING,3,4,5
1.Department of Neurology,University of Alabama,Birmingham,Alabama;2.Department of Biochemistry,University of Alabama,Birmingham,Alabama;3.Department of Genetics,University of Alabama,Birmingham,Alabama;4.Department of Cell Developmental and Integrative Biology,University of Alabama,Birmingham,Alabama;5.Department of Veterans Affairs Medical Center,Birmingham,Alabama;6.Department of Neuroscience,Mount Sinai School of Medicine,New York,New York
星形胶质细胞(astrocyte,Ast)是中枢神经系统(central nervous system,CNS)的主要胶质细胞,在数量上是神经元的5倍以上。它们在CNS发挥着广泛的作用,包括对神经血管单元提供结构和营养支持、维持突触功能以及调控神经元可塑性等。此外,在诸如多发性硬化、肌萎缩侧索硬化、阿尔茨海默病和脑瘤等多种病理情况下,Ast亦在调节CNS炎性反应过程中扮演了重要角色。Ast可以生成许多细胞因子和趋化因子,吸引、激活或削弱包括小胶质细胞和外周淋巴细胞在内的其他免疫细胞。而这种分子多样性的一个重要调控水平是转录后调控。Ast分泌的细胞因子[如肿瘤坏死因子-α(tumor necrosis factor alpha,TNF-α)和白介素-1β(interleukin-1 beta,IL-1β)]的m RNA的3’-非翻译区(untranslated region,UTR)含有腺苷酸-尿苷酸富含元件(adenylate-uridylate-rich elements,ARE),可以直接调控转录本的稳定性和翻译效率。KH型剪切调控蛋白(KH-type splicing regulatory protein,KSRP)和其他腺苷酸-尿苷酸富含RNA结合蛋白(adenylate-uridylate-rich RNA-binding proteins,AUBP),如Hu抗原R(Hu Antigen R,HuR),可以同ARE相互作用,在转录后水平调控目标基因的表达。KSRP,又叫做远端上游元件结合蛋白2(far upstream element binding protein 2,FBP2),最初被发现是一种DNA结合蛋白,可以增强c-myc的转录。而后又被发现可以与3’-非翻译区的ARE结合,通过募集外泌体(exosome)促进m RNA的脱腺苷酸化和降解。本研究主要观察了KSRP-/-对Ast分子表型和细胞学表型的影响。笔者发现,KSRP-/-Ast显著高表达TNF-α和IL-1β等炎性介质。荧光素酶报告研究表明KSRP可在转录后水平,甚至转录水平发挥抑制作用。KSRP基因缺失可以诱导Ast产生一系列可溶性分子,从而进一步诱导Ast的趋化性和神经元的凋亡。本研究结果表明,KSRP是Ast炎性细胞因子表达的重要抑制因子。
1 材料与方法
1.1 质粒构建
p GL2-TNF-3’UTR和p GL2-Hel N1-promotor的构建方法如之前研究所述(King,1996;Nabors et al.,2003)。为获得pGL2-TNF(-655)、pGL2-TNF(-610)、pGL2-TNF(-122)及p GL2-TNF(-78),首先以p XP1-TNF(由Dr.Economou友情提供)为模板通过PCR的方法扩增人TNF-α启动子。该过程所用的引物为:TNF655-Fwd,5’-ATATATACGCGTATGAAAGAAGAAGGCCTGC-3’;TNF610-Fwd,5’-ATATATACGCGTATTTCACTCCCCGGGGCT-3’;TNF122-Fwd,5’-ATATATACGCGTTACCGCTTCCTCCAGATGA-3’;TNF78-Fwd,5’ATA-TATACGCGTG-TTTTCCGCTGGTTGAATGA-3’;TNF3-Rev,5’-ATATA-TCTCGATTGTGCCAACAACTGCCTT-3’。由Dr.Nagaoka(Juntendo University,Tokyo,Japan)友情提供的小鼠TREM-1启动子(154-21200)(Hosoda et al.,2011)被克隆入p GL2-Basic载体的MluⅠ/BglⅡ位点。包含核内不均一核糖核蛋白C(heterogeneousnuclear ribonucleoprotein C,hnRNP C)的质粒由Dr.Scott Blume赠送(University of Alabama at Birmingham)。pSV-b-galactosidase对照载体购于Promega公司。pcDNA3-FLAG-KSRP的构建方法如之前研究所述(Lin et al.,2007)。
1.2 细胞培养
分别从KSRP-/-小鼠和同窝出生对照组小鼠大脑皮质分离原代培养Ast。细胞培养至融合后,室温下用力摇晃3 h,然后室温下用胰酶消化至脱壁,并接种于6孔板内。Ast的纯度通过GFAP免疫荧光染色确定。RAW 264.7和N2a细胞根据说明书进行培养(ATCC)。
1.3 转染及荧光素酶检测
根据说明书通过电穿孔法(Invitrogen)转染Ast。每次转染,荧光素酶报告基因表达质粒的量保持恒定(1μg),而表达质粒则采取3种不同剂量(1、2、3μg)。每次转染的DNA总量与空pcDNA一致,保持恒定。在细胞复制时进行转染。报告质粒(针对N2A细胞,用0.2μg;针对RAW 264.7细胞,用0.5μg)、pcDNA3-FLAG-KSRP或pcDNA3-myc-hnRNP C(0.2~1.5μg)、以及SV40-b-ga-lactosidase质粒(0.2μg)用TransIT-LT试剂盒共转染(Mirus)。荧光素酶的活性用Promega的试剂盒通过酶标仪(Spectrafluor plus,Tecan U.S.)进行检测。根据文献报道的方法(Nabors et al.,2003),检测值除以β-半乳糖苷酶的吸光度值得到标准化值。
1.4 免疫印迹(Western blot)、RNA免疫沉淀和酶联免疫吸附试验(ELISA)
M-Per试剂盒(Pierce)进行全细胞总蛋白提取,BCA蛋白定量试剂盒测定蛋白浓度。将50μg总蛋白通过凝胶电泳按分子量大小进行分离,然后通过下列抗体对靶蛋白进行特异性检测:FLAG和a-tubulin抗体(Sigma);MYC、HuR、TIA-1和TIAR抗体(Santa Cruz);TTP抗体(Abcam);荧光素酶抗体(Millipore)。
在RNA免疫沉淀实验中,分别用1μg/m L脂多糖(lipopolysaccharide,LPS)或溶剂处理野生型Ast 24 h,然后用NE-PER(Pierce Endogen)抽提细胞质提取物。取200μg提取物进行免疫沉淀实验。再从沉淀物中提取RNA,定量PCR检测其含量。每个样本的初始总RNA含量亦通过定量PCR确定。
在ELISA中,Ast被接种于6孔板后,分别用LPS(1μg/mL)或TNF-α(10 ng/m L)处理。细胞培养上清液中的TNF-α、IL-1β及血管内皮生长因子(vascular endothelial growth factor,VEGF)的含量用ELISA进行检测(R&D系统)。检测值用培养基的体积进行标准化。同时提取细胞总RNA并定量,以保证每次检测中所用的细胞数量相同。
1.5 RNA抽提、定量、动力学及芯片分析
用RiboGreen试剂盒(Invitrogen)提取总RNA并定量。根据说明书,将1μg的RNA进行逆转录(Applied Biosystems)。再用商业化的引物和探针(Applied Biosystems)通过7900HT Fast实时荧光定量PCR系统进行定量PCR。靶mRNA值除以S9mRNA值得到标准化值。在RNA动力学分析研究中,首先用TNF-α(10 ng/m L)或脂多糖(1μg/m L)处理Ast 24 h。按照之前研究报道的方法检测半衰期(Lu et al.,2009)。在芯片研究中,将300 ng从KSRP-/-和野生型Ast中提取总RNA分别进行单芯片检测。接着用随机T7引物和逆转录酶进行线性扩增,制备双链cDNA。然后以3’扩增试剂(Affymetrix)为体外转录标记进行体外转录,合成生物素标记的cRNA,然后将cRNA片段化并准备杂交混合液。将整个检测体系45℃杂交过夜,第2天进行洗脱、染色及扫描。然后用Affymetrix Gene Chip Command Console软件读取基因表达水平数据。用GeneSpring v10.0中的robust multiaverage方法读取、标准化并总结芯片数据。
1.6 细胞迁移和神经元死亡检测
按照文献报道的方法(Ding et al.,2002;Tezel et al.,2001)进行细胞迁移检测。用玻连蛋白包被孔径为8μm的Transwell小室的下表面,37℃过夜。然后用含1%BSA的DMEM培养基37℃封闭1 h。胰酶消化原代培养的Ast,清洗后用迁移检测缓冲液按4×105细胞/孔的密度重悬(含1%BSA的DMEM及2 m M L-谷氨酰胺)。然后将100μL细胞悬液接种至细胞迁移小室,然后将小室放入预先加有Ast条件性培养基的24孔板中,37℃孵育。48 h后,小室下表面的细胞用4%的多聚甲醛固定10 min。清洗后,用1%的结晶紫染色15 min。显微镜下随机取8个高倍镜视野对迁移的细胞进行细胞计数,结果取3次独立实验结果的平均值。在细胞死亡检测中,将皮质神经元接种至预先加有含B27和0.5 m M的L-谷氨酰胺的neurobasal培养基的24孔板内。神经元培养7 d后,用新鲜培养基半量换液。然后用不同浓度的Ast条件性培养液处理神经元24 h。为检测神经元凋亡,首先用4%的多聚甲醛固定神经元,然后用1∶500半胱氨酸蛋白酶(caspase-3)抗体(Cell Signaling)孵育,之后用兔抗AlexaFuor 488二抗(Invitrogen)孵育。用尼康Eclipse TI显微镜进行观察,并计算阳性细胞比率(阳性细胞数/细胞核总数)。为观察细胞核破碎的情况,细胞染色质用DAPI进行染色,并根据细胞核的形态定量估计神经元活力。细胞核呈固缩或破碎状态的神经元被认为是无活力的神经元。每次实验取8个高倍镜视野计数有活性及无活性的神经元。
1.7 统计学分析
所有的数据用Graphpad Prism v.5软件进行t检验。
2 结果
2.1 KSRP-/-Ast TNF-α及IL-1β表达上调
在环境因素(如TNF-α)的刺激下,Ast可以产生大量TNF-α和IL-1β。因为这些炎性细胞因子mRNA的转录后调节主要是通过ARE来实现的,笔者着重研究了KSRP-/-基因型对Ast上述细胞因子表达的影响。由于各种AUBPs之间存在相互调节,本研究首先通过Western blot检测了Ast HuR、TIAR、TIA-1及tristetraprolin(TTP)蛋白的表达量,见图1。与预期结果一致,无论在基础状态还是激活状态(TNF-α刺激)下,与同窝出生对照组小鼠Ast相比,KSRP-/-Ast KSRP表达缺失;但是其他AUBPs表达量无统计学差异。本研究通过定量PCR分析基础状态和TNF-α激活后Ast TNF-α和IL-1βm RNA表达量,见图2。在对照组Ast,TNF-α刺激后,TNF-α和IL-1β的表达量上升(TNF-α为基础状态对照组小鼠Ast检测值的2倍,IL-1β为10倍);而在KSRP-/-Ast,无论在基础状态还是受到刺激后,其TNF-α和IL-1βmRNA表达量都更高(是对照组的2~2.5倍)(P<0.05)。KC(CXCL1)和VEGF mRNA的3’UTR区均含有ARE,但是KSRP-/-组和对照组这2种mRNA的表达量却没有明显差异,说明KSRP基因缺失并不能广泛影响所有含ARE的mRNA。本研究还检测了LPS刺激对TNF-α和IL-1β表达的影响,见图3。在对照组细胞,LPS可以诱导TNF-α和IL-1β的mRNA表达增加;但是,与TNF-α诱导一样,在KSRP-/-Ast,LPS诱导的TNF-α和IL-1β的增加更加明显,是对照组的2~3倍。本研究在LPS刺激24和72 h后检测细胞培养上清中的细胞因子含量,发现与对照组相比,KSRP-/-组Ast TNF-α含量增加了15倍。在野生型细胞,未检测到IL-1β的表达,但是在KSRP-/-组Ast,可检测到2 pg/mL的IL-1β。但是,在基础情况或TNF-α刺激下,KSRP-/-组Ast及野生型Ast培养上清液中均未检测到TNF-α和IL-1β(数据未显示)。与mRNA结果一致,刺激前后VEGF的分泌在2组细胞中无明显变化。本研究亦检测了KSRP-/+杂合子小鼠Ast TNF-α(1.7倍)和IL-1β(1.5~2.1倍)的mRNA表达量,发现有中等程度的增加,说明KSRP的作用有剂量依赖性。为进一步明确KSRP-/-Ast TNF-α和IL-1β表达的增加是否与RNA动力学改变有关,本研究检测了基础条件、TNF或LPS刺激下TNF-α和IL-1βmRNA的半衰期,见图4。基础条件下和TNF-α刺激时,2组细胞TNF-α和IL-1βm RNA的半衰期无差异。2组细胞的RNA降解曲线基本重合。TNF-α的半衰期较短,约为0.3 h,与其它细胞类型中报道的一致,且在TNF-α刺激后无明显改变。在对照组细胞,LPS刺激后,TNF-αmRNA的半衰期较未受刺激时增加了3倍(刺激后半衰期为0.9 h);而在KSRP-/-组细胞,刺激后TNF-α的mRNA半衰期延长至1.7 h。对照组细胞在LPS刺激前后IL-1β的m RNA半衰期无显著改变;但是KSRP-/-组细胞在LPS刺激后IL-1β的半衰期增加了将近2倍(3.0~5.8 h)。综上所述,KSRP基因缺失将广泛导致肿TNF-α和IL-1βmRNA水平增加,但m RNA稳定性的变化却与刺激的类型相关。
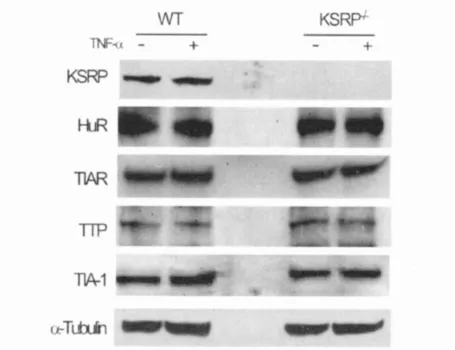
图1 KSRP-/-基因型对Ast其他ARE RNA结合蛋白的表达无影响。通过Western blot检测TNF-α(10 ng/m L)处理或未处理24 h后的KSRP-/-小鼠Ast和同窝出生的对照组小鼠Ast(野生型)中目标蛋白的含量。抗体名称标记在免疫印迹的左侧。

图2 KSRP-/-基因型可增强TNF-α诱导的Ast TNF-α和IL-1βmRNA表达。分别用溶剂(PBS)或TNF-α(10 ng/m L)处理KSRP-/-或同窝出生对照组小鼠(野生型)Ast,24 h后用定量PCR分析TNF-α和IL-1β的表达量。所得的mRNA值除以管家基因m RNA(S9)的值得到标准化值,并统计为未受刺激的野生型Ast靶mRNA值(设为1)的倍数。图上每个点平均值(±标准误)代表至少4次独立实验的平均值。*P<0.05(与野生型相比)。
2.2 受KSRP-/-基因型影响的其它mRNA靶点
为检测受KSRP基因缺失影响的其它m RNA,本研究对KSRP-/-Ast和野生型Ast进行了初步的芯片分析,并筛选出KSRP-/-Ast中含量较对照组改变超过2倍的mRNA(结果未显示)。根据芯片结果,进一步研究了3个mRNA:C型凝集素结构域家族5,成员A(C-type lectin domain family 5,member A;CLEC5A)、髓样细胞触发受体(triggering receptor expressed on myeloid cells,TREM)和趋化因子,C-C

图3 KSRP-/-基因型可增强LPS诱导的Ast TNF-α和IL-1βm RNA及蛋白质的表达。左图:用1μg/m LLPS处理Ast,24 h后用定量PCR分析TNF-α和IL-1βm RNA的表达量。靶mRNA值用S9 m RNA的值标准化,然后统计为未受刺激的野生型Ast靶mRNA值的倍数(值设为1)。图上每个点[平均值(±标准误)]代表至少4次独立实验的平均值。*P<0.05(与野生型相比)。右图:脂多糖刺激Ast24及72 h后培养上清液ELISA分析。图上每个点[平均值(±标准误)]代表2次独立实验的平均值,每次2个复孔。

图4 KSRP-/-Ast LPS诱导TNF-α和IL-1βmRNA稳定性增强。用溶剂、TNF-α(10 ng/mL)或LPS(1μg/mL)处理野生型或KSRP-/-Ast,24 h后用5μg/m L ActD终止转录,不同时间间隔后,收集RNA,并用定量PCR分析其含量。RNA的表达量除以S9细胞的RNA表达量得到标准化值,然后统计为ActD添加前(0时间点)RNA水平的百分率。图上每个点[平均值(±标准误)]代表至少3次独立实验的平均值。计算的半衰期写在括弧内。模体,配体12(chemokine,C-C motif,ligand 12;CCL12)。上述每种mRNA的变化量都用定量PCR进行验证,证实在基础条件下,基因敲除组细胞mRNA表达量较对照组增加2倍以上,见表1。TNF-α刺激后,3种mRNA的表达量都增加2~4倍,其中TREM-1增加最明显。与对照组相比,KSRP-/-Ast上述m RNA的表达量又增加了2~3倍。LPS可以诱导4倍以上的CCL12 mRNA的表达,但是对CLEC5A或TREM-1 mRNA的表达量没有影响。过去文献报道,诱导型一氧化氮合成酶(inducible nitric oxide synthase,iNOS)的调节与KSRP相关,但是芯片分析却没有发现该基因的变化。定量PCR进一步验证了该研究结果,无论在基础条件下还是各种刺激条件下,KSRP-/-组Ast和对照组AstiNOS m RNA表达量无明显差别。有趣的是,芯片分析结果表明,在KSRP-/-Ast,一种与KSRP密切相关的远端上游元件结合蛋白1(fuse binding protein 1,FBP1)的表达量上升了2倍。同样在肝癌细胞系,KSRP沉默也可诱导FBP1表达的增加。而远端上游元件结合蛋白3(FBP3)在KSRP敲除前后无明显变化。本研究接下来检测基础条件或各种刺激条件下,TREM-1、CLEC5A和CCL12的RNA半衰期,见表1。在基础条件和TNF-α刺激时,KSRP-/-组Ast和对照组Ast这3种靶mRNA的降解曲线基本类似,其中,CLEC5A的半衰期由于超过6 h而难以用本研究估算(本研究检测的最后1个时间点为6 h)。TNF-α刺激可以稳定CCL12的m RNA,但是仅略微延长TREM-1的m RNA半衰期(从2.2 h延长至3.6 h)。LPS可以稳定KSRP-/-组AstCCL12的m RNA半衰期,但对对照组CCL12的m RNA稳定性无影响(2组细胞LPS刺激后的CCL12的m RNA半衰期分别为>6.0和6.0 h)。综上所述,在KSRP-/-组Ast,上述3种mRNA的表达量均有显著增加,但m RNA半衰期的延长却与刺激的种类和mRNA的类别有关。
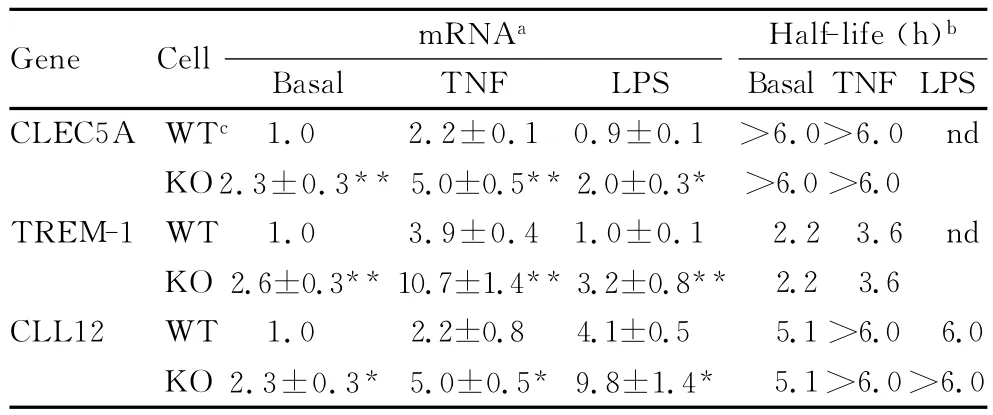
表1 芯片研究筛选出的3种mRNA的表达和动力学变化表明KSRP-/-Astm RNA表达水平较对照组上升2倍以上
2.3 KSRP可以在转录后水平负向调控Ast基因的表达
本研究结果表明KSRP基因缺失除了可以增加部分mRNA的表达水平外,还可以增加部分mRNA的稳定性。为进一步研究Ast KSRP参与基因表达调节的分子机制,本研究通过荧光素酶报告系统研究3’-非翻译区(转录后水平调节)和启动子区(转录水平调节)对mRNA表达水平的影响。为研究3’-非翻译区对mRNA表达水平的影响,本研究首先在TNF-α的3’-非翻译区的ARE部位连接1个荧光素酶报告基因,然后和FLAG-KSRP或myc-hn RNP C(对照)基因表达质粒共转,见图5A,并用荧光素酶报告基因连接1个反向3’-非翻译区片段(不含ARE)作为第2对照。当野生型Ast异位表达KSRP时,可观察到与KSRP基因表达水平呈剂量相关性的荧光素酶活性下降(P<0.0001),但是转染了反向3’非翻译区或hn RNP C(对照)却对荧光素酶的活性无影响,见图5B。异位表达KSRP同样明显抑制KSRP-/-Ast TNF-α的3’非翻译区介导的基因表达。为进一步证实荧光素酶的活性的降低与蛋白表达下降有关,本研究在神经元样N2a细胞系评估了报告基因的活性。笔者分别用Western blot和定量PCR检测荧光素酶的m RNA含量和蛋白表达水平,发现荧光素酶的活性与荧光素酶蛋白的表达量呈剂量相关性。在其他细胞,KSRP亦被证实可与TNF-α mRNA结合,在转录后水平进行mRNA调控,但是却没有报道KSRP能与上述其他4个mRNA结合。为进一步验证KSRP与上述mRNA的关系,本研究用抗KSRP抗体将LPS刺激后的野生型Ast提取物进行了RNA免疫沉淀研究,见图6。结合的mRNA用定量PCR进行检测,并且统计为初始总mRNA含量的百分比。本研究观察到KSRP除了与TREM-1mRNA之间没有结合外,与其它m RNA的结合较对照组(IgG)都有所增加。用未受刺激的Ast提取物重复上述研究得到相同的结果。笔者进一步研究了这些KSRP结合的mRNA的3’-非翻译区,发现这些mRNA的3’非翻译区至少含有1个ARE;但是TREM-1的3’非翻译区却不含ARE,这就解释了为什么KSRP不能与TREM-1 mRNA结合。同时,另一种AUBP Hu R的结合模式与KSRP类似,也进一步支持上述解释。

图5 KSRP通过TNF-α的3’非翻译区负向调控基因的表达。A:荧光素酶报告基因模式图。图中可见荧光素酶报告基因下游连接的TNF-α3’UTR的ARE部分或对照组中的反向UTR。B:上图为转染FLAG-KSRP或myc-hn RNPC对照质粒的野生型Ast的Western blot结果。分别用抗-FLAG(KSRP)或抗-myc(hnRNP C)抗体检测。下图显示,在荧光素酶报告质粒含量不变的情况下(1μg)荧光素酶活性随共转染的表达质粒的含量的增加(1~3μg)而变化。测得的荧光素酶活性除以转染对照组(β-半乳糖苷酶)荧光素酶活性得标准化值,并统计为共转pcDNA时荧光素酶活性的百分率。所检测的3’UTR写在括号内。所有的数据为3次独立实验的均值,并记为均数±标准误。转染KSRP组细胞,转染TNF-α和对照组反向3’UTR相比,**P<0.003,****P<0.0001。
图6 KSRP可与除TREM-1外的其他4种mRNA结合。提取脂多糖刺激后的野生型Ast细胞质提取物,并用KSRP、Hu R或对照组IgG抗体进行RNA免疫沉淀研究。沉淀中提取的RNA通过定量PCR检测含量,并且统计为初始总RNA含量的百分比。左图为不同3’UTR的示意图(小鼠来源),并标记处了AUUUA五聚体。所有的数据为2次独立实验的均值,每次实验有2个复孔,并记为(均数±标准误)。
2.4 KSRP可以在转录水平负向调控Ast基因的表达
因为基础条件或TNF-α刺激下RNA表达的差异与RNA的半衰期无关,以及KSRP不与TREM-1 mRNA结合等原因,本研究进一步检测了KSRP在转录水平调控基因表达的可能性。笔者在TNF-α和TREM-1启动子下游连接荧光素酶报告基因。如前人研究所述,这2种启动子都含有激活蛋白-1(activator protein-1,AP-1)和核因子κB(nuclear factor kappaB,NF-κB)区,见图7。对照组用了另一个哺乳动物的启动子Hel-N1。本研究将报告质粒与FLAG-KSRP或myc-hnRNP C表达质粒共转,同时还转染一个转染调控质粒进入Ast,见图7B。笔者发现当KSRP与TNF-α和TREM-1启动子共转后,荧光素酶的活性显著下降,且与转染的KSRP基因剂量相关。当KSRP基因剂量达到最高时,TNF-α和TREM-1启动子的活性分别下降到基线值的36%和53%。对照组表达质粒hnRNP C在任何剂量均对启动子活性和基因表达量无影响。KSRP作用的特异性体现在它无法抑制Hel-N1启动子的活性。本研究接着通过在N2a细胞中检测TNF-α启动子的活性来验证其他细胞中KSRP是否存在转录水平负向调节,见图8。KSRP可以诱导明显的基因剂量相关性荧光素酶活性降低,见图8A,及相应的蛋白表达降低,见图8B,但是hn RNP C无此效应。为进一步研究LPS刺激下,KSRP对TNF-α启动子活性的影响,本研究采用了一种可以被LPS强诱导的巨噬细胞系RAW264.7。对照组细胞(转染hnRNP C)转染后用脂多糖可以诱导20倍的荧光素酶活性,与转染空pcDNA载体的诱导效率类似。但是当共转染KSRP时,这种荧光素酶的诱导效应下降了60%(P<0.0001)。为进一步明确顺式作用元件(cis element)在负向调节中的作用,笔者进一步在N2a细胞中进行了TNF-α启动子定位研究,见图8C。当启动子5’端含45个碱基的序列(-611~-655)被删除后,笔者观察到转染KSRP组较对照组荧光素酶的活性显著下降(P<0.008)。删除的这一部分包括第3个NF-κB位点。尽管额外删除另外2个NF-κB位点可以降低整体荧光素酶的活性,但是与对照组相比却没有统计学差异。上述研究结果表明最上游的NF-κB位点与KSRP转录水平的负向调控相关。综上所述,在原代培养Ast(或其他细胞),KSRP可以特异性抑制TNF-α和TREM-1启动子的活性,以降低基础和刺激条件下这些炎性介质的RNA及蛋白的水平。
2.5 KSRP-/-Ast可以诱导皮质神经元毒性及Ast迁移
因为KSRP-/-Ast可以产生更多的可溶性分子(如TNF-α、IL-1β),笔者推测这些细胞可能对其周围的其他CNS细胞产生旁分泌的效应。在本研究中,笔者检测了神经元毒性和Ast的趋化性。笔者从未受刺激的KSRP-/-Ast收集Ast条件性培养基,以避免人为添加在培养基中的LPS或TNF-α所产生的复合效应。为研究神经元毒性,笔者在大鼠原代培养神经元中加入Ast条件性培养基,见图9A,培养24 h后,用Caspase-3抗体进行免疫染色来检测神经元凋亡水平。笔者观察到KSRP-/-条件性培养基处理组与野生型培养基处理组免疫活性细胞的数量呈剂量依赖性明显增高,其中最高剂量大约可以诱导阳性细胞增高60%(P<0.0001)。通过观察聚缩或破碎的细胞核,笔者发现在大致相同的剂量范围,KSRP-/-条件性培养基暴露可导致无活性细胞的数量明显增加(P<0.001)。为研究Ast趋化性,笔者检测了野生型Ast通过transwell小室8μm孔径的滤膜的数量(小室置于条件性培养基中)。48 h后,除去滤膜,用结晶紫染色,见图9B,与对照组相比,笔者发现KSRP-/-条件性培养基处理组迁移的Ast数量呈剂量相关性显著增加。在最高剂量,迁移的细胞较对照组增加60%(P<0.0001)。上述结果提示KSRP可能通过旁分泌的形式对周围其他细胞起到调节作用。

图7 KSRP可以特异性抑制Ast TNF-α和TREM-1启动子活性。A:报告系统中所用的TNF-α、TREM-1和Hel-N1启动子模式图。B:与3种浓度FLAG-KSRP和myc-hn RNP C质粒共转后的荧光素酶活性(见材料与方法)。本实验使用了一个转染调控质粒来调控转染效率。所得数据统计为仅转染报告质粒时的荧光素酶活性的百分率。所有的数据为3次独立实验的均值,每次实验有2个复孔,并记为(均数±标准误)。与转染hnRNP C的对照组相比,*P<0.03,**P<0.003,****P<0.0003。
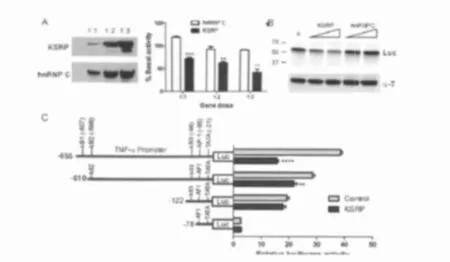
图8 KSRP可在N2a细胞中TNF-α启动子的活性。A:左图,含TNF-α启动子的荧光素酶报告基因质粒与Flag-KSRP或myc-hnRNPC表达质粒共转,48 h后,通过Western blot检测N2a细胞蛋白的表达。基因的剂量表达为荧光素酶报告质粒和表达质粒的摩尔比。用FLAG(KSRP)和myc(hnRNP C)抗体进行检测。右图,转染后N2a细胞的荧光素酶活性。B.Western blot检测KSRP或hnRNP C表达质粒与TNF-α报告质粒共转后荧光素酶蛋白的表达。所用抗体列在右侧。C.TNF-α启动子的定位分析。笔者用KSPP或pcDNA(对照)、报告质粒和转染控制质粒转染N2a细胞。所有的数据为至少3次独立实验的均值,每次实验有2个复孔,并记为(均数±标准误)。**P<0.008,****P<0.0001。

图9 KSRP-/-可诱导神经元死亡和Ast迁移增加。A:用不同浓度的取自KSRP-/-和同窝出生的对照组小鼠Ast的条件性培养基处理大鼠皮质神经元。24 h后,用caspase-3和DAPI抗体染色。并计数绿色细胞的数量。每个数据代表3次独立实验的均值,每次实验取8个高倍镜视野,并记为(均数±标准误)。与野生型培养基处理组相比,**P<0.007,****P<0.0001。B:野生型Ast接种至8μm孔径的transwell小室中,并置于含KSRP-/-和同窝出生的对照组小鼠Ast的条件性培养基的孔板中。48 h后,小室下表面的迁移细胞用结晶紫染色并计数。每个数据代表3次独立实验的均值,每次实验取8个高倍镜视野,并记为(均数±标准误)。***P<0.003,****P<0.0001。
3 讨论
本研究主要研究了KSRP对Ast细胞因子表达的影响,以及对炎性反应刺激下细胞表现型的影响。本研究发现,KSRP敲除后,Ast部分细胞因子(包括TNF-α、IL-1β和TREM-1等)表达上调。这种分子表型的变化导致Ast产生一系列可溶性因子,并进一步增强了Ast的趋化性和神经元毒性。令人吃惊的是,基础条件下,本研究并没有观察到上述细胞因子RNA半衰期的延长;而仅仅在LPS刺激后,有选择性延长效应。荧光素酶报告研究表明KSRP通过转录水平和转录后水平调控影响Ast基因的表达。
本研究结果提示KSRP是Ast部分炎性因子表达的负向调控因子。KSRP的这种负向调控作用在上述炎性因子中十分明显且较为均一(均可以诱导上述炎性因子的RNA表达水平降低2~3倍)。但是,这种负向调控亦有一定的特异性,主要体现在对KC和VEGF mRNA无影响。而KSRP对可直接影响Ast自分泌和旁分泌的蛋白分泌功能则有更大的影响。例如,LPS刺激后,与野生型星形胶质相比,KSRP-/-组Ast培养基中的TNF-α和IL-1β水平上升15倍甚至更多。这种增加有2种可能的机制:①KSRP除调节mRNA的稳定性外,还可调节其翻译效率。最近研究表明在Hela细胞中沉默KSRP可以诱导TNF-α或IL-1β的m RNA重新分布至多核糖体上,并且增加这些蛋白的分泌。转录水平沉默这些细胞因子的表达主要通过ARE介导。②可能是TREM-1(一种细胞表面受体)和CLEC5a(一种跨膜蛋白)表达增加,从而导致诸如TNF-α和IL-1β的释放减少。此外,由于Ast表达趋化因子受体,这些释放的细胞因子还可以通过与趋化因子受体结合进一步促进炎性因子的释放。TNF-α、IL-1β及CCL12还可以通过趋化、募集和激活免疫细胞(中枢免疫细胞及周围免疫细胞)放大炎性反应。最近还有研究报道,在胚胎成纤维细胞中,KSRP亦与固有免疫系统存在联系,敲除KSRP可诱导I型干扰素mRNA稳定性增加,对病毒感染的防御性更强。
Ast可以分泌许多细胞因子。KSRP敲除后,笔者通过芯片研究发现了一些新的含量改变在2倍以上的目标RNA(尽管还未被其他研究证实)。根据既往研究,在其他细胞类型中,KSRP敲除在不同细胞条件下可调控多种基因。但是,在这些研究中,IL-1β、TREM-1、CCL-12和CLEC-5A却未有报道,提示KSRP的基因调控作用与细胞类型密切相关。由于Ast分子表现型的多种多样,其对周围的细胞作用也千差万别,既有可能有支持作用,亦有可能有毒害作用。KSRP-/-条件性培养基作用下Ast迁移率的增加可能与CNS炎症及创伤条件下的胶质细胞反应密切相关。这种迁移可能通过局限炎性反应发挥保护性作用,或者通过形成胶质瘢痕发挥有害作用。尽管本研究表明KSRP可以调控Ast这种表现型,但是其具体作用机制尚不明确。KC是一种与Ast迁移有关的趋化因子,但是在本研究中,KSRP-/-Ast KC的表达却没有明显变化(图2)。在划痕损伤模型中,TNF-α和IL-1β反而可以抑制Ast的迁移。在本研究中,KSRP敲除导致神经元死亡的原因也不知道。在许多神经炎性疾病和神经退行性疾病(包括多发性硬化、肌萎缩侧索硬化、帕金森氏病、阿尔茨海默病等)中,Ast的神经元毒性作用主要是通过释放一些有毒分子造成的。而TNF-α和IL-1β都被认为与神经元损伤有关,因此在本研究中,与KSRP-/-Ast上述炎性因子的表达上调一致,笔者亦观察到其神经毒性作用。
KSRP的负向调控作用似乎通过2种分子机制实现,包括转录途径和转录后途径。与其他视黄醇结合蛋白一致,KSRP可与DNA和RNA结合并发挥多重效应。KSRP及其同系物与转录调节、RNA剪切、3’端加工、编辑、定位、稳定性、miRNA突变有关。其中一些功能可能是通过与靶mRNA及其启动子的相互作用直接,或通过调控影响基因表达的其他因子(如转录因子,miRNA或视黄醇结合蛋白)间接抑制mRNA的表达实现的。尽管mRNA表达水平有显著增加,基础条件下或TNF-α刺激时,KSRP-/-Ast RNA半衰期却没有明显延长,提示可能还存在其他调节途径。在Hela细胞中,KSRP敲除可以诱导400多种靶m RNA的表达量增加2倍以上,但是表达量增加的大部分mRNA(包括TNF-α)并不稳定。本研究发现KSRP可诱导TNF-α和TREM-1启动子活性抑制,提示转录水平的抑制可能是另一条KSRP的另一条调控途径。KSRP和视黄醇结合蛋白家族的其他成员除了可以反式激活c-myc外,亦具有启动子抑制物的活性。尽管本研究所用的TNF-α和TREM-1启动子序列没有表现出典型的远端上游元件结合元件特性,但是在最近的研究报道中,KSRP可以和更广泛的DNA位点结合,且这些位点之间没有明显的共有序列。笔者在电泳迁移率检测实验(结果未显示)或染色体免疫沉淀研究中并未发现KSRP与DNA的相互作用。尽管这些阴性数据不能排除直接效应的存在,KSRP更有可能是通过影响其他转录因子的表达间接调控启动子的活性。例如,在KSRP-/-Ast,FBP1 mRNA的水平增加了2倍。笔者的定位研究提示KSRP的负向调控部分与TNF-α启动子区的第3个NF-κB位点的序列有关。有趣的是,包括巨细胞病毒启动子(在预实验中,用于启动转染的对照基因,本文未列出)在内的所有抑制性启动子都含有一系列NF-κB位点,而一些无抑制作用的启动子,如Hel-N1和SV40等(用以启动β-半乳糖苷酶对照基因)却不含。为明确反式元件及NF-κB在其中的具体作用,还需要更多的研究。此外,KSRP对基因表达的抑制效应并不局限在Ast,在其他免疫细胞中也可观察到,提示KSRP在细胞因子调节方面存在广泛作用。
本研究发现,LPS刺激后,KSRP-/-Ast TNF-α、IL-1β和CCL12的RNA稳定性增加,提示KSRP在这些靶RNA的转录后调节方面发挥作用。同时TNF-α3’非翻译区的报告基因研究及RNA免疫沉淀研究中发现的KSRP可以与这些转录本结合,也进一步支持上述观点。转染TREM-1后,KSRP基因缺失对RNA降解没有影响,说明此时启动子的抑制作用是主要机制。而TREM-1 mRNA 3’非翻译区缺乏明确的ARE及不能与KSRP(以及HuR)结合进一步支持上述结论的可能性。有趣的是,本研究在Ast中观察到KSRP具有刺激依赖性选择性mRNA稳定效应。在LPS刺激下,野生型Ast m RNA的半衰期增加了3倍(从0.3 h增加到0.9 h),但IL-1β却没有变化。在其他细胞中,其他RNA却没有观察到类似的差异性稳定现象,充分说明转录后调控的复杂性。
综上所述,笔者认为KSRP是调节Ast促炎介质生成的重要检测点之一。这些研究结果提示KSRP可能在CNS自身免疫性疾病和神经退行性疾病(这些疾病中,持续存在的免疫反应是疾病进展的重要原因)中有重要意义。
【致谢】
感谢组织培养中心协助我们进行神经元培养(P30 HD038395);感谢UAB微阵列分析机构(P30 CA013148-39)。
