HPLC测定补阳还五汤总苷中黄芪甲苷和芍药苷的含量
邹 龙,刘 辉,李仲秋,邓常清*
(湖南中医药大学,湖南 长沙 410208)
HPLC测定补阳还五汤总苷中黄芪甲苷和芍药苷的含量
邹 龙,刘 辉,李仲秋,邓常清*
(湖南中医药大学,湖南 长沙 410208)
目的 建立高效液相色谱法测定补阳还五汤总苷中黄芪甲苷和芍药苷的含量。方法 色谱柱为Kromasil C18柱(4.6 mm×250 mm,5 μm),黄芪甲苷测定:蒸发光散射检测器,流动相为甲醇∶水=80∶20(v/v);漂移管温度 60 ℃;气体流量 1.5 L/min;输出压力 0.5 MPa;柱温 30 ℃。 芍药苷测定:流动相为甲醇∶水=23∶77(v/v);流速为 1 mL/min,检测波长:218 nm, 柱温:30℃。 结果 黄芪甲苷在0.57~9.10μg时,Y=1.506 3X+2.409 6,r=0.999 4; 芍药苷在0.48~7.70μg时,Y=598.91X-2.334 6,r=0.999 9;其线性关系良好,平均加样回收率分别为99.62%和101.1%,RSD为2.6%和1.7%(n=6)。结论 本法快速、简便、准确、灵敏度高,适用于黄芪甲苷及芍药苷的含量测定,并为其总苷物质制备工艺研究提供质量标准依据。
补阳还五汤;高效液相色谱法;黄芪甲苷;芍药苷;含量测定;黄芪;赤芍;地龙
补阳还五汤出自清代王清任的《医林改错》[1],由黄芪、赤芍、当归、地龙、川芎、桃仁、红花组成。其方中苷类物质是补阳还五汤中重要的活性成分[2],本文对其原方药材进行提取,醇沉,通过732阳离子树脂,氯仿萃取及DA-201大孔树脂洗脱后得到的总苷类物质,采用高效液相色谱法(HPLC)[3-7]对其中黄芪甲苷和芍药苷进行含量测定,为该方总苷类工艺研究提供质量标准依据。本文建立的方法与吴青业[8],何石兰等[9]所采用的乙腈-酸水系统检测比较,甲醇-纯水系统具有方便简单,毒性小,易操作等特点。
1 仪器与试药
Agilent-1200高效液相色谱仪(美国安捷伦公司);蒸发光散射检测器Allteeh El803300(埃文森科技有限公司);Ohaus-AR124CN型电子分析天平(奥豪斯仪器上海有限公司)。
甲醇为色谱纯,水为重蒸馏水,其余试剂均为分析纯。黄芪甲苷对照品(上海源叶科技有限公司,批号 YY20100809,HPLC≥98%);芍药苷对照品(上海源叶科技有限公司,批号YY20100505,HPLC≥98%);补阳还五汤总苷物质由湖南中医药大学药剂实验室制备,批号 20110428、20110625、20110717。
总苷类物质样品由补阳还五汤全方经过两次水提,每次1 h,合并煎液经真空浓缩后,85%乙醇醇沉3次,每次静置12 h,滤过,回收乙醇,样品液通过预先处理好的732阳离子树脂,收集水洗液经氯仿萃取,分离水层通过预处理好的DA-201大孔树脂,60%乙醇洗脱,将洗脱液浓缩后真空干燥,即得。
2 方法与结果
2.1 色谱条件
色谱柱为 Kromasil C18柱(4.6 mm×250 mm,5 μm);黄芪甲苷检测条件:流动相为甲醇∶水=80∶20(v/v);蒸发光散射检测器检测;漂移管温度60℃;气体流量1.5 L/min;输出压力0.5 MPa;柱温30℃;理论板数按黄芪甲苷峰计算应不低于4 000。芍药苷检测条件:检测波长为218 nm;流动相为甲醇∶水=23∶77(v/v);流速:1 mL/min;柱温:30 ℃;理论板数按芍药苷峰计算应不低于3 000。进样量均为10 μL。
2.2 对照品及供试品溶液的配制
2.2.1 对照品溶液 取黄芪甲苷对照品9.1 mg,加甲醇定容至10 mL,制得含黄芪甲苷0.91 mg/mL的对照品溶液。
取经五氧化二磷减压干燥器中干燥36 h的芍药苷对照品7.7 mg,用甲醇定容至10 mL,制得含芍药苷0.77 mg/mL的对照品溶液。
2.2.2 供试品溶液 取总苷类样品0.051 g精密称定,置于100 mL具塞锥形瓶中,精密加入50 mL乙醇,浸泡 4 h,超声处理 20 min,放冷,滤过,置60℃水浴挥掉溶剂后补加甲醇定容至10 mL,0.45 μm滤膜滤过,作为供试品溶液。
2.3 样品含量测定的方法学考察
2.3.1 线性范围 (1)取黄芪甲苷对照品溶液储备液 (0.91 mg/mL), 分别加甲醇配成 0.91、0.455、0.227 5、0.113 6、0.056 9 mg/mL 的系列对照品溶液,依法测定,每次进样10 μL,记录峰面积。以峰面积的对数值为纵坐标(Y),对照品进样量对数值(μg)为横坐标,绘制标准曲线。得线性回归方程:Y=1.506 3X+2.409 6,r=0.999 4。结果表明黄芪甲苷在0.57~9.10μg 范围内呈良好线性关系。(2)取芍药苷对照品溶液储备液(0.77 mg/mL),分别加甲醇配制成 0.77、0.385、0.192 5、0.096 2、0.048 1 mg/mL 的系列对照品溶液,依法测定,每次进样10 μL,记录峰面积。以峰面积为纵坐标(Y),对照品进样量(μg)为横坐标,绘制标准曲线。得线性回归方程:Y=598.91X-2.334 6,r=0.999 9。结果表明芍药苷在0.48~7.70μg范围内呈良好线性关系。
2.3.2 阴性干扰实验 原方分别去除黄芪、赤芍,按照制备工艺分别制备为缺黄芪甲苷和缺赤芍的阴性对照。按“2.2.2”项下进行样品的配制并测定,阴性样品色谱在黄芪甲苷和芍药苷相应的保留时间上无干扰峰(补阳还五汤总苷、黄芪甲苷、芍药苷对照品及其阴性液相色谱图分别见图1~6)。
2.3.3 精密度试验 分别精密吸取浓度为0.168 mg/mL的黄芪甲苷和浓度为0.192 5 mg/mL的芍药苷对照品溶液10 μL,分别重复进样5次,测得黄芪甲苷其峰面积积分值 551.7、567.8、555.5、564.3、557.8。芍药苷峰面积值分别为 1 136.9、1 165.8、1 175.2、1 180.7、1 175.35,RSD 分 别 为1.17%和1.5%,结果表明仪器精密度良好。
2.3.4 稳定性试验 分别取供试品溶液 (批号20110625)于 0、2、4、6、8 h 进样 10 μL,黄芪甲苷峰面积分别为:693.1、692.3、707、700.1、698.5, 芍药苷峰 面 积 值 分 别 为 :3 090.83、3 134.99、3 155.78、3 165.7、3 194.5,RSD 分 别 为 0.85% 和1.23%,结果表明样品溶液在8 h内稳定性良好。
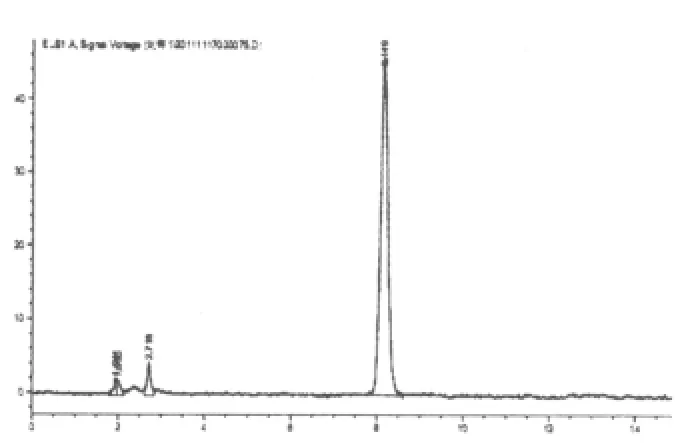
图1 黄芪甲苷对照品的HPLC图
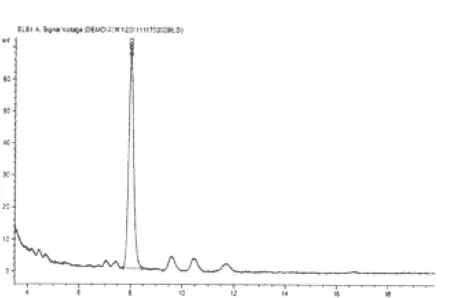
图2 补阳还五汤总苷样品的HPLC图
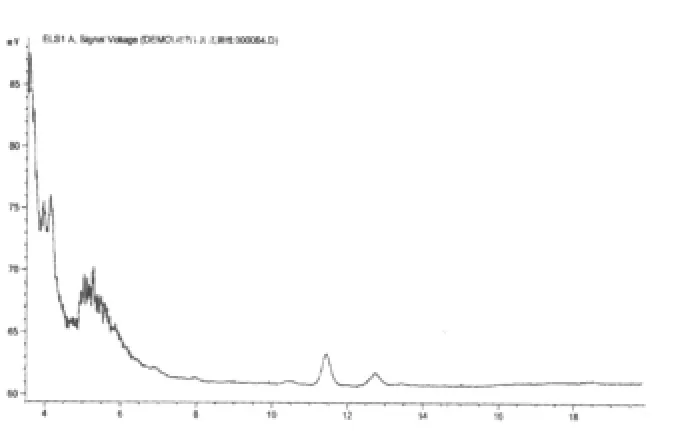
图3 黄芪甲苷阴性对照液的HPLC图
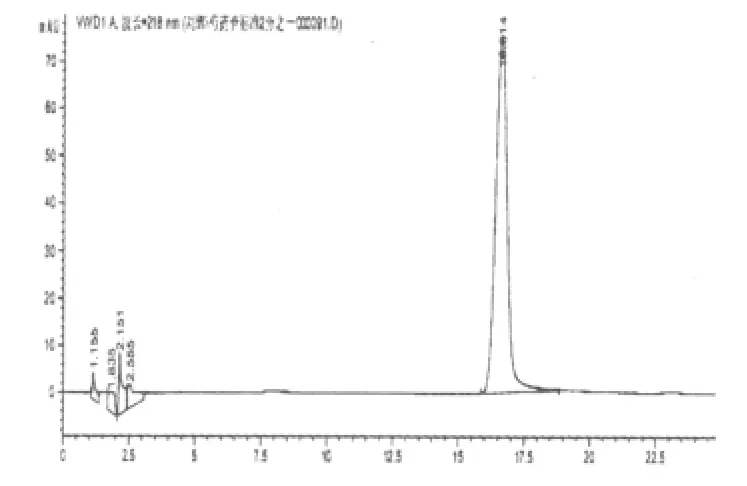
图4 芍药苷对照品的HPLC图
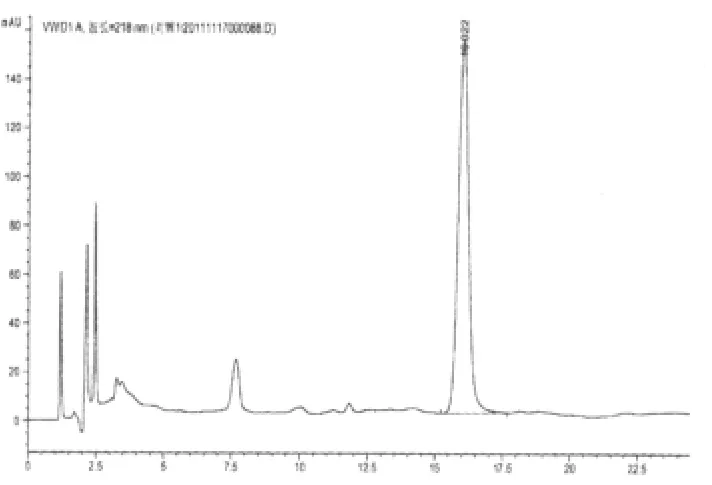
图5 补阳还五汤总苷样品的HPLC图
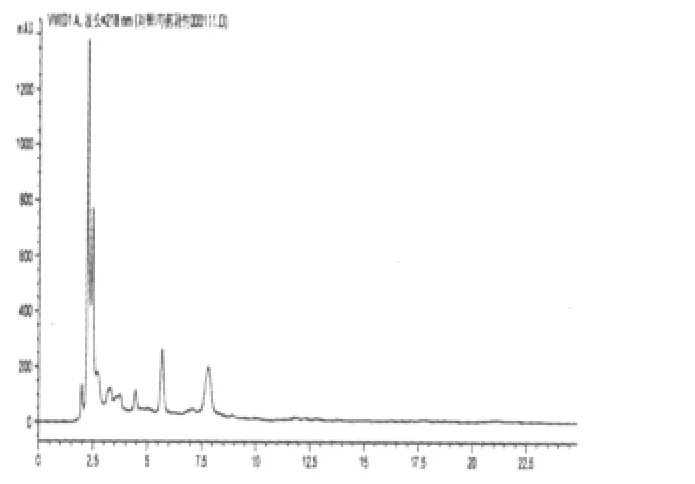
图6 芍药苷阴性对照液的HPLC图
2.3.5 重复性试验 精密称取5份补阳还五汤总苷 51 mg(批号 20110625),按照“2.2.2”项下供试品溶液的配制并测定,进样10 μL,测得黄芪甲苷峰面积分别为 701.1、693.1、713、697.6、704.8。芍药苷峰面积值分别为 3 122.75、3 166.87、3 148.6、3 178.52、3 116.8,RSD 分别为 1.1%和 0.85%,结果表明重复性良好。
2.3.6 加样回收率试验 分别精密称取已知含量的总苷样品适量(批号20110625,黄芪甲苷含量为37.8 mg/g,芍药苷含量为103.93 mg/g)3.7 mg共6份,5 mg 6份。前者6份分别精密加入1 mL黄芪甲苷对照品(0.14 mg/mL),后者6份分别精密加入1 mL芍药苷对照品(0.481 3 mg/mL)然后按“2.2.2”项下供试品制备方法配制并测定,计算回收率,结果见表 1~2。
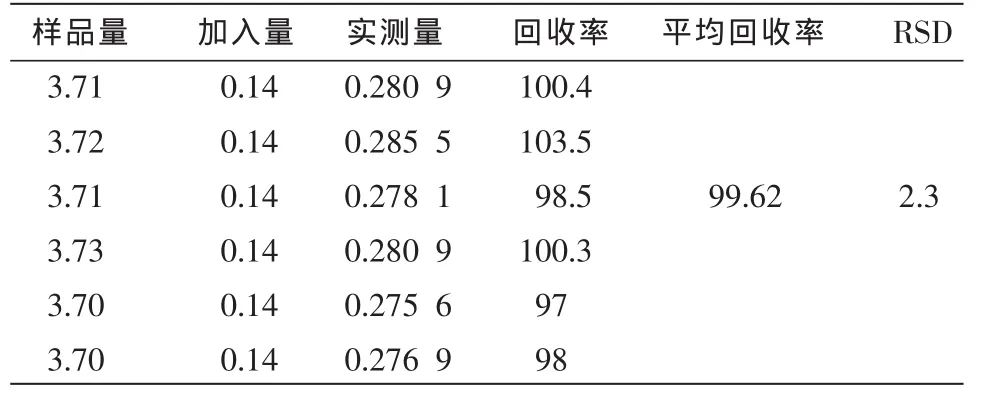
表1 芍药苷回收率结果 (mg,%)
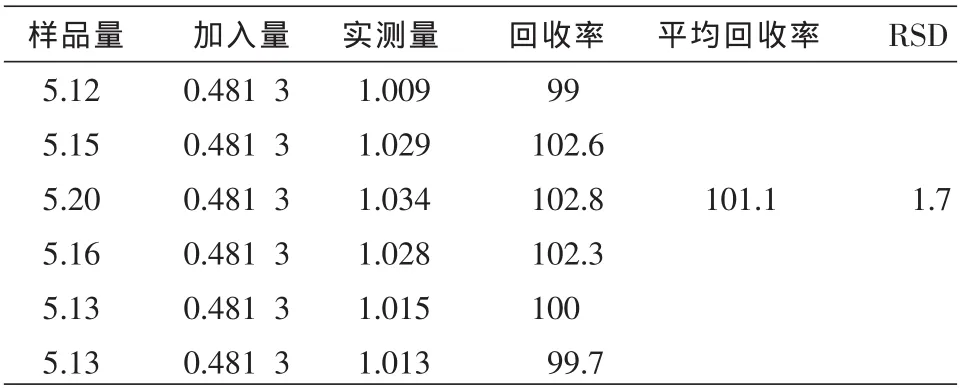
表2 黄芪甲苷回收率结果 (mg,%)
2.3.7 样品含量测定 分别精密称取3批样品0.051 g(批号 20110428、20110625、20110717),按照“2.2.2”项下进行样品溶液的配制并测定,进样10 μL,记录色谱图并计算:黄芪甲苷含量依次为38.45、37.81、38.24 mg/g,平均含量为(38.17 ±0.33)mg/g。 芍药苷的含量依次为 103.60、103.93、102.92 mg/g,平均含量为(103.48±0.52)mg/g。
3 讨论
本文建立了测定补阳还五汤总苷中黄芪甲苷和芍药苷的HPLC。在制备总苷物质的过程中,先后考察了多种提取手段对本品的提取效果。反复实验证明,采用全方经过两次水提,每次1 h,合并煎液经浓缩后,85%乙醇3次醇沉,回收乙醇,样品液通过732阳离子树脂,氯仿萃取及DA-201大孔树脂洗脱所得到的样品总苷类物质能得到较好结果。含量测定结果表明,采用C18柱,黄芪甲苷采用蒸发光散射检测器,流动相为甲醇∶水=80∶20(v/v);芍药苷采用甲醇∶水=23∶77(V/V),检测波长 218 nm。 采用本法操作简单、线性范围宽、回收率高、重复性良好,是一种简便有效检测补阳还五汤总苷中黄芪甲苷和芍药苷含量的方法。
本文测得结果表明,补阳还五汤总苷类物质中黄芪甲苷含量(38.17±0.33)mg/g、芍药苷含量(103.48±0.52)mg/g,比原方中未经阳离子树脂、氯仿及DA-201处理过的黄芪甲苷含量 (0.127±0.004)mg/g、芍药苷(1.33±0.03)mg/g 含量有很大提高,所建立的方法为该方总苷制剂的工艺研究提供了质量标准依据。
[1]清·王清任.医林改错[M].上海:上海科技出版社,1966:31.
[2]王 敏,邓常清.补阳还五汤抗脑缺血作用的研究概况与展望[J].湖南中医学院学报,2000,20(4):71-72.
[3]李小安,张 军,科亚兰,等.HPLC-ELSD法测定暖胃舒胶囊中黄芪甲苷的含量[J].现代中医药,2007,27(2):67-68.
[4]萧 伟,彭国平,文红梅.HPLC法测定醒脑通络粉针中苦杏仁苷与芍药苷的含量[J].南京中医药大学学报,2003,19(2):102-103.
[5]周 琳.高效液相色谱法测定六味补血颗粒中芍药苷和阿魏酸的含量[J].中南药学,2009,7(3):187-190.
[6]郑建锋,郑阿利,盖 轲.HPLC法测定冠心康颗粒中芍药苷的含量[J].中国药事,2011,25(4):377-378,381.
[7]国家药典委员会.中华人民共和国药典[S].北京:中国医药科技出版社,2010:727.
[8]吴青业,关业枝.HPLC-ELSD法测定芪茸保健酒中黄芪甲苷的含量[J].黑龙江医药,2010,203(4):512-513.
[9]何石兰,洪松彬.高效液相色谱法测定赤芍中芍药苷的含量[J].医学信息,2010,23(7):2 342-2 343.
(本文编辑 杨 瑛)
Determination of Astragaloside IV and paeoniflorin in total glucosides of Buyang Huanwu decoction by HPLC
ZOU Long, LIU Hui, LI Zhong-qiu, DENG Chang-qing
(TCM University of Hunan, Changsha, Hunan 410208, China)
Objective To establish the HPLC conditions for determination of Astragaloside IV and paeoniflorin in totalglucosides ofBuyang Huanwu decoction.Methods The Kromasil C18 column(250 mm×4.6 mm,5μm)was used. Astragaloside IV detection conditions:Evaporative light scattering detector was used;the mobile phase was methanol-water(80:20)(v/v);temperature of drift tube was 60 ℃;gas flow rate was 1.5 L/min;pressure was 0.5 Mpa and column temperature was 30 ℃.Paeoniflorin detection conditions:the mobile phase was methanol-water(23:77)(v/v);the flow rate was 1.0 mL/min;the detection wavelength was 218 nm and column temperature was 30 ℃.Results Astragaloside IV was better in linear correlation between 0.57~9.10μg,Y=1.5063X+2.4096, (r=0.9994).Paeoniflorin was better in linear correlation between 0.48 ~7.70μg,Y=598.91X-2.3346(r=0.9999).The average recoveries were 99.62%and 101.3%respectively,and RSD were 2.6%and 1.7%(n=6)respectively.Conclusion The method is rapid,simple and accurate and has high sensitivity for determination of Astragaloside IV and paeoniflorin,which can provide quality standards for the study of total glycosides.
Buyang Huanwu Decoction; HPLC; Astragaloside IV; Paeoniflorin;content determination;Radix Astragali;Paeoniae Radix Rubra;Pheretima
*邓常清,男,医学博士,教授,博士研究生导师,E-mail:dchangq@sohu.com。
R284.1
B
10.3969/j.issn.1674-070X.2012.05.009.039.04
2012-02-19
国家自然科学基金资助项目(81072750)。
邹 龙(1969-),男,湖南新化人,博士,教授,硕士研究生导师,主要从事中药制剂工艺与质量控制研究工作。

