水飞蓟宾口服亚微乳剂的制备及大鼠体内药动学研究*
高朝阳,李 娟,芦 霜
中国药科大学药剂教研室,南京 210009
水飞蓟宾(silybin,SLB)是从菊科植物水飞蓟果实中提取得到的一种黄酮类化合物,具有广泛的药理活性,临床上主要用于治疗急慢性肝炎及肝硬化。该药物毒性低,是一种有良好应用前景的肝病治疗药物[1]。但水飞蓟宾为水不溶且脂难溶性药物,难于吸收,在胃肠道易降解,市售普通制剂口服吸收差,生物利用度低[2]。制备安全高效的水飞蓟宾口服制剂有很大的研究空间。亚微乳作为药物载体具有提高药物溶解度及生物利用度等优势,近年来受到越来越多的关注[3]。对于油水均不溶性的药物,亚微乳的载药量常常难以达到临床用药需求,解决亚微乳载药量低的问题是更好应用该剂型的关键。本研究通过薄膜分散法将水飞蓟宾分散并包裹于脂质材料中,提高药物脂溶性,然后将其包裹于亚微乳的油相中,制成水飞蓟宾口服亚微乳。研究水飞蓟宾口服亚微乳在大鼠体内的药动学特征,并以市售水林佳胶囊为参比制剂,评价了其口服相对生物利用度,为该产品的开发和应用提供依据。
1 材 料
1.1 药品与试剂
水飞蓟宾对照品 (中国药品生物制品检定所,纯度:99.5%);水飞蓟宾原料药(盘锦格林恩生物资源开发有限公司);甲萘酚(中国医药集团上海化学试剂公司);水林佳(水飞蓟宾磷脂复合物胶囊,天士力公司,35mg/粒);中链脂肪酸甘油脂(MCT,法国嘉法赛公司);吐温80(Tween80,辽阳奥克纳米材料有限公司);大豆磷脂(SPC,上海太伟磷脂有限公司,PC含量>80%);聚乙二醇400(PEG 400,汕头市西陇化工厂公司);油酸(OA,上海国药集团);甲醇(色谱纯);乙醚(分析纯)。
1.2 仪器与设备
IY92-Ⅱ超声波细胞粉碎机 (南京贝帝实验仪器有限公司);Zetasizer3000 HAS激光粒径测定仪(英国Malvern公司);NDJ-79型旋转式粘度计 (同济大学机电厂);SHA-B水浴恒温振荡器(金坛市精达仪器制造厂);透析袋(中国医药集团上海化学试剂公司,截留分子量8000~10000);TGL-16离心机(上海安亭科学仪器厂);岛津LC-10AT高效液相色谱仪(日本岛津)。
1.3 实验动物
SD大鼠 (南京市江宁区青龙山动物繁殖场,SCXK(浙)2008-0033),体重(200±20)g,雄性。
2 方法与结果
2.1 水飞蓟宾亚微乳的制备及质量评价
2.1.1 薄膜分散-探头超声法制备水飞蓟宾亚微乳精密称取水飞蓟宾30 mg、磷脂120 mg、胆固醇20 mg置于茄形瓶中,加混合溶剂(甲醇-乙醚=4∶1,v/v)10 mL超声溶解,40℃下减压蒸干除去混合溶剂,形成药物的脂质薄膜。再加入MCT 1000 mg和油酸 30 mg,50℃加热混合均匀形成油相;将Tween80 500 mg、PEG400 180 mg溶于10 mL纯净水中,混合均匀形成水相。两相分别加热至50℃保温,将油相缓慢滴加入水相,磁力搅拌10 min后得初乳,探头超声仪(200W)超声振荡5 min,即得水飞蓟宾亚微乳。
2.1.2 亚微乳的粒径及电位
取水飞蓟宾口服亚微乳适量,用纯净水适当稀释后,采用Zetasizer3000 HAS激光粒径测定仪测定亚微乳的粒径与Zeta电位,测定3批。结果表明:水飞蓟宾亚微乳的平均粒径为(155.9±2.2)nm,多分散指数 (PDI)为0.06±0.01,Zeta电位为-(29.62± 0.03)mV。
2.1.3 亚微乳的粘度
以旋转式粘度计测定水飞蓟宾亚微乳剂的粘度,测得水飞蓟宾亚微乳剂的粘度为3.00 mPa·s。说明水飞蓟宾亚微乳粘度较小,适合口服使用。
2.1.4 含量测定及体外释放研究
2.1.4.1 HPLC法[4]
色谱条件:色谱柱:Kromasil C18(150 mm×4.6 mm,5 μm);流动相:甲醇-磷酸盐缓冲液(49∶51);检测波长:288 nm;流速:1 mL·min-1;柱温:40℃;进样体积:20 μL。
标准曲线的绘制:配制浓度分别为0.50、1.00、2.00、4.00、8.00、10.00、20.00 μg·mL-1的水飞蓟宾标准液,按上述色谱条件,经HPLC法测定。以水飞蓟宾两异构体的峰面积之和(A)对浓度(C)进行线性回归,得标准曲线:A=5.17×104C+3861.3,r=0.9995。配制浓度分别为1.00、4.00、10.00 μg·mL-1的水飞蓟宾标准液,测定日内及日间精密度(RSD)均小于5%(n=3),回收率为97%~99%(n=3)。
2.1.4.2 含量测定
精密吸取0.5 mL水飞蓟宾亚微乳转移至10 mL量瓶中,加入甲醇定容至刻度,超声20 min破乳,取1 mL转移至25 mL量瓶中,加甲醇稀释至刻度,混匀,取20 μL进样,测定3批。结果表明:水飞蓟宾亚微乳中药物含量为(2.93±0.07)mg·mL-1。
2.1.4.3 体外释放研究
精密量取1.0 mL水飞蓟宾亚微乳溶液剂转移至透析袋中,置于200 mL pH6.8的磷酸盐缓冲液(含0.25%Tween80)中,(37±0.5)℃水浴条件下往复振荡(100 r·min-1)。分别于0.25、0.5、1、2、4、6、8、 10、12 h取样2 mL(同时补加2 mL释放介质)。样品用HPLC法分析测定。以累积释放率对时间作图,释放曲线见图1。
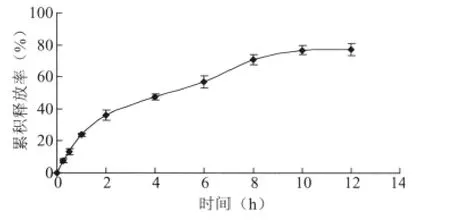
图1 水飞蓟宾亚微乳体外释放曲,n=3)
由结果可知,水飞蓟宾亚微乳初期释放较快,后期释放较为缓慢,这可能与药物在亚微乳剂中的分布有关。分布于水相中的药物能够快速释放,而分布于油相中的药物则先要从脂质材料中扩散至油相,再从油相扩散至水相。
分别采用不同释药模型对水飞蓟宾亚微乳的释药曲线进行拟合,拟合结果见表1。结果表明,水飞蓟宾亚微乳剂的体外释放符合Weibull方程。

表1 水飞蓟宾亚微乳体外释放拟合方程
2.2 水飞蓟宾口服亚微乳大鼠体内药动学
2.2.1 色谱条件
色谱柱:Diamonsil C18(250 mm×4.6 mm,5 μm);流动相:甲醇-磷酸盐缓冲液(45∶55);检测波长:288 nm;流速:1 mL·min-1;柱温:40℃;进样体积:20 μL。2.2.2 血浆样品的处理
精密移取大鼠血浆100 μL,加入内标液(甲萘酚,7.8 μg·mL-1)10 μL,涡旋30 s,混匀后,加入乙醚4 mL,涡旋3 min,3000 r·min-1离心10 min,取上层乙醚4 mL,再加乙醚4 mL重提1次,合并乙醚,于40℃水浴下空气吹干。加入流动相比例的醇水溶液100 μL复溶,涡旋1 min,3000 r·min-1离心10 min,取上清液20 μL进样。
2.2.3 方法专属性
分别取空白血浆、空白血浆加入水飞蓟宾与甲萘酚的样品和体内实测样品,按照 “2.2.2”项进行血样处理,HPLC法进行测定,记录色谱图,考察血浆内源性物质对水飞蓟宾及内标甲萘酚的检测是否有干扰。结果见图2。由图2可知,血浆内源性物质对水飞蓟宾及甲萘酚的检测无干扰,分离情况良好,表明该方法具有较高的专属性。
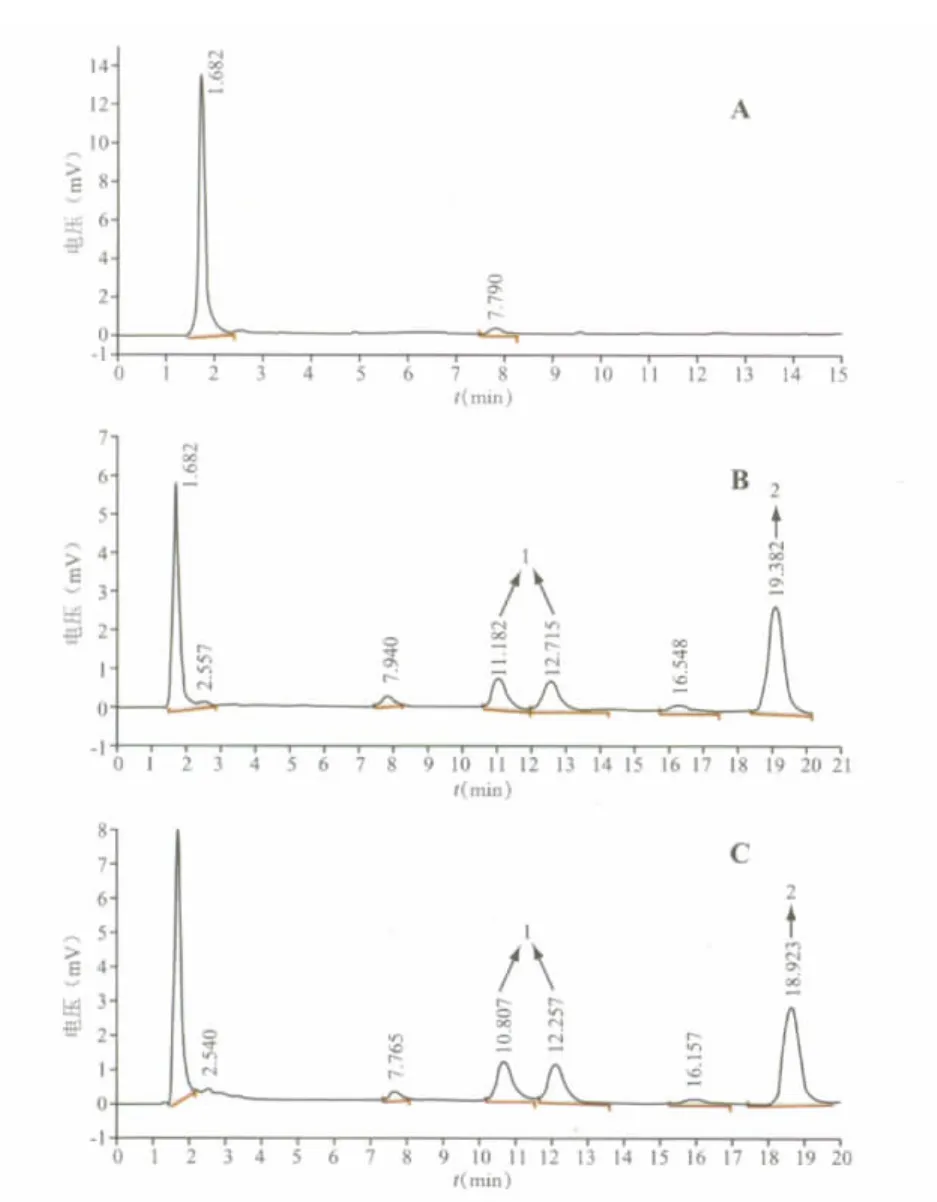
图2 水飞蓟宾的色谱图(A)空白血浆;(B)空白血浆加入水飞蓟宾与甲萘酚;(C)大鼠灌服水飞蓟宾亚微乳体内实测样品的色谱图;1-水飞蓟宾;2-甲萘酚
2.2.4 标准曲线的建立及方法学的验证
取空白大鼠血浆100 μL,分别加入水飞蓟宾标准溶液,配制成浓度为0.05、0.25、0.50、1.00、1.50、3.00、5.00 μg·mL-1的血浆样品,加入内标液10 μL,按照“2.2.2”血浆样品处理方法操作后,经HPLC法测定。以水飞蓟宾与甲萘酚峰面积的比值(As/Ai)对水飞蓟宾在血浆中的浓度(C)进行一元线性回归,绘制标准曲线。取空白大鼠血浆加入水飞蓟宾标准溶液,配制成低(0.05 μg·mL-1)、中(1.00 μg·mL-1)、高(5.00 μg·mL-1)三个质量浓度的血浆样品,分别加入内标液10 μL,按“2.2.2”血浆样品处理方法操作,考察方法学的回收率、精密度及血浆样品的稳定性。
实验得到的标准曲线方程为As/Ai=0.7948C+ 0.0098,r=0.9998,线性范围为0.05~5.00 μg·mL-1。测定日内及日间精密度(RSD)均小于5%(n=3),方法回收率为96%~98%(n=3),说明该方法符合生物样品的分析测定要求。水飞蓟宾血浆样品在-20℃条件下贮存5天及经过前处理后-20℃放置1天后样品浓度RSD均小于5%(n=3),说明血浆样品在分析所需要的时间周期内能够保持稳定。
2.2.5 血浆样品采集和处理
健康的雄性SD大鼠12只,随机分成对照组和实验组,每组6只,给药前禁食12 h,自由饮水。将受试制剂(自制水飞蓟宾亚微乳剂)与参比制剂(市售水飞蓟宾磷脂复合物水林佳胶囊)分别灌胃给药,剂量均为50 mg·kg-1,给药后0.25、0.5、0.75、1、1.5、2、3、4、6、8、10 h于大鼠眼底静脉丛取血 200 μL,5000 r·min-1离心10 min,取上层血浆,置-20℃冷冻保存备用。将血浆样品按“2.2.2”处理后,HPLC法测定血药浓度。
2.2.6 药动学软件处理
12只大鼠服用水飞蓟宾亚微乳剂及水林佳胶囊后的体内血药浓度-时间曲线见图3。
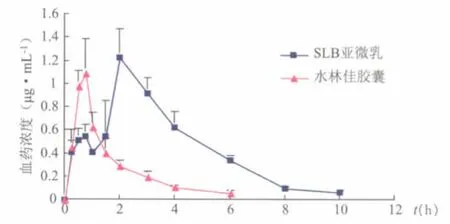
图3 大鼠灌服水飞蓟宾亚微乳和水林佳胶囊的血药浓度-时间曲线(,n=6)
用统计矩法对两种制剂的药动学数据进行处理,并对两种制剂的药动学参数进行t检验,结果如表2所示。水飞蓟宾亚微乳在大鼠体内平均滞留时间(MRT)延长为水林佳的2倍,清除速率(CL)为其1/3,表明亚微乳显著延长了药物在体内的滞留时间。水飞蓟宾亚微乳与水林佳胶囊的AUC0-∞分别为(1.83±0.38)mg·h·L-1和(4.72±0.48)mg·h·L-1,水飞蓟宾亚微乳在大鼠体内的生物利用度为水林佳胶囊的2.58倍,表明水飞蓟宾亚微乳促进了药物在胃肠道的吸收,提高了口服生物利用度。
表2 大鼠灌服水林佳胶囊和水飞蓟宾亚微乳的药动学数据(,n=6)

表2 大鼠灌服水林佳胶囊和水飞蓟宾亚微乳的药动学数据(,n=6)
注:*水飞蓟宾亚微乳与参比制剂水林佳胶囊比较,P<0.05
?
3 讨 论
水飞蓟宾为油水均难溶性药物,若直接将水飞蓟宾加入油相制备亚微乳,所得亚微乳载药量低,不能达到临床用药要求。本文将水飞蓟宾通过简单的薄膜分散法包裹于脂质材料中,提高了药物的脂溶性,与合成水飞蓟宾磷脂复合物相比,不需要繁琐的合成工艺和大量的有机溶剂,提高了制剂的生产效率和安全性。
水飞蓟宾口服亚微乳药时曲线出现双峰现象,可能与药物的释放情况有关。水飞蓟宾在油水两相中均有一定的分配,口服该制剂后,水相中的药物先释放出来被快速吸收出现第一个峰,而位于界面膜及包裹于油相脂质材料中的药物被吸收后而出现第二个峰。还可能与药物多部位吸收有关。水飞蓟宾亚微乳灌胃给药后,在胃中迅速吸收出现第一个峰,然后水飞蓟宾亚微乳进入肠道吸收出现第二个峰。
水飞蓟宾亚微乳显著提高了药物的口服生物利用度,其机理主要有以下几个方面:水飞蓟宾在胃肠道中易降解,将其包裹于亚微乳内部,可避免被胃肠道中的酶降解;亚微乳粒径较小,在进入胃肠道后能够广泛分布,与胃肠黏膜充分接触,有利于药物的吸收利用;亚微乳中的表面活性剂和助表面活性剂可以减低肠道表面粘液的粘度,增加了细胞膜的通透性,从而增加药物吸收[5];亚微乳中的脂质能够兴奋脂蛋白的形成,促进小肠淋巴循环,促进药物在小肠部位的淋巴转运,降低首过效应,从而提高了生物利用度[6]。
[1] 陈 红.水飞蓟宾的药理作用 [J].药学情报通讯,1991,9(3):7-9.
[2] Chopra S,Motwani SK,Iqbal Z,et al.Optimisation of polyherbalgelsforvaginaldrug delivery by Box-Behnken statistical design [J].J Pharmacokinet Biopharm,2007,67(1):120-31.
[3] Sznitowska M,Janicki S,Dabrowska E,et al.Submicron emulsions as drug carriers studies on destabilization potential of various drugs[J].Eur J Pharm Biopharm,2001,12(3):175-9.
[4] 张 勇,李 娟.PEG修饰水飞蓟素脂质体的制备及体外释放研究[J].药学与临床研究,2010,18(3):239-46.
[5] Chen Y,Li G,Wu XG,et al.Self-microemulsifying drug delivery system (SMEDDS)of vinpocetine:formulation development and in vivo assessment[J].Biol Pharm Bull,2008,31(1):118-25.
[6] Sha XY,Yan GJ,Wu YJ,et al.Effect of selfmicroemulsifying drug delivery systems containing Labrasol on tight junctions in Caco-2 cells[J].Eur J Pharm Biopharm,2005,24(5):477-86.