三氧化二砷治疗急性早幼粒细胞白血病的进展
祝洪明,李军民
上海交通大学医学院附属瑞金医院血液科,上海 200025
砷化合物是天然存在的化学物质,其作为药物应用已有2400多年的历史,中国传统医学有记载用砷化物治疗银屑病、梅毒等。18世纪西方医学采用亚砷酸钾(Fowler’s)溶液治疗慢性粒细胞性白血病(CML)[1]等。20世纪初,随着放化疗技术的兴起以及越来越多对砷剂毒性的报道[2],砷剂逐渐淡出了医学,尤其是血液肿瘤学领域。
急性早幼粒细胞白血病(APL)约占急性髓性白血病(AML)的10%~15%,较其他亚型的AML更易发生致死性出血及弥散性血管内凝血(DIC),曾被认为是最凶险的白血病。虽然传统的以蒽环类药物为基础的化疗可使75%APL患者获得完全缓解(CR),但是这种单纯化疗可能增加DIC的发生率,并且2年内复发率高达35%[3]。
通过对APL细胞遗传学及分子学的研究发现,98%以上的APL染色体核型发生t(15;17)(q22;q21)易位,表达早幼粒白血病基因(PML)和维甲酸受体基因(RARα)融合基因(PML-RARα)和融合蛋白,从而干扰APL细胞的正常转录,细胞分化凋亡受阻,停留在早幼粒细胞阶段。全反式维甲酸(ATRA)正是特异性作用于PML-RARα中的RARα部分,使APL细胞转录激活并分化成熟,开启了肿瘤诱导分化治疗的先河[4]。1992年,中国学者孙鸿德等首次报道用三氧化二砷 (As2O3)治疗32例APL患者,获得了较高的CR率和5年生存率[5]。1997年,Shen等进一步将As2O3用于治疗复发的APL患者,CR率可达90%[6]。由此,As2O3在复发难治及初治APL中的应用逐渐被科学家们所重视,并有望成为继ATRA之后治疗APL的一线用药。
1 As2O3治疗APL的作用机制
1.1 As2O3诱导APL细胞分化和凋亡
As2O3对APL细胞存在剂量依赖的双重作用,高浓度(0.5~2.0 μmol·L-1)时引起细胞凋亡,而低浓度(0.1~0.5 μmol·L-1)时诱导细胞分化[7]。进一步研究表明,As2O3主要依赖与巯基(-SH)结合而发挥作用[8]。
针对As2O3引起肿瘤细胞凋亡,目前研究已发现多条途径。调控基因转录方面,As2O3可通过下调抑癌基因Bcl-2[9]、抑制NF-κB释放[10]等使细胞进入程序化凋亡。另外,As2O3也可使细胞内的活性氧(ROS)生成增多或清除减少[11];或与线粒体通透性转运复合物(PTPC)上的巯基结合,开放PTPC,使线粒体跨膜电位下降,细胞色素C(Cyt-C)等外漏[12],可进一步激活Caspase级联反应,介导细胞凋亡[13]。
As2O3诱导APL细胞分化的作用不及ATRA明显,As2O3通常只能诱导APL细胞部分分化,而ATRA可使粒细胞分化成熟[4]。研究表明,环磷酸腺苷(cAMP)可与低浓度As2O3(0.25 μmol·L-1)协同作用,使NB4细胞及APL细胞彻底分化,而蛋白激酶A拮抗剂H89可阻断As2O3和cAMP的协同分化作用,提示APL细胞的分化过程中存在未知的信号交叉通路[14]。
1.2 As2O3降解PML-RARα融合蛋白
目前认为PML-RARα的PML部分是As2O3治疗APL的主要靶点,降解PML-RARα融合蛋白也是As2O3治疗APL的最重要的分子机制。近期研究发现,As2O3可直接作用于PML-RARα融合蛋白或野生型PML蛋白中的PML-RBCC(RING-B box-coiled coil)区域,诱导RING-锌指结构发生异构,进而促进其寡聚化、泛素化和蛋白酶体激活,最终导致PML降解[15]。在APL小鼠模型中发现蛋白酶体抑制剂可降低As2O3的诱导缓解率[16],反向证明了前述PML-RARα降解机制。另有研究表明As2O3+ATRA可增加溶酶体的自噬作用,也促进了PML-RARα的降解[17]。
1.3 As2O3和ATRA共同去除白血病启动细胞
Nasr等提出,APL中存在一群白血病启动细胞(LIC),它们可以通过自我更新不断产生成熟障碍的APL细胞,故APL治疗的关键不仅在于诱导细胞分化成熟,更需要清除LIC,才能获得根治。在APL小鼠模型和部分临床试验中发现,在ATRA和As2O3的共同作用下,PML-RARα降解,导致体内的LIC迅速被清除,而LIC的清除和细胞分化无明显相关性[16]。这也吸引更多的学者探究PML-RARα是如何刺激LIC的自我更新,以及如何更快速彻底地降解PML-RARα。目前就ATRA或脂质体ATRA单药给药、两者联合用药或ATRA+蒽环类药物化疗比较而言,ATRA和As2O3联合用药时PML-RARα降解最显著,LIC的清除也最快,同时可诱导细胞分化而无细胞毒作用,临床可获得完全缓解且无复发[18]。
1.4 As2O3与其他药物的协同作用
由于As2O3联合ATRA的治疗方案取得了显著疗效,故As2O3与ATRA的协同作用也成为研究热点。大量体外和体内实验证明:ATRA作用于PMLRARα的RARα部分,主要在转录基因水平发挥诱导APL细胞分化成熟的作用,而As2O3作用于PML部分,主要在转录后修饰和蛋白质水平发挥诱导细胞凋亡和降解PML-RARα的作用。但两者在诱导APL细胞的分化、凋亡和降解PML-RARα方面都存在一定的协同作用,机制之一可能为:ATRA使跨膜蛋白AQP9表达上调,显著提高As2O3的摄取率,从而增加APL细胞对As2O3的敏感性[19]。此外,抗坏血酸等药物可通过降低细胞内谷胱甘肽水平而促进As2O3对肿瘤细胞的凋亡作用[20]。
1.5 APL细胞对As2O3的耐药机制
随着对As2O3临床研究的大量开展,As2O3的耐药问题也逐渐有所报道。在前述As2O3与PMLRARα的结合位点的研究基础上,Goto等进一步探索该结合位点的改变,在其研究的2例As2O3耐药的APL患者中,均发现PML B2结合区域的氨基酸序列发生改变,As2O3无法对其产生泛素化作用,故不能降解PML-RARα[21]。由此推测,B2区域的突变可能是As2O3耐药的重要机制之一,但该突变是否为长期使用As2O3所致[22],以及还存在哪些不同形式和不同机制的结合位点改变,尚待进一步探讨。
2 As2O3治疗APL的临床应用
自ATRA成为APL一线诱导用药以来,APL的完全缓解率(CR)和总体生存率(OS)得到显著提高,目前APL的标准治疗包括ATRA+蒽环类药物为基础的化疗、蒽环类药物巩固治疗及ATRA±小剂量化疗持续1~2年的维持治疗,该方案可获得90%的CR率和80%的OS,但仍有5%~30%的患者复发,且多为高危患者(白细胞计数>10×109/L),易发生ATRA耐药[23-24]。传统的二线治疗通常为大剂量化疗继以自体或异体骨髓移植,而细胞毒药物的过多使用无疑增加了患者的早期死亡率和移植风险[25]。因此有必要探索新的治疗方案,以更高的疗效和更低的毒副作用改善患者的CR、OS及无复发生存(RFS)。表1列出了1996年以来As2O3用于治疗复发及初发APL的一些临床研究,其在APL各阶段的应用也日渐成为血液学家们关注的焦点。
2.1 As2O3治疗复发难治或不能耐受化疗的APL
20世纪90年代以来,中国学者Shen ZX等陆续报道用As2O3治疗初发和复发的APL患者获得50%~90%的CR率[3,6,26]。1998年Soignet等将As2O3用于12例复发的APL患者,11例达CR,其中8例PMLRARα融合基因转阴[27]。随后Soignet等继续开展了一项较大样本的多中心临床研究[28-29],对52例一次或多次复发的APL患者以As2O3诱导缓解,部分患者辅以As2O3巩固或维持治疗,获得了85%的CR率,预计18月OS和无复发生存率(RFS)分别为66%和50%。
Lengfelder[30]等将 1997~2011年的 14个以As2O3治疗复发APL的临床研究进行汇总,估计As2O3单药诱导可使86%的复发APL患者获得二次缓解(CR2),2年OS达50%~81%。基于以上研究,美国国家癌症综合网(NCCN)指南自2006年起推荐As2O3用于治疗标准诱导失败的APL,2007年起又将其作为不能耐受化疗的APL首选用药之一。
但目前As2O3治疗复发APL的研究多为单臂、短期临床试验,主要探讨了As2O3单药[31]或联合ATRA、吉妥单抗(GO)[32]、化疗等的疗效和副作用,只有Raffoux等进行了一项含20例患者的小型随机对照试验,比较As2O3和As2O3+ATRA治疗复发APL的疗效,发现无明显差异[33]。仍缺乏大样本的随机对照试验证明对于复发难治APL患者,As2O3与ATRA或蒽环类化疗药物联用是否获益更大。
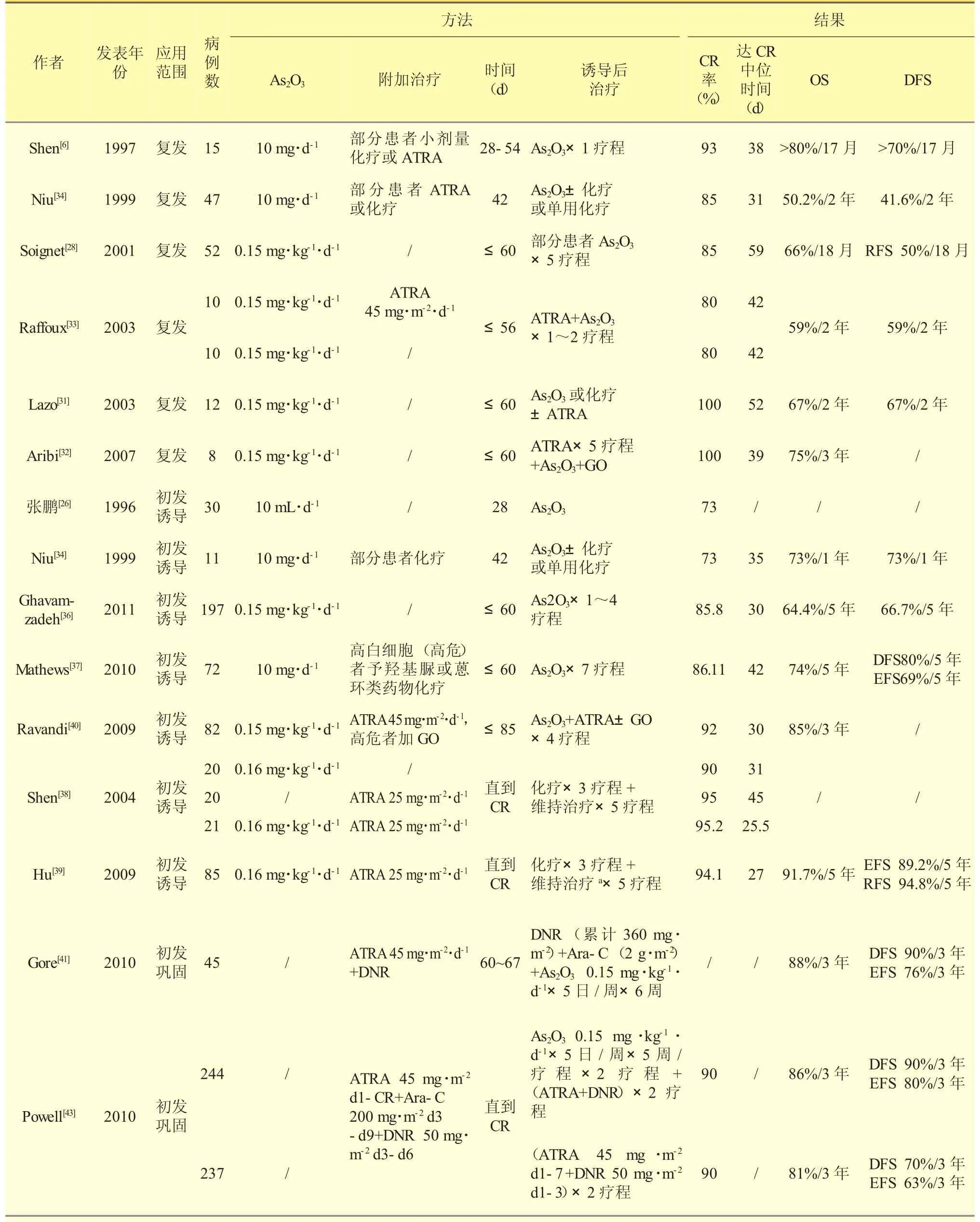
表1 三氧化二砷(As2O3)治疗急性早幼粒细胞白血病(APL)的临床研究
2.2 As2O3治疗初发APL的尝试
2.2.1 诱导治疗 As2O3在复发难治APL患者中的应用已得到广泛认可,而对于初发APL患者,As2O3又可带来哪些新的获益,这已成为当前研究的新焦点。1999年至今,As2O3用于初发APL诱导缓解治疗的研究集中讨论了As2O3是否可成为诱导治疗的一线用药,增加现有诱导方案的疗效,包括CR、OS、无病生存(DFS)等,以及As2O3是否可减低甚至取代化疗,从而使细胞毒作用最小化。
张鹏[26]、Niu[34]等早在20世纪90年代就尝试用As2O3治疗初发APL患者,CR率分别达73.3%和72.7%,初步证明了As2O3可作为初发APL患者的诱导用药。
随后Ghavamzadeh等对197例初发APL患者以As2O3单药诱导+As2O3×1~4疗程的巩固治疗,CR率达85.8%,5年OS和DFS分别为64.4%、66.7%,证明 As2O3单药诱导治疗初发 APL疗效显著[35-36]。Mathews等也以As2O3单药诱导为主要手段,得出了与前述临床实验相似的结论,并进一步发现低危(白细胞(WBC)<5×109/L及血小板计数(PLT)>20×109/L)和高危(除上述标准外)患者的5年OS和无事件生存(EFS)存在显著差异,低危组患者的疗效与传统诱导治疗相当,提示As2O3单药对低危APL的诱导效果理想,可用于不能耐受化疗的初发APL患者,而对高危APL可能需增加其他干预手段,如ATRA或化疗[37]。
在As2O3单药诱导获得成功的同时,Shen等还开展了一项随机对照试验,比较ATRA、As2O3及ATRA+As2O3对初治APL的疗效,结果发现三组患者CR率无显著差异,而联合用药组较任一单药治疗组达CR的用时更短、DFS持续时间更长,即CR的质量更高[38]。据此,Hu等将ATRA+As2O3组扩展至85例患者,并结合 ATRA和 As2O3协同作用于PML-RARα的分子机制,推荐As2O3成为APL诱导治疗的一线用药[39]。
Estey、Ravandi等采用ATRA+As2O3±GO联合用药,进行诱导及巩固治疗,亦获得较高的CR率和OS率,并提出对于初治APL患者 (尤其是低危患者),As2O3可替代传统方案中的化疗药物,从而减低细胞毒作用[40]。
2.2.2 巩固维持治疗 鉴于As2O3可显著提高复发APL患者的CR2,部分学者设想,As2O3若早期介入治疗,如加入巩固或维持治疗,是否可改善患者CR后的质量。
Gore[41]等对45例ATRA+柔红霉素(DNR)诱导缓解后的APL患者进行阿糖胞苷 (Ara-C)+DNR+ As2O3×1疗程的巩固治疗,其中DNR总量低于标准治疗剂量,而Ara-C用量稍增加,3年DFS和OS分别为90%和88%,与传统的ATRA+DNR巩固治疗的疗效相仿[42],而As2O3的使用可减少蒽环类药物的累积剂量及可能产生的心肌毒性。
Powell等的C9710试验是目前唯一研究As2O3在巩固治疗中所起作用的大型多中心随机对照试验。该临床研究以ATRA+DNR+Ara-C为诱导,试验组较对照组在巩固治疗中加入了2个疗程的As2O3,结果表明As2O3组的EFS、DFS分别为80%和90%,较非As2O3组(EFS 63%、DFS 70%)均明显获益[43]。该试验证明了As2O3用于巩固治疗可显著降低复发率,同时减轻化疗药物引起的骨髓抑制和心脏毒性等,但对于As2O3的具体用法用量以及是否可替代阿糖胞苷(Ara-C)等问题,仍有待进一步探索。
目前欧洲正在进行的APL2006[44]临床试验将APL患者分为低/中危组和高危组,试图回答在低/中危组病人中,As2O3或ATRA是否可替代Ara-C进行巩固治疗,以及对于高危组病人,As2O3与Ara-C联合巩固治疗是否可以减低后者的用量,从而降低细胞毒作用。
因APL93研究[45]与AIDA 0493研究[46]在APL的维持治疗上存在分歧:前者认为间断ATRA+持续6-巯基嘌呤(6-MP)+甲氨蝶呤(MTX)的方案疗效佳,降低早期复发,而不增加远期复发;而后者认为对于巩固治疗后PML-RARα阴性的患者,维持治疗没有体现任何远期优势,由此推测维持治疗的疗效主要取决于前期诱导和巩固治疗时药物及疗程数的差异,故As2O3用于APL维持治疗的研究也少有报道。Hu[39]等在APL 93维持治疗方案的基础上加用As2O3,但其较高的DFS、EFS等与其新颖的诱导和巩固治疗方案也不无关系。Au等研究了长期口服As2O3的疗效、可行性及安全性,希望通过口服给药方式降低维持治疗期间的住院率[47],并进一步研究口服As2O3后的血浆和脑脊液(CSF)砷浓度,提示可能对中枢APL有一定疗效[48]。
2.3 “上海方案”的成果与展望
近年发现,WBC升高和PLT降低是影响APL患者预后的危险因素,据此可将患者进行高危(WBC>10×109/L)、中危(WBC≤10×109/L,PLT≤40× 109/L)、低危(WBC≤10×109/L,PLT>40×109/L)分层治疗[49]。2010年起,NCCN指南明确了APL的分层治疗方案,将ATRA加入巩固治疗,并在高危组患者的巩固治疗中加入中大剂量Ara-C,但均未将As2O3作为一类推荐,且目前治疗方案的化疗药物负荷仍较大。
2001年开始,上海瑞金医院将As2O3作为APL的一线用药之一,并形成了以ATRA+As2O3±伊达比星(IDA)为诱导、DA(DNR+Ara-C)/中剂量Ara-C/HA(高三尖杉碱酯HHT+Ara-C)方案为巩固、ATRA/As2O3/6-MP或MTX交替5疗程为维持的 “上海方案”(见表1 Hu 2009年),获得了94.1%的CR率,5年OS、EFS分别为91.7%和89.2%,CR患者的 5年 RFS高达94.8%[39]。结合分层治疗的理念,瑞金医院即将开展一项多中心临床研究,通过随机对照试验回答如下两个问题:①As2O3是否可替代低危患者的化疗?②是否可降低甚至取代高危患者Ara-C的使用?
3 As2O3治疗APL的药代动力学及不良反应
3.1 药代动力学
虽然As2O3是剧毒化合物,人一次口服As2O3的致死剂量约为60 mg,但作为药物小剂量使用时,尚具有较高的安全性和良好的耐受性。目前治疗APL的诱导剂量10 mg·d-1或0.15 mg·kg-1·d-1,均由传统中医使用剂量沿用而来,关于As2O3剂量、疗程与毒性的Ⅰ期临床试验因存在较大风险,至今仍未开展,其药代动力学研究仅局限于数个临床研究。
目前认为,As2O3静脉给药后约4 h血浆浓度达峰值[6],血浆中半衰期较短,约12 h,且不随连续给药而变化[51]。As2O3经血流分布至全身各脏器,经氧化为五价砷、甲基化为甲基砷酸(MMA)、二甲基砷酸(DMA)等过程[52],最终每天摄入的砷有1%~8%至32%~65%经尿液排出[51]。毛发、指甲等组织的蛋白中富含巯基,As2O3易与之结合而沉积,但停药后毛发、指甲中的砷含量逐渐下降,而尿砷一段时间内可持续排出[6,52],但长期随访尿砷含量在正常范围内。故对血砷、尿砷及毛发、指甲中的砷含量进行检测,有助于了解患者体内砷的短期负荷量和长期蓄积量,预防急慢性不良反应的发生。
3.2 近期不良反应
As2O3的主要近期不良反应包括:APL分化综合征(7%~35%)、高白细胞血症(32%~72%)、心电图异常、肝功能损害、周围神经病变、胃肠道反应、皮疹、高血糖等[30]。
APL综合征(APLDS)目前认为是As2O3所致最严重的副作用,旧称维甲酸综合征,但As2O3单药[28,35,37]或与 ATRA联合[40]诱导治疗时也可出现体重增加、水肿、发热、呼吸困难等类维甲酸综合征表现,故统称为APLDS。上述临床症状大多可通过地塞米松控制,但如出现呼吸窘迫、肺浸润等亦可致死。研究表明,As2O3与ATRA联合应用并不增加APLDS的发生率[38]。
高白细胞血症通常发生在As2O3治疗早期,且白细胞增高的患者发生APLDS的概率更高[50],故近期临床试验中若出现高白细胞血症,多采用羟基脲或蒽环类药物为主的化疗等进行干预[37]。
心电图异常主要表现为Q-T间期延长[28,40],其他可有T波改变、阵发性室上性心动过速[37]等,亦可发生扭转性室性心动过速[28]等威胁生命的心律失常。上述心电活动改变可能与As2O3影响心肌细胞ROS,从而导致动作电位持续时间延长有关,低血钾或低血镁可增加心脏事件的发生率[53]。因此治疗过程中需监测心电图及维持电解质平衡。
肝功能损害的发生率亦较高,Hu[39]等报道了75%的患者在As2O3联合ATRA治疗中发生肝酶升高,但大多为Ⅰ-Ⅱ级损害,表现为肝酶和/或胆红素轻度升高,而无肝区疼痛、黄疸等报道,均未中止用药,罕有Ⅲ-Ⅳ级肝功能损害,且疗程结束后长期随访患者肝功能均恢复正常。
3.3 远期毒副作用
目前对于砷剂蓄积作用和慢性中毒的报道多涉及水资源污染和工业区的空气污染,其中最严重的是其致癌作用。长期慢性接触砷含量超标的饮用水或空气,皮肤癌、肺癌、膀胱癌等恶性肿瘤发生率明显升高,可能与砷剂引起细胞内ROS增多、氧化还原平衡破坏,导致DNA损伤有关[54]。Hu等随访2001年至2008年经ATRA+As2O3治疗的APL患者,未发现As2O3致二次肿瘤的病例[39],其他几项临床试验的长期随访[36-37]也均未报道致皮肤癌等二次肿瘤。
慢性砷中毒还可引起心血管系统、消化系统、神经系统等多系统病变,如心律失常[55]、血管内皮受损、高血压、恶心呕吐、腹痛腹泻、肝功能异常、肝硬化、手足麻木、肌肉无力、神经传导速度下降等[56]。
以上毒副作用基本涵盖了As2O3所致的常见近期不良反应,提示临床医生需监测患者体内的砷剂蓄积量,从而合理制定As2O3的使用剂量和疗程,避免短期不良反应转变为慢性砷中毒甚至二次肿瘤。Hu等对33例As2O3停药2年以上的患者进行血、尿、毛发及指甲的砷含量测定,发现上述指标较正常对照仅轻度升高,而血、尿砷浓度较治疗中的患者明显下降,尿砷含量明显低于安全限值,同时心电图、超声心动图、胸片等均无明显异常,亦未发现皮损、肿瘤等[39],提示治疗剂量的As2O3安全性较高。但由于慢性砷中毒尤其是致肿瘤作用常在10~20年后方有所表现,故仍需长期随访患者的砷蓄积情况。
4 总 结
As2O3用于治疗APL已逾20年,大量临床试验证明As2O3对各阶段、各年龄段的APL患者均有显著疗效[28,36,43,57],这有赖于其作用于早幼粒细胞的分子机制。研究证明As2O3可通过诱导细胞分化和凋亡、降解PML-RARα、清除LIC、抑制肿瘤细胞增殖和抑制血管生成等多条途径发挥抗肿瘤作用[8,16],其中As2O3和ATRA分别作用于PML-RARα的PML部分和RARα部分,协同降解PML-RARα而无交叉耐药,被认为是治疗APL最重要的分子机制[58],也是临床以ATRA+As2O3联合治疗APL的重要理论依据,树立了肿瘤靶向治疗的成功典范。
对于复发难治的APL患者,As2O3较传统的二线方案明显改善了患者的CR2,达80%以上,同时减少了细胞毒药物的使用,提高患者的长期生存率和骨髓移植成功率[25],已成为复发难治APL的推荐用药。而在初发APL中,现有的治疗方案虽可获得90%的CR,但复发率仍较高,将As2O3引入当前的诱导、巩固和/或维持治疗中,可缩短达到CR的时间[38],更重要的是,可明显提高APL患者的OS、DFS、EFS、RFS等[43],使APL从最凶险的白血病变为预后最好、可能治愈的白血病[4]。
As2O3作为一种高毒性无机化合物,长期慢性接触可致皮肤、心血管、消化系统、神经系统等多组织器官病变[54],甚至可致皮肤癌、肺癌、膀胱癌等二次肿瘤[55],小剂量用于治疗APL可发生APLDS、高白细胞血症、心电图异常、肝功能损害、周围神经病变等不良反应[30],多可逆或可控,但目前尚未有报道致二次肿瘤作用,严重的脏器损害亦罕见,治疗结束2年后,在人体内无明显蓄积[39],提示治疗剂量的As2O3耐受性好、安全性高。
目前已上市的As2O3主要有亚砷酸氯化钠注射液(商品名:伊泰达,哈尔滨伊达药业)、三氧化二砷注射剂(商品名Trisenox,美国Cell Therapeutics公司)、注射用三氧化二砷冻干粉针剂(商品名:纳维雅,北京双鹭药业)等,临床疗效与不良反应均无明显差异。As2O3用于治疗APL获得了理想的疗效,不良反应轻微,有望通过进一步临床试验使其成为初发APL的一线用药,第二代As2O3也正在研发中。
随着对APL危险程度分级、分子学缓解(mCR)等认识的更新[59]及微小残留病灶(MRD)测定的开展[60],As2O3的治疗目标也相应改变,希望在保持高mCR率、长期RFS和低毒性的同时,As2O3还可替代低危组病人的化疗、减低或取代中高危组病人的大剂量化疗(主要为Ara-C),从而降低化疗的毒副作用,部分APL也有望成为无需化疗而获得治愈的血液学肿瘤。
[1] Waxman S,Anderson KC.History of the development of arsenic derivatives in cancer therapy[J].Oncologist, 2001,2(Suppl6):3-10.
[2] Evens AM,Tallman MS,Gartenhaus RB.The potential of arsenic trioxide in the treatment of malignant disease: past,present,and future[J].Leuk Res,2004,28(9):891-900. [3] Degos L.The history of acute promyelocyticleukaemia [J].Br J Haematol,2003,122(4):539-53.
[4] Zhou GB,Zhang J,Wang ZY,et al.Treatment of acute promyelocytic leukaemia with all-trans retinoic acid and arsenic trioxide:a paradigm of synergistic molecular targeting therapy[J].Phil Trans R Soc B, 2007,362(1482):959-71.
[5] 孙鸿德,马 玲,胡晓晨,等.癌灵1号结合中医辨证治疗急性早幼粒白血病32例 [J].中国中西医结合杂志,1992,12(3):170-1.
[6] Shen ZX,Chen GQ,Ni JH,et al.Use of arsenic trioxide(As2O3)in the treatmentofacute promyelocytic leukemia(APL):II.Clinical efficacy and pharmacokinetics in relapsed patients[J].Blood,1997,89(9):3354-60.
[7] Chen GQ,Shi XG,Tang W et al.Use of arsenic trioxide (As2O3)in the treatment of acute promyelocytic leukemia (APL):I.As2O3exerts dose-dependent dual effects on APL cells[J].Blood,1997,89(9):3345-53.
[8] Miller WH Jr.,Schipper HM,Lee JS,et al.Mechanisms of action of arsenic trioxide[J].Cancer Res, 2002,62(14):3893-903.
[9] Chen GQ,Zhu J,Shi XG et al.In vitro studies on cellular and molecular mechanisms of arsenic trioxide (ATO)in the treatment of acute promyelocytic leukemia: ATO induces NB4 cell apoptosis with downregulation of Bcl-2 expression and modulation of PML--RAR alpha/PML proteins[J].Blood,1996,88(3):1052-61.
[10] Kapahi P,Takahashi T,Natoli G,et al.Inhibition of NF-κB activation by arsenite through reaction with a critical cysteine in the activation loop of IκB kinase [J].J Biol Chem,2000,275(46):36062-6.
[11] Dai J,Weinberg RS,Waxman S,et al.Malignant cells can be sensitized to undergo growth inhibition and apoptosis by arsenic trioxide through modulation of the glutathione redox system[J].Blood,1999,93(1):268-77.
[12] Larochette N,Decaudin D,Jacotot E,et al.Arsenite induces apoptosis via a direct effect on the mitochondrial permeability transition pore[J].Exp Cell Res, 1999,249(2):413-21.
[13] Huang XJ,Wiernik PH,Klein RS,et al.Arsenic trioxide induces apoptosis of myeloid leukemia cells by activation of caspases[J].Med Oncol,1999,16(1):58-64.
[14] Zhu Q,Zhang JW,Zhu HQ,et al.Synergic effects of arsenic trioxide and cAMP during acute promyelocytic leukemia cell maturation subtends a novel signaling cross-talk[J].Blood,2002,99(3):1014-22.
[15]Zhang XW,Yan XJ,Zhou ZR,et al.Arsenic trioxide con-trols the fate of the PML-RARα oncoprotein by directly binding PML[J].Science,2010,328(5975):240-3.
[16] Nasr R,Guillemin MC,Ferhi O,et al.Eradication of acute promyelocytic leukemia-initiating cells through PML-RARA degradation[J].Nat Med,2008,14(12): 1333-42.
[17] Isakson P,Bjøra°s M,Bøe SO,et al.Autophagy contributes to therapy-induced degradation of the PML/ RARα oncoprotein[J].Blood,2010,116(13):2324-31.
[18] Kogan C.Curing APL:Differentiation or destruction? [J].Cancer Cell,2009,15(1):7-8.
[19] Leung J,Pang A,Yuen WH,et al.Relationship of expression of aqua glyceroporin 9 with arsenic uptake and sensitivity in leukemic cells[J].Blood,2007,109 (2):740-6.
[20] Dai J,Weinberg RS,Waxman S,et al.Malignant cells can be sensitized to undergo growth inhibition and apoptosis by arsenic trioxide through modulation of the glutathione redox system[J].Blood,1999,93(1):268-77.
[21] Goto E,Tomita A,Hayakawa F,et al.Missense mutations in PML-RARA critical for the lack of responsiveness to arsenic trioxide treatment[J].Blood,2011, 118(6):1600-9.
[22] Gallagher RE.Mutants strike again in APL[J].Blood, 2011,118(6):1432-4.
[23] Tallman MS.Treatment of relapsed or refractory acute promyelocytic leukemia[J].Best Pract Res Clin Haematol, 2007,20(1):57-65.
[24] Warrell RP Jr,de The H,Wang ZY,et al.Acute promyelocytic leukemia[J].N Engl J Med,1993,329 (3):177-89.
[25] Thomas X,Dombret H,Cordonnier C,et al.Treatment of relapsing acute promyelocytic leukemia by all-trans retinoic acid therapy followed by timed sequential chemotherapy and stem cell transplantation [J]. Leukemia,2000,14(6):1006-13.
[26] 张 鹏,王树叶,胡龙虎,等.三氧化二砷注射液治疗72例急性早幼粒细胞白血病 [J].中华血液学杂志,1996,17(2):58-60.
[27] Soignet SL,Maslak P,Wang ZG,et al.Complete remission after treatment of acute promyelocytic leukemia with arsenic trioxide[J].N Engl J Med, 1998,339(19):1341-8.
[28]Soignet SL,Frankel SR,Douer D,et al.United States multicenter study of arsenic trioxide in relapsed acute promyelocytic leukemia[J].J Clin Oncol,2001,19(18): 3852-60.
[29] Dombret H,Fenaux P,Soignet SL,et al.Established practice in the treatmentof patients with acute promyleocytic leukemia and the introduction of arsenic trioxide as a novel therapy[J].Semin Hematol,2002, 39(2 Suppl 1):8-13.
[30] Lengfelder E,Hofmann WK,Nowak D.Impact of arsenic trioxide in the treatment of acute promyelocytic leukemia[J].Leukemia,2012,26(3):433-42.
[31] Lazo G,Kantarjian H,Estey E,et al.Use of Arsenic trioxide (As2O3)in the treatment of patients with acute promyelocytic leukemia[J].Cancer,2003,97(9):2218-24.
[32] Aribi A,Kantarjian HM,Estey EH,et al.Combination therapy with arsenic trioxide,all-trans retinoic acid,and gemtuzumabozogamicin in recurrentacute promyelocytic leukemia[J].Cancer,2007,109(7):1355-9.
[33] Raffoux E,Rousselot P,Poupon J,et al.Combined treatment with arsenic trioxide and all-trans-retinoic acid in patients with relapsed acute promyelocytic leukemia[J].J Clin Oncol,2003,21(12):2326-34.
[34] Niu C, Yan H, Yu T, et al. Studies on treatment of acute promyelocytic leukemia with arsenic trioxide: remission induction, follow-up, and molecular monitoring in 11 newly diagnosed and 47 relapsed acute promyelocytic leukemia patients[J].Blood,1999,94(10):3315-24.
[35] Ghavamzadeh A,Alimoghaddam K,Ghaffari SH,et al. Treatment of acute promyelocytic leukemia with arsenic trioxide without ATRA and/or chemotherapy[J]. Ann Oncol,2006,17(1):131-4.
[36] Ghavamzadeh A,Alimoghaddam K,Rostami S,et al. Phase II study of single-agent arsenic trioxide for the front-line therapy of acute promyelocytic leukemia[J]. J Clin Oncol,2011,29(20):2753-7.
[37] Mathews V,George B,Chendamarai E,et al.Singleagentarsenic trioxide in the treatmentofnewly diagnosed acute promyelocytic leukemia: longterm follow-up data[J].J Clin Oncol,2010,28(24):3866-71. [38] Shen ZX,Shi ZZ,Fang J,et al.All-trans retinoic acid/ As2O3combination yields a high quality remission and survival in newly diagnosed acute promyelocytic leukemia [J].Proc Natl Acad Sci USA,2004,101(15):5328-35.
[39] Hu J,Liu YF,Wu CF,et al.Long-term efficacy and safety of all-trans retinoic acid arsenic trioxide-based therapy in newly diagnosed acute promyelocytic leukemia[J]. Proc Natl Acad Sci USA,2009,106(9):3342-7.
[40] Ravandi F,Estey E,Jones D,et al.Effective treatment of acute promyelocytic leukemia with all-transretinoic acid,arsenic trioxide,and gemtuzumabozogamicin[J].J Clin Oncol,2009,27(4):504-10.
[41] Gore SD,Gojo I,Sekeres MA,et al.Single cycle of arsenic trioxide based consolidation chemotherapy spares anthracycline exposure in the primary management of acute promyelocytic leukemia[J].J Clin Oncol, 2010,28(6):1047-53.
[42] Lo-Coco F,Avvisati G,Vignetti M,et al.Front-line treatment of acute promyelocytic leukemia with AIDA induction followed by risk-adapted consolidation for adultsyounger than 61 years:results of the AIDA-2000 trial of the group[J].Blood,2010,116(17):3171-9.
[43] Powell BL,Moser B,Stock W,et al.Arsenic trioxide improves event-free and overall survival for adults with acutepromyelocyticleukemia:North American Leukemia Intergroup Study C9710[J].Blood,2010, 116(19):3751-7.
[44] Adès L,Raffoux E,Chevret S,et al.Arsenic trioxide (ATO)in the consolidation treatment of newly diagnosed APL.First interim analysis of a randomized trial (APL 2006)by the French Belgian Swiss APL group [J].Blood (ASH Annual Meeting Abstracts),2010, 116:Abstract 505.
[45] Adès L,Guerci A,Raffoux E,et al.Very long-term outcome of acute promyelocytic leukemia after treatment with all-trans retinoic acid and chemotherapy: the European APL Group experience[J].Blood,2010, 115(9):1690-6.
[46]Avvisati G,Lo-Coco F,Paoloni FP,et al.AIDA 0493 protocol for newly diagnosed acute promyelocytic leukemia:very long-term results and role of maintenance[J].Blood,2011,117(18):4716-25.
[47] Au WY,Kumana CR,Lee HK,et al.Oral arsenic trioxide-based maintenance regimens for first complete remission of acute promyelocytic leukemia:a 10-year follow-up study[J].Blood,2011,118(25):6535-43.
[48] Au WY,Tam S,Fong BM,et al.Determinants of cerebrospinalfluid arsenic concentration in patients with acute promyelocytic leukemia on oral arsenic trioxide therapy[J].Blood,2008,112(9):3587-90.
[49] Sanz MA,Lo-Coco F,Martin G,et al.Definition of relapse risk and role of non-anthracycline drugs for consolidation in patients with acute promyelocytic leukemia: a joint study of the PETHEMA and GIMEMA cooperative groups[J].Blood,2000,96(4):1247-53.
[50] Camacho LH,Soignet SL,Chanel S,et al.Leukocytosis and the retinoic acid syndrome in patients with acute promyelocytic leukemia treated with arsenic trioxide [J].J Clin Oncol,2000,18(13):2620-5.
[51] Mathews V,Chendamarai E,George B,et al.Treatment of acute promyelocytic leukemiawith single-agent arsenic trioxide[J].Mediterr J Hematol Infect Dis, 2011,3:22011056.
[52] Fujisawa S,Ohno R,Shigeno K,et al.Pharmacokinetics of arsenic species in Japanese patients with relapsed or refractory acute promyelocytic leukemia treated with arsenictrioxide[J].CancerChemother Pharmacol,2007,59(4):485-93.
[53] Raghu KG,Yadav GK,Singh R,et al.Evaluation of adverse cardiac effects induced by arsenic trioxide,a potent anti-APL drug[J].J Environ Pathol Toxicol Oncol,2009,28(3):241-52.
[54] Liu SX,Athar M,Lippai I,et al.Induction of oxyradicals by arsenic:implication for mechanism of genotoxicity[J].Proc Natl Acad Sci USA,2001,98(4):1643-8.
[55] Mumford JL,Wu K,Xia Y,et al.Chronic arsenic exposure and cardiac repolarization abnormalities with QT interval prolongation in a population-based study [J].Environ Health Perspect,2007,115(5):690-4.
[56] Jomova K,Jenisova Z,Feszterova M,et al.Arsenic: toxicity,oxidative stress and human disease[J].J Appl Toxicol,2011,31(2):95-107.
[57] Zhou J,Zhang YM,Li JM,et al.Single-agent arsenic trioxide in the treatment of children with newly diagnosed acute promyelocytic leukemia[J].Blood,2010, 115(9):1697-702.
[58] Nasr R,Breitenbach VL,Zhu J,et al.Therapy-induced PML/RARα proteolysis and acute promyelocytic leukemia cure[J].Clin Cancer Res,2009,15(20):6321-6.
[59] Lo-Coco F,Avvisati G,Vignetti M,et al.Front-line treatment of acute promyelocytic leukemia with AIDA induction followed by risk-adapted consolidation:results of the AIDA-2000 trial of the Italian GIMEMA group[J].Blood,2004,104(17):3171-9.
[60] Chendamarai E,Balasubramanian P,George B,et al. Role of minimal residual disease monitoring in acute promyelocytic leukemia treated with arsenic trioxide in frontline therapy[J].Blood,2012,119(15):3413-9.