早产儿低血糖与胰岛素、C肽、胰高血糖素的关系研究
李慧竹 林建军 兰秀聪 金艳艳
早产儿低血糖是早产儿出生时的常见病,也是早产儿脑损伤的重要原因之一,可引起远期神经-精神发育障碍,影响生存质量,降低人口素质[1,2]。早产儿低血糖造成脑损伤的程度,与早产儿低血糖持续的时间有关,低血糖持续时间越长,脑损伤越严重,如能及时诊治,可防止永久性中枢神经系统后遗症的发生。以往研究较多的是早产儿母子因素如疾病、出生体重、出生胎龄及伴发疾病等,对早产儿低血糖内在的因素研究较少[2,3]。本研究通过对早产儿出生后24h内、7天,测定血清中的胰岛素(insulin,Ins)、C-肽(C-eptide,C-ep)、胰高血糖素(glucagon,Gc)水平,探讨以上3者与早产儿低血糖的关系,为治疗早产儿低血糖提供理论依据。
资料与方法
1.对象:2010年1~12月生后24h内入住笔者医院新生儿科,胎龄29~34周,无其他合并症;所选病例母亲包括孕期在内一直身体健康,产时除剖宫产中常规滴注平衡液和常规麻醉药物外,无其他用药史。患儿采血前1h内无输注葡萄糖、静脉营养药物,整个过程中未使用氨茶碱、皮质醇、镇静剂等影响血糖的药物,附合上述情况的早产儿共89例,将其分为观察组1和观察组2,观察组1为早产儿低血糖组(34例),观察组2为早产儿正常血糖组(55例)。设对照组为足月儿,随机选取同时期出生的足月儿53例,其他条件均与观察组相同,其中3例为低血糖(由于出生后3h内尚未喂养,查到血糖不正常,给予喂糖水后血糖恢复正常),给予剔除,50例正常血糖足月产儿作为对照组。
2.方法:(1)血糖检测方法:根据2002年《诸福棠实用儿科学》(7版),新生儿低血糖诊断的标准,不论胎龄和出生体重,凡出生24h内血糖<2.2mmol/L(40mg/dl),诊断为低血糖。本观察组以此为依据,对早产儿的低血糖进行诊断。对符合入院条件的早产儿,入院时的同步血糖,采用强生(中国)公司血糖微量检测仪,纸片法检测其血糖水平。对于入院时正常血糖者,采用每8h 1次监测血糖;对于入院时低血糖者,不论有无低血糖的症状,均给予10%葡萄糖1ml/kg静脉注射1次后,改用10%葡萄糖静脉滴注,速度为4~8mg/kg,每2h检测血糖1次,至血糖3次正常者为稳定,稳定后改每8h 1次测定血糖。对微量血糖值<1.1mmol/L者加测即刻静脉血糖对照。对符合入院条件的足月新生儿采用出生后喂养前测定血糖。(2)血标本收集:采血时间分别为出生后24h内(与入院时血糖同步)和第7天上午7:00~9:00(停输液4h以上和空腹3h后)抽血,取股静脉血3m l,采血后离心10min,分离血清,置-80℃冰箱待测。(3)标本的测定:使用放射免疫分析方法,由笔者医院放射免疫科专科检验师独立完成。放免药盒由原子高科股份有限公司提供,按照试剂盒说明进行操作,双份血清重复对照试验。胰岛素(Ins)灵敏度1.5m IU/L,C肽(C-ep)灵敏度0.1ng/ml,胰高血糖素(Gc)灵敏度20pg/m l。采用西安262厂生产的FJ2008psr放射免疫计数仪。
3.统计学方法:采用SPSS 16.0统计软件进行数据分析,计数资料采用χ2检验,计量资料采用F检验,运用逐步线性回归和Bivariate相关分析,以P<0.05为差异有统计学意义。
结果
1.一般情况:入选89例早产儿中有34例24h内发生低血糖,55例血糖正常;53例足月产儿,有3例发生低血糖予剔除后,以50例正常血糖足月儿作为对照组。早产儿组低血糖者给予输注10%葡萄糖后,血糖水平在24h内稳定者24例,3天内稳定者7例,5天内稳定者3例。早产儿的低血糖发生率明显高于足月儿(χ2=18.19,P<0.01)。同步血糖与出生体重(r=0.416,P<0.05)、胎龄(r=0.421,P<0.01)、胰高血糖素(r=0.348,P<0.05)密切相关。具体数据见表1。
2.胰岛素、C肽、胰高血糖素水平:3组间各时段Ins、C-ep差异无统计学意义(P>0.05);各组1天与7天的Ins、C-ep比较,无明显变化(P>0.05)。生后24h内Gc含量,早产儿正常血糖组低于足月儿组(P<0.01),早产儿低血糖组低于早产儿正常血糖组(P<0.05),出生后24h内Gc含量与胎龄、出生体重呈正相关。出生7天3组Gc含量差异无统计学意义(P>0.05);而早产儿低血糖组和早产儿正常血糖组1天与7天的Gc含量比较存在显著性差异(P<0.01),提示生后早产儿Gc恢复较快,早产儿低血糖组尤为明显。具体数据见表1。
表1 Ins、C-ep、Gc在早产儿、足月儿中不同时段的比较(±s)
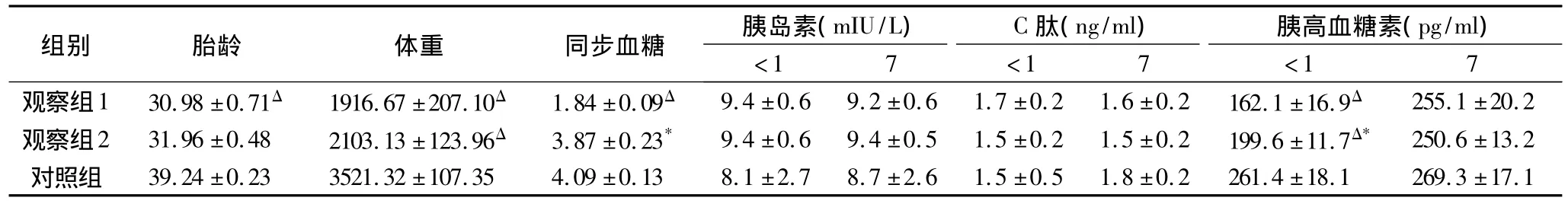
表1 Ins、C-ep、Gc在早产儿、足月儿中不同时段的比较(±s)
观察组与对照组比较,ΔP<0.01;观察组1与观察组2比较,*P<0.05
) C肽(ng/ml)组别 胎龄 体重 同步血糖 胰岛素(m IU/L 胰高血糖素(pg/ml)<1 7 <1 7 <1 7观察组1 30.98±0.71Δ 1916.67±207.10Δ 1.84±0.09Δ 9.4±0.6 9.2±0.6 1.7±0.2 1.6±0.2 162.1±16.9Δ255.1±20.2观察组2 31.96±0.48 2103.13±123.96Δ 3.87±0.23* 9.4±0.6 9.4±0.5 1.5±0.2 1.5±0.2 199.6±11.7Δ* 250.6±13.2对照组 39.24±0.23 3521.32±107.35 4.09±0.13 8.1±2.7 8.7±2.6 1.5±0.5 1.8±0.2 261.4±18.1 269.3±17.1
讨论
低血糖是一种早产儿较常见的并发症,发生率37.04%,本组病例发生率为38.2%[1]。其影响因素多而复杂,除早产本身这个最重要的高危因素外,尚有母亲和患儿方面的诸多因素,如体重与胎龄不相符合的新生儿,宫内发育迟缓的新生儿,糖尿病母亲所生的新生儿、围生期缺氧缺血的新生儿及低体温新生儿等[2,3]。本研究结果也提示,早产儿血糖水平与胎龄、出生体重呈正相关。然而,近年来研究发现,早产儿低血糖不仅与上述因素密切相关,其内分泌系统的相关激素和生长因子亦是重要的影响因素[1,4~9]。本组研究结果也提示,早产儿的血糖水平,与早产儿的胰高血糖素有密切相关。目前由于胰岛α细胞不成熟,分泌胰高血糖素明显低于足月儿,在国内文献甚少。
胰岛β细胞分泌胰岛素,由于C肽是胰岛素原α链和β链之间的连接肽,胰岛素和C肽共同释放入血中,其数量与胰岛素的分泌量相平等,在体内代谢过程中,由于C肽几乎不被肝脏摄取,所以外周血中C肽水平比胰岛素更稳定。因此C肽水平可用于评价胰岛β细胞分泌功能[4]。本研究结果显示,出生时和出生后第7天静脉血的胰岛素、C肽水平与足月儿无显著性差异,其水平与胎龄和体重无明显相关性,提示早产儿胰岛β细胞分泌胰岛素功能基本成熟,与邹永蓉、李杨方等研究结果一致,提示血清胰岛素水平可能不是导致早产儿低血糖的主要原因[10~12]。
胰高血糖素系胰岛α细胞分泌的另一种激素[10,11]。胰高血糖素的作用与胰岛素的作用相反,胰高血糖素是一种促进分解代谢的激素。胰高血糖素具有很强的促进糖原分解和糖原异生作用,使血糖明显上升。胰高血糖素通过cAMP-PK系统激活肝细胞的磷酸化酶,加速糖原分解;糖异生增强是因为激素加速氨基酸进入肝细胞,并激活糖异生过程有关的酶系。胰高血糖素还可激活脂肪酶,促进脂肪分解,同时又能加强脂肪酸氧化,使酮体生成增多。胰岛素与胰高血糖素是一对作用相反的激素,它们都与血糖水平构成负反馈调节环路。影响胰高血糖素分泌的因素很多,血糖浓度是重要的因素。当机体血糖降低时,机体即分泌胰高血糖素,血清胰高血糖素增高;血糖升高时,则胰高血糖素分泌减少,血清胰高血糖素下降。本研究通过检测血清胰高血糖素水平了解其对早产儿糖代谢的影响。结果显示,早产儿低血糖组血清胰高血糖素水平最低;早产儿组血清胰高血糖素明显低于足月儿组;低血糖均在生后24h内开始发生,与24h内低胰高血糖素水平相一致。本组低血糖患儿给予相应处理后绝大多数血糖水平在3天内稳定,1例5天内稳定。结果表明,早产儿胰岛α细胞分泌胰高血糖素功能尚不完善,7天后才趋完善。早产儿日龄与糖代谢紊乱有关,日龄越小,发生低血糖的可能性越大,说明胰高血糖素水平及血糖调节能力可随日龄的增加而日渐成熟。
从本项研究我们发现,早产儿易发生低血糖除与胎龄、出生体重相关外,可能与Gc激素水平有关。早产儿胰高血糖素分泌不足与早产儿低血糖发生有关,而胰岛素、C肽对早产儿血糖水平影响不大;表明34周前(本组病例均为34周前出生)早产儿胰岛α细胞在出生时尚不成熟,所分泌的胰高血糖素明显低于足月儿;表明胰岛β细胞相对较成熟,成熟时间要比胰岛α细胞成熟早。多项临床研究表明,胰高血糖素可用于治疗严重或难治性低血糖,而采用静脉持续输入“生理剂量”胰高血糖素治疗持续性、反复性新生儿低血糖,可以取得满意效果[12]。日常工作中,早产儿低血糖多无临床症状,若不重视血糖的监测,常不能知晓低血糖的存在,不能及时纠正低血糖,从而加重脑损伤。因此,早期检测胰高血糖素水平,不仅可以判断低血糖的原因,更可以采用输注血糖联合胰高血糖素来控制低血糖,从而减轻早产儿脑损伤,提高早产儿的生存质量有重要的临床意义。
1 何向桦.早产儿血糖紊乱的特点及皮质醇水平变化的研究[J].中国医药导报,2007,4(6):33-34
2 Rozance PJ,HayWW.Hypoglycemia in newborn infants:features associated with adverse outcomes[J].Biol Neonate,2006,90(2):74-86
3 Jain A,Aggarwal R,Jeeva Sankar M,et al.Hypoglycemia in the newborn[J].Indian JPediatr,2010,77(10):1137-1142
4 王秩.C肽研究进展[J].国外医学:内分泌学分册,1996,16(4): 169-171
5 Stanley KP,Fraser RB,Milner M,et al.Cord insulin and C-peptide-distribution in an unselected population[J].Br JObstet Gynaecol,1992,99(6):512-515
6 Lubchence LO,Bard H.Incidence of hypoglycemia in newborn infants classified by birth weight and gestational age[J].Pediatrics,197l,47 (5):831-838
7 Mir A,Raza S.Congenital ACTH Deficiency as a Cause of Hypoglycemia in a Newborn Infant[J].Clin Pediatr,2010
8 吴圣楣,贲晓明,蔡威,等.新生儿营养学[M].2版.北京:人民卫生出版社,2003:112-118
9 邹永蓉,龚放,李乔红,等.早产儿低血糖与胰岛素、C肽、瘦素及皮质醇的关系研究[J].临床儿科杂志,2009,27(10):959-962
10 Urakami T,Nagano N,Suzuki J,et al.Influence of plasma glucagon levels on glycemic control in children with type1 diabetes[J].Pediatr Int,2011,53(1):46-49
11 Coan PM,Conroy N,Burton GJ,et al.Origin and characteristics of glycogen cells in the developingmurine placenta[J].Dev Dyn,2006,235(12):3280-3294
12 Pearson T.Glucagon as a treatment of severe hypoglycemia:safe and efficacious but underutilized[J].Diabetes Educ,2008,34(1):128-134

