结直肠癌CD133+细胞定量评估的意义
缪 刚 李 尧 赵艳阳 黄美雄 韦军民
越来越多的证据表明肿瘤中存在肿瘤干细胞(cancer stem cells),并且其与肿瘤的增殖、转移、复发和对化疗不敏感关系密切。CD133被确认为最好的独立结直肠癌干细胞标志物,并且可以通过对结直肠癌CD133+细胞表达来预测患者的生存期[1]。这说明CD133不但可以在筛选肿瘤干细胞以及靶向性或选择性杀伤肿瘤干细胞中发挥重要作用,还可以成为结直肠癌患者的一个重要预后指标。本研究取材于手术中切除的新鲜结直肠癌组织标本,提取具有活性的原代结直肠癌单细胞进行流式细胞分析。在准确定量评估后发现CD133+结直肠癌干细胞的表达与肿瘤增殖能力和肿瘤转移相关蛋白的表达相关。这为临床结直肠癌干细胞的准确定量检验提供了方法和依据。
材料与方法
1.肿瘤组织取材:结直肠癌组织直接来源于手术切取标本(术前经纤维结肠镜活检病理确认)。标本离体后迅速切开肠道,用0.9%生理盐水冲洗后切取肿瘤边缘约1cm×2cm大小非坏死组织。癌组织经5次清洗液(青霉素1mg/ml、卡那霉素0.5mg/ml、两性霉素2.5μg/ml的生理盐水)清洗后,存放入4℃保存液(5%FBS的DMEM,抗生素剂量同清洗液)备用。相关操作程序经北京医院伦理委员会审核通过。
2.原代结直肠癌细胞提取:肿瘤组织进入实验室无菌操作台。经细胞清洗液(Hanks液,抗生素剂量同前)清洗3次后将组织剪碎,然后用刀片将组织切至稠液状。将组织用9ml清洗液清洗收集入50m l离心管,加入1%collagenase 1ml (type I,Invitrogen corporation)后放入37℃培养箱震荡消化60min。消化后组织液经清洗离心,然后用60目筛网滤过后再次收集离心。离心后组织与10m l培养液(10%FBS的DMEM/F12,抗生素同前)混匀后放入25cm2细胞培养Flask (collagen coated)过夜培养。第2天将上清悬浮细胞液吸除,保留贴壁活性细胞。用EGTA/Trypsin液将贴壁细胞游离收集后过120目筛网。细胞经计数后备用。
3.流式细胞计数:应用直接免疫荧光法检测细胞表面抗原。所用单克隆干、祖细胞单抗为CD133-PE。管中加入细胞1×106个/毫升,加入20μl CD133-PE荧光抗体。避光孵育20min后,加PBS混悬。采用FACScalibur(BD公司,美国)流式细胞仪,应用CELL-Quest软件,每管获取并分析105个细胞。
4.Western blotting:新鲜组织放入液态氮,研磨6~8次,直至细胞与生物重组基膜混合物粉碎融合。细胞裂解液包含Tris液(pH值7.4)、氯化钠液、1%的蛋白酶抑制剂和磷酸酶抑制剂(roche applied science,德国)的NP-40的缓冲液。全细胞裂解液蛋白浓度测定使用BCA试剂盒(Pierce)。蛋白质通过SDS-PAGE电泳转移到聚偏氟乙烯膜(Millipore)。使用以下抗体:caspase-3、e-cadherin和 GAPDH(Sigma-Aldrich,美国)。蛋白斑点随后与山葵过氧化物酶标记的羊抗兔IgG(KPL,美国)或抗兔抗山羊抗体(Santa Cruz)培养。蛋白质的ECL检测试剂盒的(Pierces)。
5.免疫组化:将10%甲醛固定包埋的结直肠癌标本行4μm厚度连续切片,免疫组织化学方法采用非生物素二步法,常规免疫组织化学染色程序染色;其基本流程为:烤片-脱蜡和水化-抗原修复-免疫组织化学染色-复染、分化-封片-镜检、拍照。实验结果评估标准:用PBS代替一抗作阴性对照。由两位病理医师分别双盲阅片。结直肠癌组织中P53和Ki-67阳性细胞数目判断方法如下:每张玻片均选择10个高倍视野;结果取10个视野的平均数。P53按照0~3评分,Ki-67按占总细胞百分比量化比较。
6.实验设计:按照流式细胞定量评估结果,将CD133+肿瘤干细胞<3%的病例分于A组,CD133+肿瘤干细胞≥3%的病例分于B组。实验检测结果分别在A、B两组之间比较。
7.统计学方法:运用不成对t检验,P≤0.05为差异有统计学意义。
结果
1.建立了具有可行性的原代结直肠癌单细胞提取体系:原代结直肠癌单细胞的提取需经过取材(图 1A)、消化过夜培养来确定贴壁的活性细胞(图1B)、特异性染色(图1C)和EGTA/Trypsin处理计数(图1D)等几个步骤。方法保证了所提取的肿瘤细胞接近100%,并且具有活性。虽然取材后的新鲜癌组织可在4℃保存液中保存1~3天,当天取材后立即提取可得到最佳结果。一般手术取材多在中午或下午进行,然后经过2h左右操作可培养过夜。第二天操作时间约45min可得到备用细胞。提取过程一人操作,简明可行。
2.准确定量评估癌组织中CD133+肿瘤干细胞:因为CD133是造血干细胞表面标志蛋白,研究首先将外周血单个核细胞作为参照对象和流式细胞仪单色设定参考(图2A和B)。病例根据CD133检测结果被分为A组(CD133+细胞<3%)和B组(CD133+细胞≥3%)。A组CD133+细胞平均为1.7%,B组CD133+细胞平均为7.7%;A组平均肿瘤大小为27cm3,B组为32cm3;A组肠系膜淋巴转移平均为0.7个,B组为2.4个;A组肿瘤中P53平均表达为1.8分,B组为1.6分(表1)。
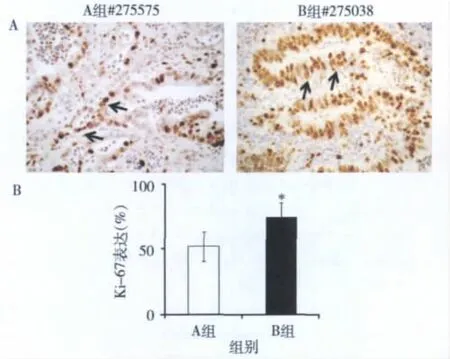
图3 用免疫染色方法比较了两组病例K i-67的表达
3.CD133的表达与肿瘤增殖和转移相关:Ki-67是一种增殖抗原,主要定位于细胞核,与细胞周期密切相连,在有丝分裂中起着维持DNA有规则结构的重要作用。肿瘤的增殖速度与预后密切相关。本研究中B组的Ki-67平均表达为74%,比A组的平均表达52%显著增高(图3),说明CD133+细胞增多的癌组织中肿瘤活性也增加了。e-cadherin在多数上皮细胞中有表达。作为一种与抑制肿瘤侵犯和转移相关的蛋白,e-cadherin在多数癌组织中表达下降。本研究中A组e-cadherin表达较B组增高,细胞凋亡相关蛋白caspase-3的表达在A组中增高(图4),这些说明CD133+细胞增多的癌组织中抑制癌转移的蛋白表达下降,细胞凋亡相关蛋白也下降了。本研究还检测了正常结直肠黏膜中CD133+细胞的比例。原代正常黏膜上皮细胞CD133+细胞为0.82% ± 0.64%(n=8),比癌细胞低(3.06%±2.65%,n= 22,P<0.05)。
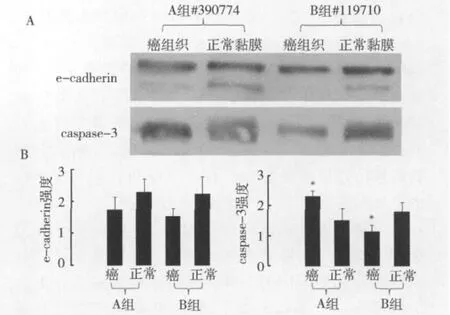
图4 用W estern blotting方法比较了两组e-cadherin和caspase-3在癌组织和正常黏膜的表达
讨论
CD133作为肿瘤中干细胞最重要的标志物已经多次被证实是结直肠癌的一个预后指标,CD133表达率越高预示着患者的预后越差[1~5]。作为一种准确而重要的评估方法,本研究首次提出直接从肿瘤中提取新鲜组织分离细胞,然后用流式细胞计数检测得到CD133+细胞在肿瘤中的精确比例。这种方法与常规CD133免疫组化得到的结论会有很大的差别[2,3,6]。免疫组化染色的优点是可以明确CD133+细胞在肿瘤中的定位。有报道显示CD133+肿瘤细胞并没有均匀分散在癌巢中,而是形成所谓的“热点”,即CD133+肿瘤细胞通常聚集在一个癌巢或相邻的几个癌巢[4]。而同一张切片另外一些癌巢CD133+肿瘤细胞只有少数几个或是根本没有。因此,CD133+肿瘤细胞所占的比例很难通过若干张切片而准确得出。本研究的方法是直接从肿瘤组织中提取原代新鲜细胞,这样即可以保证所检测的细胞100%为肿瘤细胞,又可以避免因为CD133+肿瘤细胞分布差异而造成的评估误差。
值得注意的是,CD133+肿瘤细胞≥3%的B组在肿瘤大小和淋巴结转移个数上都比CD133+肿瘤细胞<3%的A组高。虽然研究的病例有限(23例),但是表明了CD133+肿瘤细胞与不良预后相关的趋势。尤其是在 Ki-67肿瘤增殖标志物的比较中显示CD133+细胞≥3%的结直肠癌增殖显著性增高(图3)。研究显示在胃腺癌中,CD133+细胞的表达与Ki-67的表达正相关,并且预示着胃癌的最差预后[7]。CD133的表达还与肿瘤的大小和侵犯深度有关,这些都与本研究结果相符。CD133的表达与较短的生存期相关,这提示了CD133+肿瘤细胞相关数据对患者的预后意义重大[3]。基于癌干细胞假设,癌干细胞在常规治疗后可能会通过自身更新和分化导致肿瘤的复发和转移[8,9]。
虽然结直肠癌组织中CD133+细胞是否全部为肿瘤干细胞仍需要更深入的研究[10],但是有证据显示结肠癌组织CD133+细胞移植于裸鼠后具有更高的成瘤率[11]。Todaro等[12]将新鲜分离出的结直肠癌细胞注入裸鼠的皮下,发现其均可形成皮下肿瘤。然而通过免疫磁珠的方法将相同细胞中的CD133+细胞彻底去除后,则发现肿瘤的形成明显减少。将少量的纯化结直肠癌CD133+细胞注入裸鼠中即可形成皮下肿瘤。这些研究表明CD133+细胞是结直肠癌组织中具有肿瘤干细胞特性的亚群,对结直肠癌的形成、生长和转移起决定性作用。因此,检测CD133+细胞的量化比例是目前评估结直肠癌干细胞的有效方法之一。
本研究还揭示了结直肠癌中CD133的表达与抑制肿瘤侵犯相关蛋白e-cadherin的关系。在本研究CD133表达量高的结直肠癌中e-cadherin表达有下降的趋势,说明CD133在结直肠癌中的表达可能与肿瘤的侵犯和转移相关。另外,本研究显示CD133表达量高的结直肠癌中caspase-3的表达下降,说明了肿瘤细胞凋亡的减少,这与之前Ki-67增殖相关蛋白在结直肠癌中的表达规律相符。总之,CD133+结直肠癌干细胞的存在比例很可能预示着肿瘤的活性与侵犯和转移能力,这进一步说明了准确定量评估CD133+结直肠癌干细胞的重要性。
综上所述,本研究成功建立了一套具有可行性的原代结直肠癌干细胞准确定量评估系统。结直肠癌干细胞的准确定量检测可以作为评估患者预后和化疗敏感度的一项重要指标。本技术也为肿瘤细胞化疗药物敏感试验,进一步提纯结直肠癌干细胞,和最终研究对癌干细胞靶点的攻击提供了平台。
1 Horst D,Kriegl L,Engel J,etal.Prognostic significance of the cancer stem cellmarkers CD133,CD44,and CD166 in colorectal cancer[J].Cancer Invest,2009,27(8):844-850
2 尚立娜,杨爱军,王晨昱,等.结直肠癌中CD133的表达与血管成相关性的研究[J].肿瘤,2010,30(6):524-528
3 何向辉,罗宇东,卢兰涛,等.结直肠癌组织CD133的表达及其意义[J].临床肿瘤学杂志,2010,15(2):120-123
4 Horst D,Kriegl L,Engel J,etal.CD133 expression is an independent prognosticmarker for low survival in colorectal cancer[J].British Journal of Cancer,2008,99:1285-1289
5 李宝秀,张晓实,刘国龙.CD133在局部晚期结直肠癌肿瘤细胞中的异常表达及意义[J].广东医学,2010,31(13):1678-1681
6 Takahashi S,Kamiyama T,Tomaru U,et al.Frequency and pattern of the stem cellmarker CD133 have strong prognostic effecton the surgical outcome of colorectal cancer patients[J].Oncol Rep,2010,24 (5):1201-1212
7 Zhao P,Li Y,Lu Y,et al.Aberrant expression of CD133 protein correlateswith Ki-67 expression and is a prognosticmarker in gastric adenocarcinoma[J].BMC Cancer,2010,10:218-224
8 Ieta K,Tanaka F,HaraguchiN,etal.Biological and genetic characteristics of tumor-initiating cells in colon cancer[J].Ann Surg Oncol,2008,15:638-648
9 Verneulen L,Todaro M,de Sousa Mello F,et al.Single-cell cloning of colon cancer stem cells reveals amulti-lineage differentiation capacity[J].Proc Natl Acad Sci USA,2008,105:13427-13432
10 Labarge MA,BissellMJ.Is CD133 amarker ofmetastatic colon cancer stem cells?[J].JClin Invest,2008,118(6):2021-2024
11 O'Brien CA,PollettA,Gallinger S,etal.A human colon cancer cell capable of initiating tumor growth in immunodeficientmice[J].Nature,2007,445(4):106-110
12 Todaro M,Alea MP,Di Stefano AB,et al.Colon cancer stem cells dictate tumor growth and resist cell death by production of interleukin-4[J].Cell Stem Cell,2007,1(4):389-402

