CD47在急性髓细胞白血病干细胞中的表达及其临床意义探讨
李婉红 陈葆国 郑 瑞 李伯利
研究表明,白血病干细胞(leukemia stem cells,LSCs)是白血病发生、发展的起始细胞,少量的LSCs具有无限增殖和自我更新能力,能逃逸化学药物治疗作用,从而导致白血病复发[1~3]。近年来,随着对LSCs细胞生物学特性的深入研究,CD123、CD96、CD44等一些在急性髓细胞白血病(AML)LSCs过表达的分子陆续被发现,为临床上靶向治疗白血病提供了重要依据。新近,又有文献报道,AML LSCs高表达CD47,提示其是潜在的单克隆抗体治疗靶点,而目前国内罕见相关报道[1,3~5]。为系统地了解CD47在AML中的生物学特性,我们应用多参数流式细胞术分析其在AML LSCs中的表达规律,结合临床探讨其意义。
对象与方法
1.对象:(1)AML患者:自2009年3月~2011年10月笔者医院确诊的147例(除外急性早幼粒细胞白血病)AML患者,患者年龄12~78岁,中位年龄43岁,其中男性80例,女性67例。按FAB标准分别为:M0 8例、M1 21例、M2 43例、M4 30例、M5 35例、M6 10例。初诊骨髓原始细胞32% ~99%。化疗方案:DA、HA等。所有患者均签署知情同意书。(2)健康对照者:19名健康对照者包括9名骨髓移植供者,10名体检者,其中男性13名,女性6名,年龄22~47岁,中位年龄32岁。
2.方法:(1)仪器与试剂:流式细胞仪FACSCaliburTM为美国BD公司产品。小鼠 IgG1-(PE、FITC、Percp或APC)、CD34-APC、CD38-Percp、CD123-PE、CD90-FITC、CD33-FITC、P170-FITC、CD117-FITC、CD13-FITC、CD15-FITC、 CD11b-FITC、CD64-FITC、CD14-FITC、CD20-FITC、CD22-FITC、CD3-FITC、CD7-FITC、CD5-FITC、CD2-FITC购自美国BD公司。CD47-FITC购自美国eBioscience公司。(2)标本采集:化疗前采骨髓2~5m l肝素钠抗凝,常规分离单个核细胞(MNC),用磷酸盐缓冲液制成细胞浓度为1×107/ m l的单细胞悬液备用。(3)单克隆抗体标记及流式分析:正常对照和病例样本用CD34-APC/CD38-Percp散点图设CD34+CD38-细胞门,然后再分析 CD47、CD123、CD117、CD90、P170、CD33、CD13、CD11b、CD15、CD64、CD14、CD20、CD22、CD7、CD3、CD5、CD2等抗原表达。用流式细胞仪和Cell Quest软件获取并分析30000~400000个骨髓单个核细胞。结果:CD47用平均荧光强度(MFI)和百分率表示,以≥20.00%为阳性。P170用百分率表示,以≥10.00%为阳性。其余抗原用百分率表示,以≥20.00%为阳性。(4)随访:对131例AML患者进行跟踪随访,统计复发、死亡病例,记录生存时间。
3.统计学方法:应用SPSS 13.0软件包进行分析。计数资料用χ2检验分析,计量资料呈偏态分布,用[中位数M(P2.5~P97.5)]表示,进行秩和检验。用直线相关进行相关性分析。AML患者总生存率比较采用Kaplan-Meier生存分析和Logrank检验,以P<0.05为差异有统计学意义。
结果
1.CD47在健康对照者骨髓造血干细胞中的表达:19名健康对照者骨髓原始细胞 Lin-CD34+CD38-(HSC)亚群中CD47的表达百分率为15.42% (6.63% ~20.23%),其中 CD47阳性仅 4例(21.05%),结果显示HSC CD47表达阳性率很低。
2.CD47在AML患者原始细胞中的表达:147例 AML患者骨髓原始细胞Lin-CD34+CD38-(LSCs)亚群中CD47阳性112例,占76.19%,与健康对照组HSC细胞比较差异有统计学意义(χ2=24.30,P<0.01)。根据 FAB分型,8例 M0中 7例阳性(87.50%),21例M1中16例阳性(76.19%),43例M2中33例阳性(76.74%),30例M4中21例阳性(70.00%),35例M5中27例阳性(77.14%),10例M6中9例阳性(90.00%)。CD47在AML各亚型LSCs的阳性率差异无统计学意义(χ2=2.08,P>0.05)(表1)。CD47在LSCs表达百分率和MFI均高于CD34+CD38+亚群(U值分别为4.90、3.03,P均﹤0.01),也远高于正常造血干细胞中的表达水平(U值分别为4.76、6.24,P均﹤0.01)(表2、图1)。表明CD47在LSCs的表达量明显增多。

表1 CD47在AM L亚型LSCs中的表达情况
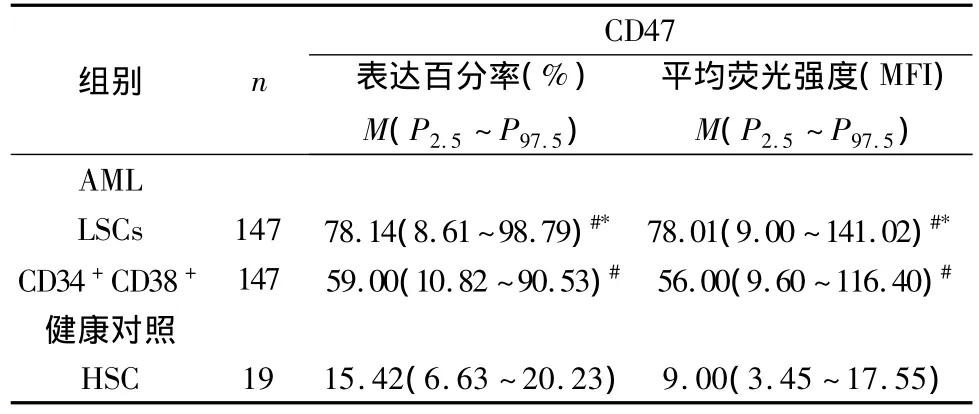
表2 CD47在健康对照和AM L患者中不同细胞亚群上的表达情况
3.CD47和P170在AML LSCs中表达的相关性:147例AML患者骨髓LSCs CD47的表达率与多药耐药蛋白P170的表达率呈显著正相关(r=0.83,P<0.01)。
4.CD47在AML LSCs中的表达与临床特征的关系:CD47与AML患者性别、年龄、原始细胞数量无关(P均 >0.05)。AML患者有肝、脾、淋巴结大者CD47阳性率高于无肝、脾、淋巴结大者,差异有统计学意义(χ2=15.77,P<0.01)。外周血白细胞≥20.0 ×109/L AML患者 CD47的阳性率 <20.0×109/L AML患者,差异有统计学意义(χ2=5.07,P<0.05) (表3)。提示,CD47过表达的AML患者易髓外浸润。
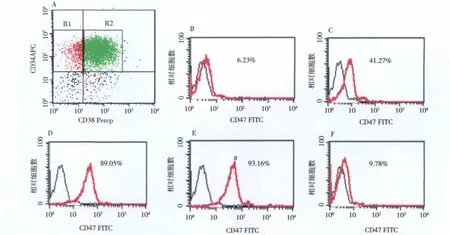
图1 CD47在AM L LSCs中的表达
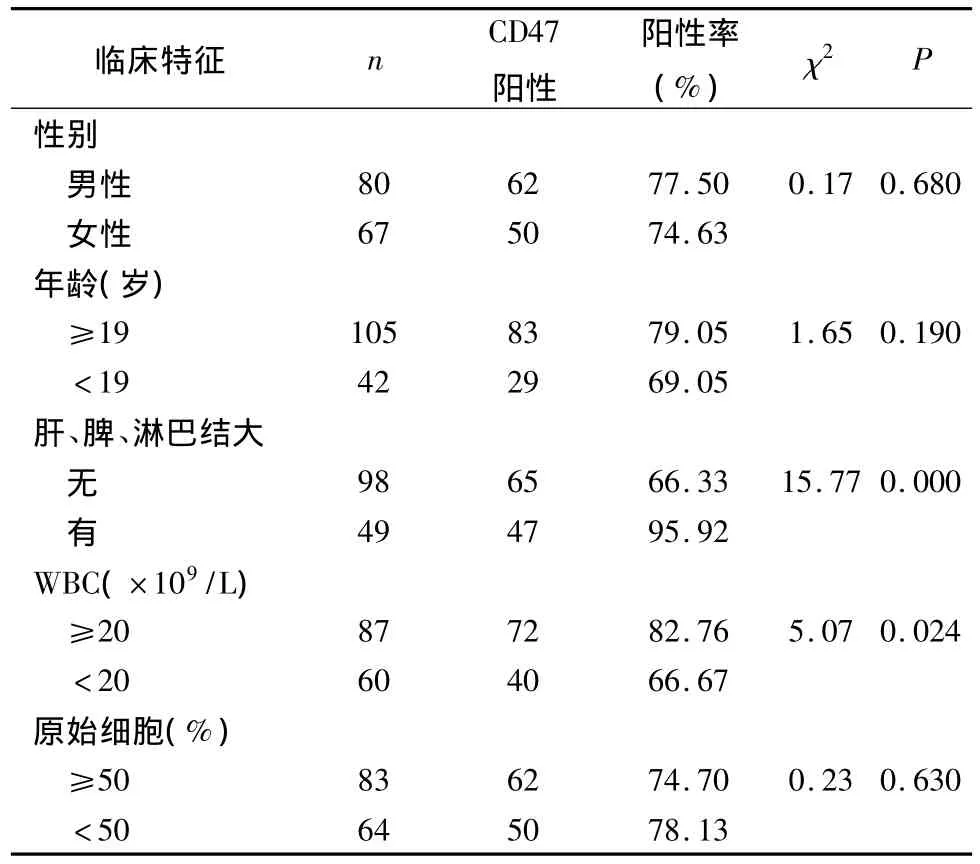
表3 CD47在AM L LSCs中的表达与临床特征的关系
5.CD47在AML LSCs中的表达与预后的关系: 147例AML患者中,除外16例因放弃治疗或转外院治疗失访,共计131例入组进行为期1~31个月的随访。根据CD47在AML LSCs中表达的阳性和阴性分为两组:CD47阳性的AML患者99例,CD47阴性的AML患者32例。99例CD47阳性的AML患者中有46例复发占46.46%,32例CD47阴性的AML患者中有8例复发占25.00%,两者比较差异有统计学意义(χ2=4.60,P<0.05)。随访31个月后,99例CD47阳性的AML患者中共43例死亡,占43.43%,32例 CD47阴性的 AML患者中共 6例死亡,占18.75%,两者比较差异有统计学意义(χ2=6.29,P<0.05);生存分析显示,CD47阳性的AML患者平均生存时间18.99±1.15个月,低于CD47阴性的AML患者平均生时间24.90±1.87个月差异有统计学意义(P<0.05)。表明CD47过表达的AML预后差,生存时间短。
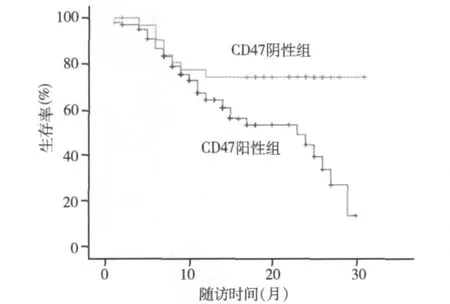
图2 AM L患者LSCs CD47表达的生存分析
讨论
CD47又称整联蛋白相关蛋白,是一种广泛表达的细胞膜表面的免疫球蛋白样蛋白质,是由特定的整联蛋白、G蛋白及胆固醇组成的超分子复合物[6]。与其配体信号调节蛋白(SIRPa)结合可产生抑制性信号,下调巨噬细胞的吞噬活性,进而对免疫系统产生抑制作用[7,8]。正常造血干细胞表面CD47的少量表达有助于维护机体内免疫系统的相对稳定,而AML患者的LSCs表面由于CD47的过量表达能够抵御自身被巨噬细胞吞噬,从而极大地降低了机体固有免疫系统对LSCs的清除[9]。
Jaiswal等[5]报道,AML及CML急变期LSCs的CD47表达水平较正常的HSC明显增加,而其他的骨髓增殖性疾病的骨髓干/祖细胞的CD47表达都未见增加。我们的结果显示,147例AML患者LSCs亚群中CD47阳性112例,占76.19%,明显高于健康对照组HSC CD47的阳性率。进一步分析AML患者原始细胞,发现CD47在LSCs的表达量显著高于CD34+CD38+亚群,与文献报道相符。本组AML患者LSCs CD47的阳性率与FAB分型亚型无关,与耐药蛋白P170则显著相关。Majeti等[10]研究也显示LSCs表面的CD 47表达水平通常与AML患者的FAB或M ICM分型无关,有t(8;21)(q22;q22)等临床预后较好的核型异常的患者CD47低表达,而有FLT3-ITD突变及1/3正常核型的AML患者中CD47却高表达。上述结果提示CD47的高表达可能与耐药、预后相关。此外,通过临床特征分析,我们还发现,CD47与AML患者性别、年龄、原始细胞数量无关,与肝、脾、淋巴结大及外周血高白细胞有关。提示,LSCs CD47过表达的AML患者易髓外浸润。
Majeti等[10]报道,成人AML患者经8年随访后发现,LSCs表面高表达CD47的患者无事件中位生存时间是6.8个月,总中位生存时间9.1个月,CD47低表达的患者无事件中位生存时间是17.1个月,总中位生存时间22.1个月,显示CD47低表达患者的生存时间比高表达的患者明显延长。本研究组131例AML患者随访31个月,结果显示,99例 LSCs CD47阳性的AML患者复发率(46.46%)和病死率(43.43%)高于 32例 CD47阴性患者的复发率(25.00%)和病死率(18.75%)。总生存时间分析显示,CD47阳性的 AML患者平均生存时间18.99± 1.15个月,低于CD47阴性的AML患者平均生时间24.90±1.87个月 差异有统计学意义(P<0.01)。进一步证实LSCs CD47阳性的AML患者易复发,生存时间缩短、预后差。
总之,AML患者LSCs表面CD47普遍过表达,造成临床上治疗反应差,易复发、耐药、生存时间短、预后差。然而,CD47在LSCs细胞中的高表达也为单克隆抗体靶向治疗AML提供了依据,目前相关体外研究及动物实验已取得重要进展。
1 Jordan CT,Upchurch D,Szilvassy SJ,et al.The interleukin-3 receptor alpha chain is a unique marker for human acute myelogenous leukemia stem cells[J].Leukemia,2000,14(10):1777-1784
2 Van Rhenen A,Moshaver B,Kelder A,et al.Aberrantmarker expression patterns on the CD34+CD38-stem cell compartment in acutemyeloid leukemia allows to distinguish themalignant from the normal stem cell compartment both at diagnosis and in remission[J].Leukemia,2007,21(8):1700-1707
3 Hosen N,Park CY,Tatsumi N,et al.CD96 is a leukemic stem cell specific marker in human acutemyeloid leukemia[J].Proc Nat Acad Sci USA,2007,104(26):11008-11013
4 J in L,Hope KJ,ZhaiQ,etal.Targeting of CD44 eradicates human acutemyeloid leukemic stem cells[J].Nat Med,2006,12(10): 1167-1174
5 Jaiswal S,Jam ieson CH,PangWW,et al.CD47 is up regulated on circulating hematopoietic stem cells and leukem ia cells to avoid phagocytosis[J].Cell,2009,138(2):271-285
6 Brown EJ,Frazier WA.Integrin associated protein(CD47)and its ligands[J].Trends Cell Biol,2001,11(3):130-135
7 Matozaki T,Murata Y,Okazaw a H,et al.Functions and molecular mechanisms of the CD472S IRPalpha signalling pathway[J].Trends Cell Biol,2009,19(2):72-80
8 Barclay AN,Brown MH.The SIRP family of receptors and immune regulation[J].Nat Rev Immunol,2006,6(6):457-464
9 Cumano A,Godin I.Ontogeny of the hematopoietic system[J].Annu Rev Immunol,2007,25:745-785
10 Majeti R,Chao M P,A lizadeh AA,et al.CD47 is an adversep rognostic factor and therapeutic antibody target on human acute myeloid leukemiastem cells[J].Cell,2009,138(2):286-299

