HCV不同标志物检测结果比较分析
李 华 龙润乡 杨 蓉 蒋蕊鞠 董承红 易红昆 白慧珠 谢忠平
丙型病毒性肝炎是由丙型肝炎病毒(hepatitis C virus,HCV)感染引起的重要的世界性传染病之一,在中国人群的感染率达3.2%,其中50%~85%感染者发展为慢性丙型肝炎,10%~30%发展为肝硬化,肝硬化患者中约3% ~10%可演变为肝细胞癌[1]。HCV初发感染往往比较隐匿,仅有约20%~30%的感染者呈急性肝炎表现,所以选择快速、灵敏、特异的检测方法检出HCV十分重要[2,3]。本研究应用HCV核心抗原试剂盒、HCV游离抗原试剂盒、丙型肝炎病毒(HCV)抗体检测试剂盒(ELISA)及HCV核酸扩增(PCR)荧光定量检测试剂盒,对1551份血清或血浆临床样品检测丙型肝炎病毒不同的标志物,现将结果报道如下。
材料与方法
1.材料:(1)血清或血浆标本来源:云南省第一人民医院、昆明医学院第一附属人民医院及云南省血液中心3个单位的血清或血浆样品。(2)丙型肝炎病毒核酸扩增(PCR)荧光定量检测试剂:深圳匹基生物工程有限公司生产,批号20080702。(3)丙型肝炎病毒核心抗原诊断试剂盒(酶联免疫法):国内某公司上市产品,批号20091101。(4)丙型肝炎病毒抗体检测试剂盒(ELISA):上海科华生物工程有限公司生产,批号200908011。(5)丙型肝炎病毒游离抗原检测试剂盒(ELISA):中国医学科学院医学生物学研究所生产。
2.方法:(1)丙型肝炎病毒核酸扩增(PCR)荧光定量检测:采用丙型肝炎病毒核酸扩增(PCR)荧光定量检测试剂,按试剂盒说明书进行荧光定量检测。(2)丙型肝炎病毒核心抗原检测:按试剂盒说明书进行ELISA检测HCV-Ag。(3)丙型肝炎病毒抗体检测:按试剂盒说明书进行 ELISA检测HCV-Ab。(4)丙型肝炎病毒游离抗原检测:包被HCV多表位复合抗原的多克隆抗体酶标板,先加入样品缓冲液50μl,待检样品50μl,37℃孵育2h,洗板5次后,加酶结合物100微升/孔,37℃孵育1h。洗板5次后,加TMB显色液,室温显色15min,于450nm波长检测OD值。
结果
1.HCV不同标志物检测结果分析:在1551份血清或血浆样品中,共检出HCV-Ab阳性样品565份、HCV-Ag阳性样品48份、HCV-RNA阳性样品317份、HCV-CAg阳性25样品。其中,HCV-Ab阳性样品(阳性率36.43%)检出率高于HCV-Ag阳性样品(阳性率3.09%,χ2=543.422,P=0.000)、HCVCAg阳性样品(阳性率1.61%,χ2=610.320,P= 0.000)及HCV-RNA阳性样品(阳性率20.445%,χ2=97.437,P=0.000),2种试剂检出率皆显示差异有统计学意义;HCV-Ag阳性样品检出率(3.09%)高于HCV-CAg阳性样品(1.61%),2种试剂检出率显示差异有统计学意义(χ2=7.421,P=0.006); HCV-RNA阳性样品(20.44%)检出率高于HCVAg阳性样品(3.09%),2种试剂盒检出率显示差异有统计学意义(χ2=224.687,P=0.000);HCV-RNA阳性样品(20.44%)检出率高于HCV-CAg阳性样品(1.61%),2种试剂检出率显示差异有统计学意义(χ2=280.203,P=0.000,表1)。
2.HCV-Ab指标相关性检测结果分析:在565份HCV-Ab阳性样品中,检出48份HCV-Ag(游离抗原)阳性样品,检出率为8.50%;检出23份HCV核心抗原(HCV-CAg)阳性样品,检出率为4.07%;检出317份HCV-RNA阳性样品,检出率为56.11%。在984份全阴性样品中,检出2份HCV核心抗原(HCVCAg)阳性样品,检出率为0.20%;但未检出HCV抗原及HCV-RNA(表2)。以上结果说明:HCV-RNA、HCV-Ag及HCV-CAg在HCV-Ab阳性样品中的检出率明显高于HCV-Ab阴性样品,具有明显的关联性。

表2 HCV抗原检测试剂盒临床研究不同性质样品结果分析
3.两种HCV抗原检测试剂检测结果分析:在317份HCV-Ab及HCV-RNA双阳性的样品中,HCV抗原检测试剂检出34份HCV游离抗原阳性样品(阳性率10.73%),HCV核心抗原检测试剂检出23份HCV核心抗原阳性样品(阳性率7.26%),HCV抗原检测试剂检出率高于HCV核心抗原检测试剂,但2种试剂检出率显示差异无统计学意义(χ2= 2.333,P=0.1267)。
在248份HCV-Ab阳性、但HCV-RNA阴性的样品中,HCV抗原检测试剂检出14份HCV游离抗原阳性样品(阳性率5.65%),HCV核心抗原检测试剂未检出阳性样品(阳性率0),2种试剂检出率有明显差异(χ2=14.407,P=0.0001)。
在984份HCV-Ab及HCV-RNA双阴性的样品中,HCV抗原检测试剂未检出阳性样品(阳性率0),HCV核心抗原检测试剂检出2份HCV核心抗原阳性样品(阳性率0.20%),2种试剂检出率无明显差异(校正χ2=0.501,P=0.479,表3)。
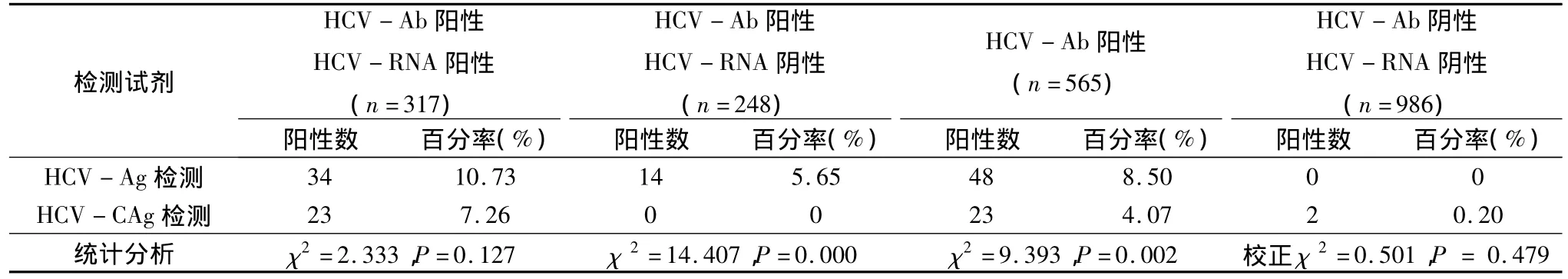
表3 2种HCV抗原检测试剂对不同样品检测结果分析
4.HCV-Ab与HCV-RNA检测结果关联性分析:将本次所有样品HCV-RNA(荧光定量PCR)与 HCV-Ab(ELISA)检测结果进行分析,若以HCVRNA结果为金标准,则与用于HCV-Ab(ELISA)检测结果一致性84.01%、灵敏度100.00%、特异度79.90%、阳性预测值 56.11%、阴性预测值100.00%。HCV-Ab(ELISA)检出率(36.43%)明显高于核酸检出率(20.44%)。二者之间差异经配对t检验有显著性(χ2=248.0,P=0.0000);对两种检测结果进行关联度分析,两种检测结果明显相关,其r =0.6696(χ2=691.9,P=0.0000)。若以HCV-Ab结果为金标准,则与HCV-RNA(荧光定量PCR)检测结果一致性、灵敏度、特异度、阳性预测值及阴性预测值分别为84.01%、56.11%、100.00%、100.00%及79.90%。此结果提示,由于检测原理及检测的病毒标志物不同,荧光定量PCR与ELISA法检测结果之间存在一定的差异,并不能完全吻合而取代,也许更重要的是相互补充(表4)。
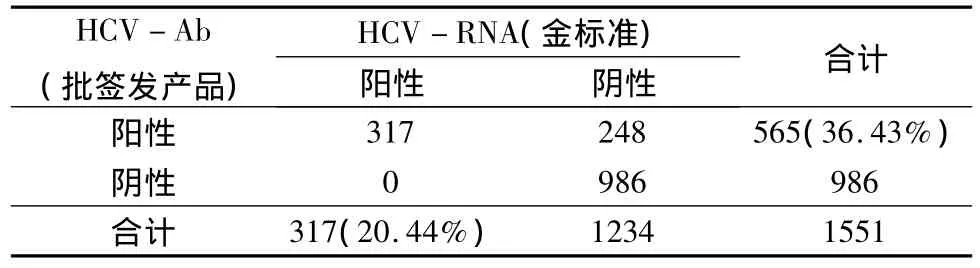
表4 HCV-Ab与HCV-RNA检测结果分析
讨论
HCV感染的实验室检查是丙型肝炎诊断的重要依据,所以检测方法的选择非常重要。HCV感染通常是持续性的终生感染,抗体检测是一个非常有效的方法,但由于存在“窗口期”及“静默感染”,此期检测不到相应的抗体,所以仍然有输血后丙肝的发生[4~6]。国外资料报道ELISA法检测HCV核心抗原比检测HCV抗体缩短窗口期平均58.2天,仅比RT-PCR检测HCV-RNA多0.24~3.33天,而抗体出现则比检测到HCV-RNA晚28~140天[7]。反转录多聚酶链反应(RT-PCR)是一个很敏感的方法。HCV -RNA可以在暴露后的1~2周被检出[8]。另外,在一些HCV感染后恢复期的人群中,抗HCV可能会逐渐降低到检测限之下,或免疫功能低下的HCV感染者,抗HCV会持续阴性,这时,HCV-RNA的检测是感染的唯一证据[9]。故使用RT-PCR技术检测HCV-RNA是判断感染最有效的方法。但其技术复杂、条件要求较高,不易在多数实验室推广。HCV抗原(HCV-Ag)包括核心抗原(HCV-CAg)、NS5、NS3及NS4等,是HCV感染者体内出现的早期感染标志,其消长趋势与HCV-RNA有明显的一致性,具有早期诊断的重要价值[7]。HCV-Ag或HCV-CAg的检测有助于评价HCV在细胞中的表达情况。ELISA法较PCR法简便、快速,其方法简单、影响因素少、重复性好。因此,在不具备RNA检测条件的实验室开展HCV-CAg检测或HCV-Ag检测是很好的筛查方法。
本研究在1551份血清或血浆样品中,共检出HCV-Ab阳性样品565份(阳性率为36.43%)、HCV-RNA阳性样品317份(阳性率为20.445%),2种试剂检出率显示差异有统计学意义(χ2=97.437,P =0.000)。HCV-RNA较HCV-Ab检出率低,原因是由于本实验采集的样品部分为特殊样品,且在HCV的3种标志物中,RNA不稳定,而核酸的稳定性较抗体差,导致在进行RT-PCR检测时,样品的检出率降低[10,11]。
在317份HCV-Ab和HCV-RNA双阳性样品及984份HCV-Ab和HCV-RNA双阴性样品,HCV-Ag及HCV-CAg 2种标志物检测结果检出率差异皆无统计学意义,由此说明HCV-Ag检测与HCVCAg检测结果有高度的相关性。但在565份HCVAb阳性样品中检出48份 HCV-Ag(检出率为8.50%),23份HCV-CAg(检出率为4.07%),2种试剂检出率有明显差异(χ2=9.393,P=0.0022);在248份HCV-Ab阳性、但HCV-RNA阴性的样品中,未检测出HCV-CAg阳性样品,而HCV抗原检测试剂检出14份,阳性率达5.65%,2种试剂检出率有明显差异(P=0.000)。可能是因为HCV-Ag检测试剂所使用的抗体为HCV多表位复合抗原的多克隆抗体,除C表位外,尚有NS3、NS5等多个表位,相对于HCV核心抗原的单克隆而言,捕获能力强、检测灵敏度提高。
综合比较分析,HCV的抗原、抗体及核酸标志物之间是相互关联的,任何单一标志物的检测均存在漏检风险,HCV-CAg试剂与HCV-Ag试剂可作为HCV-Ab检测的补充试剂,可联合应用于临床检测及血源筛选,但其灵敏度有待提高[12]。
1 付涌水.丙型肝炎病毒感染的流行病学[J].中国输血杂志,2009,22(11):873-875
2 杨朝国,陈川.丙型肝炎病毒感染的实验室检测及临床应用[J].国外医学·临床生物化学与检验学分册,2004,25(4):379-381
3 Krajden M,ShivjiR,Gunadasa K,et al.Evaluation of the core antigen assay as a second-line supplemental test for diagnosis of active hepatitis C virus infection[J].JClin Microbiol,2004,42(9):4054-4059
4 Legrer TJ,Riggert J,Simson G,et al.Testing of individual blood donations for HCV RNA reduces the residual risk of transfusion-transmitted HCV infection[J].Transfusion,2000,40(10):192-197
5 Widell A,Molnegren V,Pieksma F,et al.Detection of hepatitis Core antigen inserum or plasma as a marker of hepatitis C viraemia in the serological window-phase[J].Transfusion Med,2002,12(2):107-113
6 Icardi G,Ansaldi F,Bruzzone BM,et al.Novel approach to reduce the hepatitis C virus(HCV)window period clinical evaluation of a new enzyme-1inked immunosorbent assay for HCV core antigen[J].JClin Microbiol,2001,39(9):3110-3114
7 Laperche S,Le Marrec N,Simon N,et al.A new HCV core antigen assay based on disassociation of immune complexes:an alternative to molecular biology in the diagnosis of early HCV infection[J].Transfusin,2003,43(7):958-962
8 Busch MP,Kleinman SH,Jackson B,et al.Nucleic acid amplification testing of blood donors for transfusion-tranmitted infectious diseases[J].Transfusion,2000,40(2):143-159
9 Alter HJ,Seeff LB.Recovery,persistence,and sequelae in hepatitis C virus infection:a perspective on long-term outcome[J].Semin Liver Dis,2000,20(1):17-35
10 龙润乡,李华,崔萍芳,等.丙型肝炎病毒3种标志物的稳定性[J].中国生物制品学杂志,2009,22(5):468-469
11 刘长利,任芙蓉,吕秋霜,等.不同处理和保存条件下体外HCV RNA稳定性研究[J].中国实验血液学杂志,2006,14(6):1238-1243
12 刘杰平,张贺平.丙肝病毒核心抗原与丙肝病毒抗体检测的相关性[J].海南医学,2008,19(10):152-153

