非病毒基因递送载体的研究进展
胡 星(复旦大学药学院2008级本科生,上海201203)
基因治疗在癌症、艾滋病等严重危害人类生命健康的疾病的治疗中有良好的开发前景。基因治疗的常见方法是将外源正常基因导入生物细胞,以纠正或补偿因基因缺陷和异常引起的疾病,比一般的药物治疗有更加彻底的疗效。将外源基因药物导入生物细胞必须依赖于载体的协助,因此高效的基因载体成为目前基因治疗研究的热点。基因载体通常可以分为两类:病毒载体和非病毒载体,病毒载体给药效率高,但是存在的安全隐患限制了其临床应用[1]。近几年,有关非病毒基因递送载体的研究取得了多方面的进展,本文对此做一综述。
1 靶向递送基因载体
在递送系统表面连接对特定器官或细胞有特殊亲和力的靶向配体,可以增强递送系统中基因向病灶部位输送的靶向性,提高转染率。Huang等[2]设计了一种新型的脑靶向的非病毒基因递送载体系统。聚酰胺-胺型树枝状聚合物(polyamidoamine dendrimer,PAMAM)是一种树枝状的大分子,可以作为载体的基本骨架,并连接聚乙二醇(polyethylene glycol,PEG),以增强载药系统在体内的循环时间。Angiopep-2是含有19个氨基酸残基的小分子多肽,它具有靶向到在脑毛细血管内皮细胞(brain capillary endothelial cells,BCECs)和神经胶质细胞表面表达的低密度脂蛋白受体相关蛋白1(lipoprotein receptor-related protein-1,LRP1)的能力,因此Angiopep-2可以连接到PEG上作为载药系统的靶向配体,合成PAMAM-PEG-Angiopep基因载体,最后结合DNA,生成PAMAM-PEGAngiopep/DNA纳米粒。这种具有靶向功能的纳米粒在神经胶质细胞的细胞摄取实验中,显示出经过内涵体/溶酶体途径进入细胞核的机制。在体内生物分布实验中,PAMAM-PEG-Angiopep/DNA在脑内,特别是肿瘤部位的蓄积比PAMAM-PEG/DNA和PAMAM/DNA纳米粒要多,表明PAMAM-PEG-Angiopep有作为脑靶向非病毒基因载体的良好潜力。
2 多功能基因载体
最近,Namgung等[3]利用多功能的二氧化硅纳米管(silica nanotube,SNT)研发出一种既可以装载基因,又可以携载核磁共振造影剂的新型基因载体(见图1)。如图1所示,SNT是一种内部中空的纳米结构,其外部可以连接阳性的、低分子量的分支聚氮丙啶(branched polyethylenimine,BPEI),生成BPEI-SNT。BPEI-SNT可以携带质粒脱氧核糖核酸(pDNA)进入生物细胞,而SNT的内部则被填充了磁性-荧光纳米复合物,即氧化铁纳米粒和绿色荧光量子点。因为低波长的紫外光和可见光都可以穿透SNT的外壁,所以用紫外光照射摄取了BPEI-SNT/pDNA的细胞时,磁性-荧光填充物使得细胞可以进行核磁共振成像(magnetic resonance imaging,MRI);当用可见光照射细胞时,研究者可以通过荧光显微镜观测SNT内化入胞的过程。当然,这种在体外成功构建的、有双重功能的纳米管,有待进一步的体内研究证实其基因递载功能。
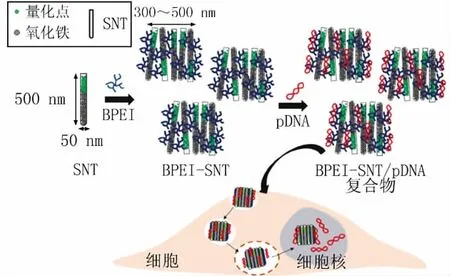
图1 制备BPEI-SNT/pDNA复合物的过程示意图Figure 1 Schematic illustration of preparation procedures of BPEI-SNT/pDNA complex SNT:二氧化硅纳米管;BPEI:分支聚氮丙啶;pDNA:质粒脱氧核糖核酸
3 同时载基因与化疗药物的载体
两种或多种药物的联合使用在癌症的治疗中常常是必要的。一般来说,成功的联合用药或基因治疗要求将两种药物作用于同一群肿瘤细胞。但是由于小分子药物和基因药物在体内的药动学性质不同,所以需要靶向递释多种药物或同时递释化疗药物与基因的载体。Bhattarai等[4]用PEG与2-(二甲基氨基)甲基丙烯酸乙酯聚合物或2-(二乙基氨基)甲基丙烯酸乙酯聚合物修饰有介孔的二氧化硅纳米粒(mesoporous silica nanoparticle,MSN),MSN装载有氯喹和pDNA或者siRNA。氯喹是一种向溶酶体药物,可以提高非病毒基因给药的转染效率。这种多聚阳离子修饰的MSN与没有装载氯喹的MSN相比,基因转染和基因沉默都可以在小鼠黑素瘤高转移细胞中观测到。氯喹单独给药时,为提高转染所要达到的必要浓度已经是中毒浓度,利用MSN同时递载氯喹和核酸物质显著提高了基因转染率和沉默能力。
4 智能基因递释载体
最近,Yamashita等[5]研发出一种对肿瘤特殊环境和外界刺激敏感、具有光热效应的金纳米棒(见图2),可以作为单链DNA的控释载体。金纳米棒在近红外区有很强的吸收带,并且被吸收的光能可以转换为热能,具有独特的光热效应。由于近红外光可以穿透人体组织,所以被双链DNA修饰的金纳米棒可以作为控释系统。当双链DNA修饰的金纳米棒被近红外光照射时,光热效应产生的热量将双链DNA降解为单链DNA释放,释放的单链DNA的数量取决于光照的时间和强度。在实验中,双链DNA修饰的金纳米棒被直接注射到小鼠结肠-26癌细胞内,并接受光的照射,可以检测到单链DNA释放。这种具有特殊光热效应的金纳米棒作为低聚核酸的控释载体将会有非常广阔的应用范围。

图2 制备双链DNA修饰的金纳米棒过程示意图Figure 2 Schematic illustration of preparation procedures of dsDNA-modified gold nanorod PEG:聚乙二醇;PEI:聚氮丙啶
5 脂质体
脂质体常被用作基因载体,以保护被包裹的基因不受核酸酶的降解,被脂质体完整包裹的核酸可以在体内达到长循环的效果。最近,Li等[6-9]研发了一种将压缩的核酸包裹在脂质细胞膜内的新型结构(见图3)。它的制备方法是首先将DNA和鱼精蛋白压缩到一个复合体内,然后用阳性脂质体包裹,自组装得到脂质体-聚阳离子-DNA(liposome-polycation-DNA,LPD)纳米粒。这种压缩复合物的核心是DNA和鱼精蛋白。与阳性脂质体-DNA复合物相比,LPD可以更好地保护质粒DNA不受酶降解,并在静脉给药的小鼠体内达到更高水平的基因表达。LPD也可以通过修饰的方式在体内或体外选择性递送siRNA至表达受体的肿瘤细胞。siRNA首先与一个载体DNA杂交,之后与鱼精蛋白混合,再用脂质细胞膜包裹,最后将连接了PEG的脂质插入到脂质细胞膜中,以提高复合物的稳定性。PEG的末端连接靶向于sigma-1受体的配体anisamide,以此达到靶向表达sigma受体的肿瘤细胞的目的。
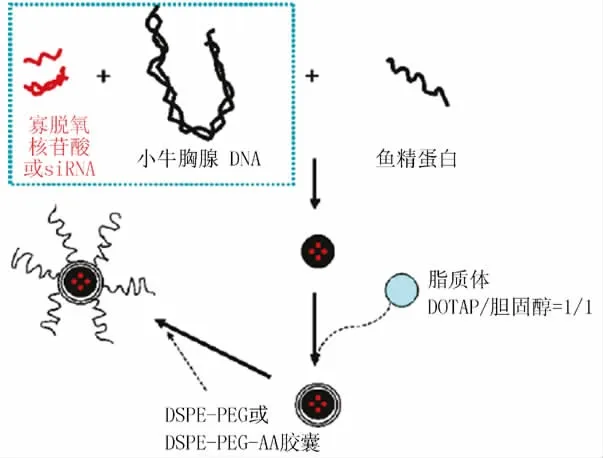
图3 制备PEG修饰的脂质体-聚阳离子-DNA纳米粒过程示意图igure 3 Schematic illustration of preparation procedures of PEGlated liposome-polycation-DNA nanoparticles PEG:聚乙二醇;DSPE:二硬脂酰基磷脂酰乙醇胺;DOTAP:N-[1-(2,3-二油酰丙氧基)-N,N,N-三甲基溴化铵];AA:氨基酸
6 结 语
虽然非病毒基因递送载体在治疗癌症、艾滋病、遗传病等多种疾病中有很好的前景,但目前在临床上的应用非常有限。存在的问题包括:寻找和筛选更高效、稳定的靶向配体,以提高纳米基因递释系统的靶向治疗效果[10],以及寻找控制基因释放的途径等[11]。本文介绍的几种新型非病毒基因载体为基因治疗提供了很好的研究思路和方法,其临床疗效需要相关体内、体外研究进一步确证。
[1] Braeckmans K,Buyens K,Naeye B,et al.Advanced fluorescence microscopy methods illuminate the transfection pathway of nucleic acid nanoparticles[J].J Control Release,2010,148(1):69-74.
[2] Huang S,Li J,Han L,et al.Dual targeting effect of Angiopep-2-modified,DNA-loaded nanoparticles for glioma[J].Biomaterials,2011,32(28):6832-6838.
[3] Namgung R,Zhang Y,Fang Q L,et al.Multifunctional silica nanotubes for dual-modality gene delivery and MR imaging[J].Biomaterials,2011,32(11):3042-3052.
[4] Bhattarai S R,Muthuswamy E,Wani A,et al.Enhanced gene and siRNA delivery by polycation-modified mesoporous silica nanoparticles loaded with chloroquine[J].Pharm Res,2010,27(12):2556-2568.
[5] Yamashita S,Fukushima H,Akiyama Y,et al.Controlledrelease system of single-stranded DNA triggered by the photothermal effect of gold nanorods and its in vivo application[J].Bioorg Med Chem,2011,19(7):2130-2135.
[6] Li S D,Chono S,Huang L.Efficient gene silencing in metastatic tumor by siRNA formulated in surface-modified nanoparticles[J].J Control Release,2008,126(1):77-84.
[7] Li S D,Chen Y C,Hackett M J,et al.Tumor-targeted delivery of siRNA by self-assembled nanoparticles[J].Mol Ther,2008,16(1):163-169.
[8] Chen Y,Bathula S R,Yang Q,et al.Targeted nanoparticles deliver siRNA to melanoma[J].J Invest Dermatol,2010,130(12):2790-2798.
[9] Li S D,Huang L.Nanoparticles evading the reticuloendothelial system:role of the supported bilayer[J].Biochim Biophys Acta,2009,1788(10):2259-2266.
[10] 黄容琴,柯伟伦,蒋 晨,等.脑靶向非病毒基因递释系统的研究进展[J].国际药学研究杂志,2010,37(1):36-39.
Huang RongQin,Ke WeiLun,Jiang Chen,et al.Progress on brain-targeting non-viral gene delivery systems[J].J Int Pharm Res,2010,37(1):36-39.In Chinese with English abstract.
[11] Hardin J O,Milam V T.Controlled release of active DNA from uncrosslinked matrices[J].Soft Matter,2011,7(8):2674-2681.

