高强度皮秒脉冲电场对人宫颈癌Hela细胞体外作用初探*
张 玉,熊正爱△,华媛媛,章锡明,姚陈果
(1.重庆医科大学附属第二医院妇产科 400010;2.重庆大学输配电装备及系统安全与新技术国家重点实验室 400030)
高强度皮秒脉冲电场对人宫颈癌Hela细胞体外作用初探*
张 玉1,熊正爱1△,华媛媛1,章锡明2,姚陈果2
(1.重庆医科大学附属第二医院妇产科 400010;2.重庆大学输配电装备及系统安全与新技术国家重点实验室 400030)
目的探讨高强度皮秒脉冲电场对人宫颈癌HeLa细胞的体外损伤效应及机制。方法 固定皮秒脉冲电场脉宽800 ps、频率3Hz、场强250kV/cm,根据处理脉冲个数不同(0、1 000、3 000和5 000个),将HeLa细胞分为对照组和不同剂量皮秒脉冲处理组,通过MTT比色法检测皮秒脉冲对各组细胞在处理后不同时间点生长抑制的影响;Fluo-3/AM探针标记细胞,激光扫描共聚焦显微镜检测细胞[Ca2+]i改变;Western blot法检测皮秒脉冲电场作用后Bax/Bcl-2蛋白表达量的改变。结果随着脉冲剂量的增加,细胞死亡率上升,生长受到抑制,12h时抑制率最为显著;皮秒脉冲处理可明显升高细胞[Ca2+]i(P0.05);随着脉冲剂量的增加,细胞内Bax蛋白表达量由对照组的0.205±0.102增加至各处理组的0.257±0.083、0.586±0.138和0.791±0.262(P0.05);Bcl-2蛋白表达量由对照组的0.694±0.132降低至各处理组的0.591±0.145、0.364±0.105和0.262±0.092(P0.05);Bax/Bcl-2比值显著上调(P0.05)。结论高强度皮秒脉冲电场对HeLa细胞有损伤效应,并能诱导其凋亡。
电磁场;脉冲疗法;细胞凋亡;肿瘤细胞,培养的
因皮秒脉冲具有超宽带脉冲频谱,可以通过匹配超宽带冲激脉冲辐射天线进行发射,并将脉冲电场聚焦于特定组织,从而为实现无创治疗提供了可能[7]。且前期研究结果表明,当电场脉冲脉宽由毫秒或微秒级降低至纳秒级时,其对细胞的作用靶点逐渐由细胞膜进入胞内结构[8-10]。如进一步将脉冲电场脉宽降低至皮秒级,其靶向作用于胞内结构的效应是否更加明显?是否可以直接作用于胞内细胞器(如线粒体、内质网等),进而诱导细胞发生凋亡?基于以上物理特性及假设,本实验对人宫颈癌HeLa细胞进行体外实验,初步探讨皮秒脉冲对肿瘤细胞的生物电学损伤效应及相关机制,为基于靶向诱导凋亡的无创治疗技术提供基础研究。
1 材料与方法
1.1 细胞与试剂 HeLa细胞由重庆医科大学超声工程研究所提供;RPMI1640培养基、新生小牛血清、PBS平衡液和胰蛋白酶购于 Hyclone公司;MTT、二甲亚砜(DMSO)、Fluo-3/AM、Bradford蛋白浓度测定试剂盒和细胞裂解液购于碧云天公司;Bax兔抗人多克隆抗体、Bcl-2兔抗人多克隆抗体和羊抗兔IgG抗血清购于北京博奥森生物技术有限公司。
表1 各组细胞在不同时间点细胞死亡率(±s,%)
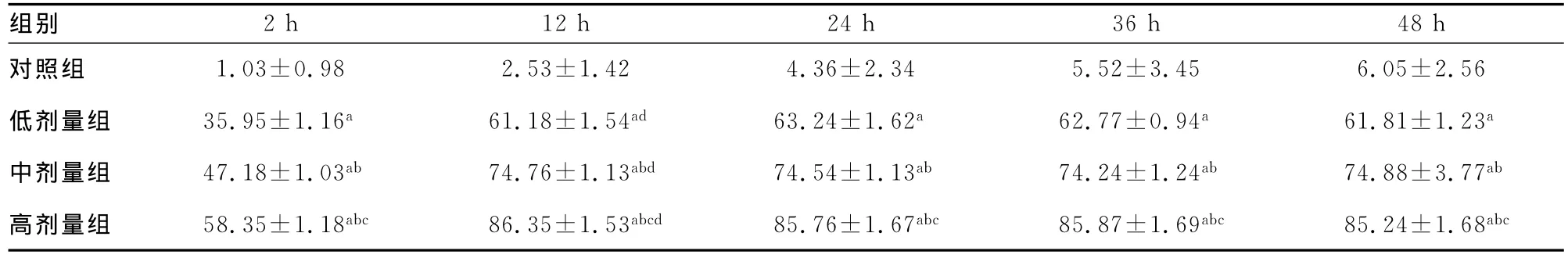
表1 各组细胞在不同时间点细胞死亡率(±s,%)
a:P 0.01,与同时间点对照组比较;b:P 0.01,与同时间点低剂量组比较;c:P 0.01,与同时间点中剂量组比较;d:P0.05,与同组2、24、36、48h时比较。
组别2h 12h 24h 36h 48h对照组 1.03±0.98 2.53±1.42 4.36±2.34 5.52±3.45 6.05±2.56低剂量组 35.95±1.16a 61.18±1.54ad 63.24±1.62a 62.77±0.94a 61.81±1.23a中剂量组 47.18±1.03ab 74.76±1.13abd 74.54±1.13ab 74.24±1.24ab 74.88±3.77ab高剂量组 58.35±1.18abc 86.35±1.53abcd 85.76±1.67abc 85.87±1.69abc 85.24±1.68abc
1.2 主要仪器 高强度皮秒脉冲发生器、电极小室由重庆大学输配电装备及系统安全与新技术国家重点实验室研制;酶标仪为美国BIO-RAD公司产品;激光扫描共聚焦显微镜为德国Leica TCS-SP2公司产品。
1.3 方法
1.3.1 细胞培养 复苏细胞,将细胞置于含10%新生小牛血清的RPMI1640培养基,37℃、5%CO2培养箱内培养,2~3d传代1次。
1.3.2 高强度皮秒脉冲电场处理 取对数生长期细胞,0.25%胰蛋白酶消化后离心,PBS液洗涤2~3次,校正细胞密度至2×106个/毫升备用。固定场强250kV/cm、重复频率3Hz、脉宽800ps,按照脉冲个数的不同(0、1 000、3 000和5 000个)分为对照组及低、中、高剂量组。每组取500μL细胞悬液置于电极小室,给予相应剂量电脉冲,对照组不予电处理。
1.3.3 MTT检测细胞死亡率 收集各组细胞,每组每孔吸取20μL细胞悬液接种于96孔板,调零组仅加入培养液而不加细胞悬液,每组设5个复孔,共接种5块培养板,于37℃、5%CO2培养箱内培养2、12、24、36、48h,平板离心机2 000r/min离心5min。每孔加入MTT溶液20μL,避光培养4h,弃上清液,每孔加DMSO 150μL,振荡15min,测定吸光值(A570)。根据公式:细胞死亡率(%)=(对照组A570-实验组A570)/(对照组A570-调零组A570)×100%,计算出每组细胞死亡率的平均值。以上实验重复3次。
1.3.4 激光扫描共聚焦显微镜(LSCM)检测细胞[Ca2+]i改变 细胞处理及分组同前。将8mm×8mm盖玻片置于24孔板中,每孔加入RPMI1640培养液500μL,取各组细胞各1×106个种植于盖玻片上,每组设3个复孔。由MTT结果可知细胞在12h死亡率达到高峰,因此于37℃、5%CO2培养箱培养12h。吸去培养液,用无血清培养液洗涤2次,加入5μmol/L Fluo-3/AM 荧光探针,37℃避光孵育60min。PBS洗涤3次。滴加10μL 50%甘油于载玻片上,勾取盖玻片,将爬有细胞的一面接触甘油盖于载玻片上完成封片。用倒置荧光显微镜物镜观察,激发波长488nm,发射波长530nm,按照XYZ三维扫描,扫描密度为1 024×1 024采集荧光图像。每组随机选取8个单细胞,用LSCM定量分析软件测出各细胞相对荧光强度,取平均值。
1.3.5 Western blot法检测 Bax、Bcl-2蛋白表达 细胞处理及分组同前。收集处理后孵育12h的各组细胞,PBS重悬并计数,取1×106个细胞离心沉淀,用已加PMSF的细胞裂解液200μL冰浴裂解1h,4℃12 000×g,离心10min,收集上清液,用Bradford蛋白浓度测定试剂盒测定蛋白浓度,以40μg蛋白质标本上样,经12%十二烷基磺酸钠-聚丙酰胺凝胶(SDS-PAGE)电泳分离蛋白质,电转至PVDF膜,5%脱脂奶粉37℃封闭1h,加入Bcl-2、Bax一抗4℃过夜,TBST室温洗3次,每次10min,加入二抗常温孵育1h,TBST室温洗3次,每次10min,凝胶成像系统显色,检测激活型Bcl-2、Bax蛋白水平,以β-actin水平作为等量蛋白上样对照。用Quantity One图像分析软件分析结果,印迹条带吸光度=平均吸光度×面积。Bax/Bcl-2=Bax条带吸光度/Bcl-2条带吸光度。
横在李愫和萧之间的同样还有文化而差异,李愫生长在嘉义农村,五个哥哥目不识丁,而当初李愫考上大学时家人认为当老师对于这个农民家庭是件光宗耀祖的事情,所以受到了全票支持。李愫的丈夫萧出生优渥,他崇拜美国文化,几十年来一直模仿者美国的生活方式,他要求李愫打扮成他想要的样子,而李愫十多年来究竟还是没有学会萧的那套美国的生活方式,萧曾经甚至称李愫为“农业社会”的产品,这种自以为是的优越使得李愫很不是滋味,李愫“一寸一寸的发觉,嫁给一个人,也同时嫁给对方的社会”③,这就像一个代表了传统一个代表了现代,一个是东方一个是西方,这不仅仅是夫妻双方在生活上的矛盾,更是两种文化在一场婚姻中的冲撞。
1.4 统计学处理 所有实验进行至少3次。使用SPSS18.0统计分析软件进行统计学处理,数据均用±s表示,MTT结果进行重复测量数据的方差分析,激光扫描共聚焦及Western blot检测采用AVOVA检验。以P0.05为差异有统计学意义。
2 结 果
2.1 各组细胞死亡率 脉冲处理后2、12、24、36、48h各组细胞的死亡率见表1。相同时间点,处理脉冲个数越多,细胞的死亡率越高,存在明显的剂量依赖关系;同一处理组细胞,于处理后12h细胞死亡率达到高峰,明显高于其余各时间点(P0.01)。

图1 LSCM透射扫描Hela细胞检测皮秒脉冲对[Ca2+]i的影响(×200)
2.2 各组细胞[Ca2+]i检测结果 HeLa细胞经 Fluo-3/AM装载后细胞质呈绿色荧光。低、中、高剂量组扫描视野内可见细胞质内荧光,与对照组相比普遍增强,个别细胞荧光极度增强;对照组细胞普遍为弱荧光强度,见图1。各组随机采集8个结构清晰、胞膜完整的单HeLa细胞,测定其荧光强度并行半定量分析,低、中、高剂量组细胞相对荧光强度分别为58.40±4.80、75.89±8.93和101.72±9.62,均明显高于对照组(39.14±5.97,P0.01)。
2.3 Bax、Bcl-2蛋白表达结果 对照组中Bax表达量较低,经皮秒脉冲处理后,其表达量升高,且脉冲剂量越大,表达越强;抗凋亡蛋白Bcl-2在各处理组表达较对照组有所减弱(P0.01);Bax/Bcl-2比例上调,促凋亡作用明显,且高剂量组Bax/Bcl-2比例上调现象最为明显,其诱导凋亡的作用最强,见图2、3。

图2 Western blot法检测Bax、Bcl-2表达的结果

图3 各组细胞Bax/Bcl-2平均光密度值
3 讨 论
宫颈癌的发病率居女性生殖系统恶性肿瘤之首,目前主要采取手术结合放、化疗的综合治疗方案。传统治疗在治病的同时往往会对生殖器官造成严重损害,影响性功能及生育能力。随着近年来宫颈癌发病年轻化及患者对生活质量要求的不断提高[11],寻求一种既能有效杀灭肿瘤细胞又能保持生殖系统完整性的无创治疗手段,是医患双方的共同期待。高强度皮秒脉冲电场因其高场强、低脉宽的物理学特性,具有集中性好、激发能量高、超宽带频谱丰富、方向性精确、控制性良好等优势,成为无创治疗研究的良好选择。
目前,国内外有关高强度皮秒脉冲生物电效应机制的研究甚少,仅有两篇有关皮秒脉冲实验研究的报道,证实了皮秒脉冲对肿瘤细胞的损伤效应是热效应和电效应的联合作用,但并未进行相关机制探讨[12]。与上述研究不同,本研究一方面通过降低皮秒脉冲参数剂量以避免热效应,同时进行相关机制探讨,用不同实验方法探讨皮秒脉冲电场对HeLa细胞的损伤效应及相关机制。
MTT比色法显示经高强度皮秒脉冲作用后HeLa细胞生长受到不同程度抑制,且存在明显的剂量和时间依赖关系。已知细胞死亡可表现为坏死和凋亡,其中坏死即刻发生,而凋亡需要时间来完成。因此,处理后2h细胞生长抑制可能由细胞坏死造成,而处理后12h细胞抑制率增高,则说明细胞可能发生了凋亡。为了研究高强度皮秒脉冲能否诱导细胞凋亡,本研究同时进行了细胞[Ca2+]i和 Bax/Bcl-2蛋白表达量实验检测。
激光扫描共聚焦示皮秒脉冲处理组细胞荧光强度显著高于对照组,提示皮秒脉冲可导致细胞[Ca2+]i升高。已知哺乳动物细胞核膜与细胞膜的充电时间常数分别为几十纳秒(ns)和几百纳秒,而细胞器的充电时间常数仅为几百皮秒(ps)[13]。高强度皮秒脉冲电场具有极高的场强、极窄的脉宽(ps级),当作用于细胞时,不满足细胞膜电穿孔所需的充电时间,对细胞膜无损伤,而胞内细胞器(如线粒体、内质网等)因充电速度极快,可先于细胞膜与核膜受到影响[14],故可以排除[Ca2+]i升高是由于细胞膜不完整情况下胞外Ca2+内流所致,而可能来自于内质网、线粒体等胞内Ca2+库的释放。Ca2+是细胞内重要的第二信使,已有大量研究证实[Ca2+]i升高参与了凋亡早期信号转导和凋亡的执行阶段。线粒体跨膜电位(ΔΨm)的崩解,[Ca2+]i升高,使许多与细胞凋亡直接相关的酶或蛋白质被释放到胞质中,就可能通过破坏核内染色质、激活Caspase或作用于其他Ca2+依赖性蛋白质引起细胞凋亡。本实验中处理组细胞[Ca2+]i升高,很可能进而诱导细胞凋亡。
Bcl-2基因家族及其相关蛋白Bcl-2是研究最早的与凋亡有关的基因,也是目前最受重视的调控细胞凋亡的基因家族。Bcl-2是细胞凋亡的负调因子,Bax能拮抗Bcl-2,进而促进细胞凋亡。因此,细胞中Bax/Bcl-2比例可以反映细胞的死亡调控状态。本实验中处理组细胞Bax/Bcl-2比例上调,且高剂量组最为明显,说明高强度皮秒脉冲电场能影响细胞的生存状态,促进细胞内Bax高表达,从而诱导细胞凋亡的发生。
高强度皮秒脉冲电场因其独特的物理学特性,有望成为继热疗、磁疗、高强度聚焦超声等疗法之后又一种新颖、无创、有效的肿瘤物理治疗手段。目前国外对皮秒脉冲电场的生物学效应研究甚少,本课题组在国内首次对皮秒脉冲电场对肿瘤细胞的生物电学效应进行研究,旨在为基于靶向诱导凋亡的高强度皮秒脉冲无创治疗技术提供研究基础,其有效实验参数的筛选、细胞凋亡分子机制的探讨、动物实验中皮秒天线的辐射及聚焦等诸多领域有待进一步研究解决。
[1]JoséA,Sobrevals L,Ivorra A,et al.Irreversible electroporation shows efficacy against pancreatic carcinoma without systemic toxicity in mouse models[J].Cancer Lett,2012,317(1):16-23.
[2] Shankayi Z,Firoozabadi SM.Tumor growth inhibited by low-voltage amplitude and 5-kHz frequency electrochemotherapy[J].J Membr Biol,2011,244(3):121-128.
[3] Cemazar M,Jarm T,SersaG.Cancer electrogenetherapy with interleukin-12[J].Curr Gene Ther,2010,10(4):300-311.
[4] Neal RE,Davalos RV.The feasibility of irreversible electroporation for the treatment of breast cancer and other heterogeneous systems[J].Ann Biomed Eng,2009,37(12):2615-2625.
[5] Heller LC,Heller R.Electroporation gene therapy preclinical and clinical trials for melanoma[J].Curr Gene T-her,2010,10(4):312-317.
[6] Horton HM,Lalor PA,Rolland AP.IL-2plasmid electroporation:from preclinical studies to phaseⅠclinical trial[J].Methods Mol Biol,2008,423:361-372.
[7] Schoenbach KH,Hargrave B,Joshi RP,et al.Bioelectric effects of intense nanosecond pulses[J].IEEE Trans Dielectr Electr Insul,2007,14(5):1088-1107.
[8] Yao C,Mi Y,Li CX,et al.Study of transmembrane potentials on cellular inner and outer membrane-Frequency response model and its filter characteristic simulation[J].IEEE Trans Biomed Eng,2008,55(7):1792-1799.
[9] Schoenbach KH,Beebe SJ,Buescher ES.Intracellular effect of ultrashort electrical pulses[J].Bioelectromagnetics,2001,22(6):440-448.
[10]Beebe SJ,Fox PM,Rec LJ,et al.Nanosecond,high-intensity pulsed electric fields induce apoptosis in human cells[J].FASEB J,2003,17(11):1493-1495.
[11]Bray F,Loos AH,Mccarron P,et al.Trends in cervical squamous cell carcinoma incidence in 13European countries:changing risk and the effects of screening[J].Cancer Epidemiol Biomarkers Prev,2005,14(3):677-686.
[12]Schoenbach KH,Shu X,Ravindra P,et al.The effect of intense subnanosecond electrical pulses on biological cells[J].IEEE Trans Plasma Sci,2008,36(2):414-422.
[13]Yao C,Mo DB,Li CX,et al.Study of transmembrane potentials of inner and outer membranes induced by pulsedelectric-field model and simulation[J].IEEE Trans Plasma Sci,2007,35(5):1541-1549.
[14]龙再全,姚陈果,孙才新,等.ps电场脉冲无创治疗肿瘤的方法及天线设计[J].高电压技术,2010,36(5):1275-1280.
In vitro study of damaging effects of intense picosecond pulsed electric field on HeLa cells*
ObjectiveTo investigate the damaging effect and mechanism of intense picosecond pulsed electric field(psPEF)on HeLa cells in vitro.MethodsIntense psPEF with constant parameters(pulse duration of 800ps,repetition frequency of 3Hz,and electric intensity of 250kV/cm)and different pulses(0,1 000,3 000and 5 000)were performed on HeLa cells.MTT assay was used to trace the effect of growth inhibition at different times.The changes of[Ca2+]i in HeLa cells were observed by laser scanning confocal microscope using Fluo-3/AM as the calcium fluorescent indicator.Western blot was used to measure the changes of expression level of Bcl-2and Bax.ResultsThe mortality rate of HeLa cells elevated with increasing of the amount of pulses,and the maximum inhibitory rate was observed 12hafter the treatment.Compare with the control group,[Ca2+]i was markedly increased by treatment with psPEF (P0.05).By increasing the pulse number,the expression of Bax was increased from 0.205±0.102in control group to 0.257±0.083,0.586±0.138and 0.791±0.262in treated groups(P0.05),and Bcl-2was decreased from 0.694±0.132in control group to 0.591±0.145,0.364±0.105and 0.262±0.092in treated groups(P0.05),demonstrating significant increase of Bax/Bcl-2ratio in all treated groups(P0.05).ConclusionIntense psPEF can damage the HeLa cells as well as inducing tumor cell apoptosis.
electromagnetic fields;pulse therapy;apoptosis;tumor cells,cultured
10.3969/j.issn.1671-8348.2012.18.001
A
1671-8348(2012)18-1785-03
* 基金项目:国家自然科学基金面上项目(81172123,50877083)。△
,Tel:13908359484;E-mail:xiongzhengai61@21cn.com。
2011-12-19
2012-02-22)
•论 著•

