配合物锌-2,5-噻吩二羧酸-邻菲啰啉的合成及其与DNA作用的研究
徐 进, 姜美平, 武光磊, 高恩军
(1.沈阳化工大学应用化学学院,辽宁沈阳110142;
2.沈阳市无机分子基材料化学(国际)重点实验室,辽宁沈阳110142)
顺铂是典型的无机抗肿瘤药物,但有较大的毒副作用,为了克服这一不足,科学家对其它金属配合物的药物前期基础性进行了研究.过渡金属配合物在配位化学和生物无机化学学科具有重要的作用,锌是组装配位化合物时常选用的金属元素,离子易与含N、S配位原子的配体形成配位化合物.过渡金属配位化合物的潜在应用前景激发了人们的研究兴趣,大量的配位化合物已被制备出来,其结构和性能已被深入研究.金属锌配合物在生命科学中具有重要作用,对肿瘤细胞具有较强的抑制活性[1-5].通常,DNA分子是抗癌化合物作用的主要靶标,而光谱学技术是研究化合物与DNA作用程度及探讨反应机理的重要手段.为进一步探讨锌混合配体配合物与DNA作用机理,我们以2,5-噻吩二羧酸(thca)和邻菲啰啉(phen)为配体,合成了锌配合物[Zn(thca)(phen)(H2O)].借助紫外光谱、荧光光谱和凝胶泳法,研究配合物与DNA的作用规律,使用本实验室培养的Hella细胞进行了细胞凋亡实验,得到较为重要的实验结果.
1 实验部分
1.1 仪器与试剂
Bruker smart 1000 CCD-X射线单晶衍射仪;PHS-3C精密数显酸度计;D-MS-I磁力搅拌器;岛津 UV2240紫外可见光谱仪;日立23010荧光光谱仪;上海JS-380A自动凝胶图像分析仪.
氯化锌、2,5-噻吩二羧酸、邻菲啰啉均为分析纯试剂;HC-DNA从本实验室培养的Hella细胞提取;pBR322 DNA为生化试剂.
1.2 配合物的合成
将10 mL、10 mmol/L的ZnCl2与10 mL、10 mmol/L的2,5-噻吩二羧酸(碱溶)混合,搅拌4 h,将10 mL、10 mmol/L的邻菲啰啉(醇溶)加入混合溶液,持续搅拌2 h,然后用0.8 mol/L KOH溶液调节混合液pH值为6.42,经过滤得到澄清溶液于小烧杯中,用保鲜膜封口,置于空气中,经过几周的溶剂挥发得到晶体.经过Bruker Smart 1000 CCDC-X射线单晶衍射仪确定了以上所得晶体的结构为[Zn(thca) (phen)H2O]配合物.
1.3 配合物的结构
配合物的结构如图1所示.
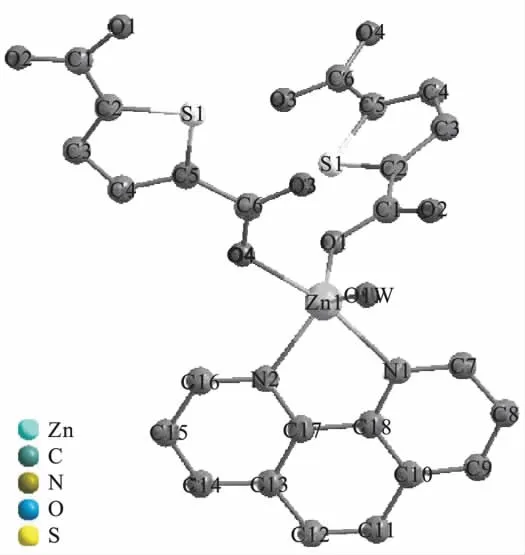
图1 配合物配位结构Fig.1 Complexes with structural H atoms are all omitted
配合物晶体结构中主要的键长(nm)如下: Zn(1)—O(1):0.199 06(14);Zn(1)—O(1W): 0.203 62(14);Zn(1)—O(4)#1:0.206 54(14); Zn(1)—N(2):0.209 57(18);Zn(1)—N(1): 0.217 20(17).
配合物晶体结构中主要的键角(°)如下: O(1)—Zn(1)—O(1W):128.69(6);O(1)—Zn (1)—O(4)#1:95.17(6);O(1W)—Zn(1)—O (4)#1:88.60(6);O(1)—Zn(1)—N(2): 104.12(6);O(1W)—Zn(1)—N(2):126.92 (6);O(4)#1—Zn(1)—N(2):91.87(6); O(1)—Zn(1)—N(1):95.27(6);O(1W)—Zn(1)—N(1):90.75(6);O(4)#1—Zn(1)—N(1):167.12(6);N(2)—Zn(1)—N(1):78.26 (7).
其他晶体数据:F(000)=880;R(int)= 0.016 0;Z=4;-12≤h≤13,-18≤k≤17,-13≤l≤10;R1=0.027 1,wR2=0.071 1(I>2σ(I));R1=0.029 8,wR2=0.072 7(all data).中心锌离子为五配位,显现出不规则四棱锥结构(见图1).为了使得配合物的结构更清晰,H原子全部被省略.
1.4 配合物与HC-DNA作用的光谱测定
1.4.1 配合物与HC-DNA作用的紫外光谱测定图2为一定浓度的配合物(2.0×10-6mol/ L)掺入到不同浓度DNA后的紫外吸收光谱图.
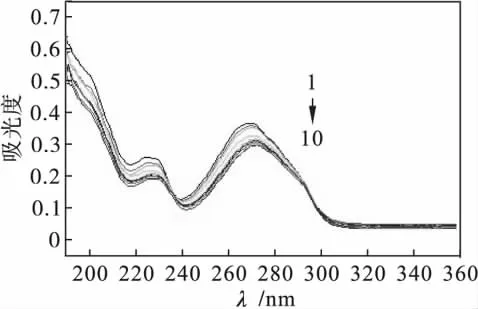
图2 配合物与DNA作用的紫外光谱Fig.2 UV spectra of complexes with DNA
配合物在波长为200~400 nm范围内均有吸收峰.所有这些紫外光谱的最大特征吸收均为芳香氮碱配体内的π-π*电子跃迁形成,配合物分子内电荷迁移光谱的波长相对较长,归属为MLCT谱[6-8],其吸收强度较比π-π*弱.DNA的掺入使配合物各特征吸收峰在波长发生红移的同时,发生明显的减色效应,DNA浓度越大,则上述趋势越明显.这是由于配合物以插入方式与DNA螺旋碱基对结合,发生的π电子堆砌作用,使其配体上π*空轨道与碱基的π电子轨道发生偶合,能级下降,从而导致π-π*跃迁能减小,产生红移现象;同时,偶合后的π轨道因部分填充电子,使 π-π*跃迁几率减小,产生减色效应[9].
1.4.2 配合物与HC-DNA作用的荧光光谱测定
溴化乙锭(EB)具有共轭芳香环的平面结构,能专一平行地嵌入DNA双链的配对碱基之间.在水溶液中,其本身荧光极弱,而DNA分子几乎没有荧光.但当溴化乙锭插入双链DNA分子之后,溴化乙锭分子借助其与碱基之间的堆积作用而能平行地“固定”在DNA分子内部,从而使溴化乙锭分子平面刚性增加,碰撞淬灭减小,发出的荧光强度约提高10倍[10].溴化乙锭不能插入单链DNA中,而只能插入双螺旋DNA分子中.因为它与DNA的插入作用是通过碱基间堆积而产生的.因而,溴化乙锭是一种能与DNA双链发生专一插入作用,且选择性好,灵敏度高的荧光探针.
溴化乙锭(EB)插入DNA后使DNA原来的紧密螺旋松弛,阻碍了DNA的进一步转录复制,进而影响生物体的繁殖.如果所合成的药物(M)与EB的结构相似且本身荧光很弱,就能与DNA发生类似EB的插入作用,而竞争EB与DNA结合的位点,释放出EB,使EB/DNA复合体系荧光减弱:M+EB·DNA=M·DNA+EB.同时可通过跟踪此体系的荧光变化来说明药物(M)与DNA结合能力的强弱.根据经典的斯特恩-沃尔默(Stern-Volmer)方程[11]可说明药物对DNA插入作用的强弱.
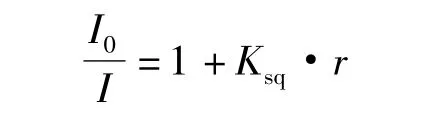
其中:I和 I0分别代表复合物(配合物/EB/ DNA)中存在和不存在配合物时的荧光强度;r为复合物中配合物与DNA的浓度比;Ksq表示斯特恩-沃尔默(Stern-Volmer)淬灭常数,其可以定量描述配合物与DNA作用的强弱.从Ksq值的大小就可以定量地比较几个化合物在相同条件下与DNA作用的强弱程度,Ksq值越大,作用强度越大,结合能力越强.
通过荧光法测定配合物与自提HC-DNA发生相互作用的结果见图3及图4.
从图4中可以看出配合物的淬灭常数Ksq= 0.203,对HC-DNA具有一定的插入能力;从图3中可以看出:随着配合物浓度的增加,DNA-EB复合物的体系荧光强度均逐渐减弱,且发生了不同程度的淬灭,并且浓度越大,荧光猝灭逐渐趋于平衡.
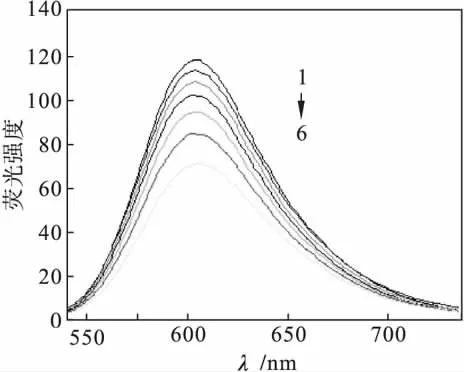
图3 不同浓度的配合物与DNA作用的荧光光谱Fig.3 Fluorescence spectra of the complexes with DNA
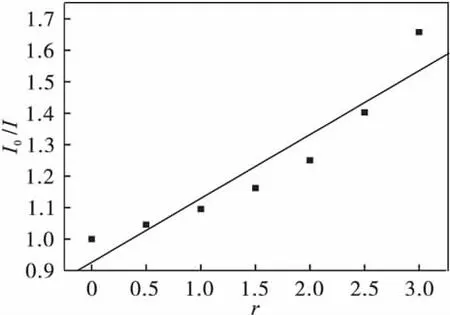
图4 配合物与DNA-EB体系作用的淬灭常数(0.203)Fig.4 Interaction with the DNA-EB system,the role of the quenching constant(0.203)
1.5 凝胶电泳法研究锌配合物对pBR322-DNA的切割作用
在外电场的作用下,带电荷物质会向着与其所带电荷电性相反的电极移动.DNA中存在有亲水性的磷酸基团,在高于其等电点的缓冲溶液中带负电荷,可使DNA在电场中通过凝胶介质向正极泳动;影响DNA在凝胶介质中移动的因素主要有电荷效应、凝胶介质的分子筛效应.在电荷相同的条件下,凝胶介质的分子筛效应至关重要,其与分子量大小及构型有关;分子量越小,空间构型产生的空间位阻越小,迁移位置就越靠前,而DNA带间的距离也就越大.如pBR质粒DNA存在共价闭环(ccc)、单链开环(oc)和线性(linear)三种空间构型;由于ccc分子结构最为紧密,oc分子结构最为松弛,因而在一般情况下,ccc在最前,oc在最后,而linear介于二者之间.当共价闭环型(ccc)DNA的一条链上出现一个缺口(nick)时,超螺旋结构解开,形成开环型(oc)结构.若两条链在同一位置发生断裂时,则成为线形分子(linear).某些能插入DNA双螺旋碱基对之间的试剂,如EtBr、放线菌素D,可以改变DNA的超螺旋状态,使负超螺旋减少,以至完全松开形成oc甚至形成正超螺旋,进而能通过凝胶电泳实验表现出来[12-13].本文基于上述原理及前面的荧光法实验结果,以凝胶电泳实验来研究配合物对DNA的切割作用.
图5是配合物的凝胶电泳实验结果.Lane 0是纯的pBR322-DNA alone,Lane 1~4为4个不同浓度配合物与DNA在有氧的条件下反应1 h的电泳图像.配合物的4个不同浓度1、2、3、4分别是 5.0 μmol/L、2.5 μmol/L、1.25 μmol/L、0.625 μmol/L.从图5可以看出:随着化合物的浓度的增加,FormⅠ在逐渐地减少,FormⅡ也在逐渐地减小,并且FormⅠ、FormⅡ都比Lane0要小.此现象表明了这些配合物对pBR322-DNA具有一定的切割能力.锌配合物对pBR322-DNA的切割,再次证明了配合物是以专一的插入方式与DNA发生作用的.
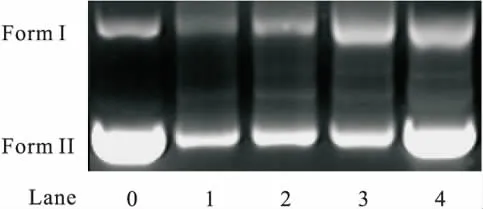
图5 配合物对pBR322-DNA的切割电泳图Fig.5 Electrophoresis of pBR322-DNA cutting via complexes
1.6 锌配合物对HeLa细胞凋亡实验的研究
对于贴壁生长的HeLa细胞,让其在盖玻片上面爬行生长.经浓度为5 μmol/L顺铂作用,配合物处理24 h后,取出盖玻片,经PBS轻轻漂洗后,用乙醇在常温下固定5~10 min,即可染色,固定(fication)的目的是保持细胞自然形态,防止细胞自溶和细菌所致的腐败;固定液能沉淀和凝固细胞内蛋白质和破坏细胞内溶酶体酶,使细胞不但保持自然形态,而且结构清晰,易于着色.着色过程如下:苏木精液染5~15 min→流水稍洗去苏木精液1 min→盐酸乙醇分化30 s→稍水洗10~30 s→促蓝液返蓝10~30 s→流水冲洗10~15 min→蒸馏水过洗1~2 s→伊红液染色2 min→蒸馏水稍洗1~2 s→95%(体积分数)乙醇(Ⅰ)1 min→95%(体积分数)乙醇(Ⅱ)1 min→无水乙醇1 min.
细胞凋亡[14-17]又称细胞程序性死亡,是指细胞在一定的生理和病理条件下,遵循自身的程序,自己结束其生命的过程.细胞凋亡不同于细胞坏死,是程序性死亡过程的一种主要形式,强调的是形态学上的改变.细胞凋亡与细胞坏死的简单区别见表1.

表1 细胞凋亡与细胞坏死的简单区别Table 1 The simple difference between apoptosis and necrosis
将处理好的爬片放在光学显微镜下进行观察、拍照.从图6(a)中可以看出:正常HeLa细胞在染色后呈不规则的多角形,细胞与细胞间连接紧密,细胞核完整,染色体均匀淡蓝色,属正常生长状态.图6(b)是顺铂作用后HeLa细胞凋亡的形态,细胞间隙增大,细胞变圆,变小,细胞核染色质固缩,集聚至核周边呈月牙形斑块,胞核深染,染色质成团块状,细胞表面有出芽现象,并伴有凋亡小体.配合物作用过的细胞也发生了类似的变化,如图6(c),可明显地观察到凋亡的形态学特征.由此看出,HeLa细胞在配合物的作用下发生了不同程度上的凋亡.
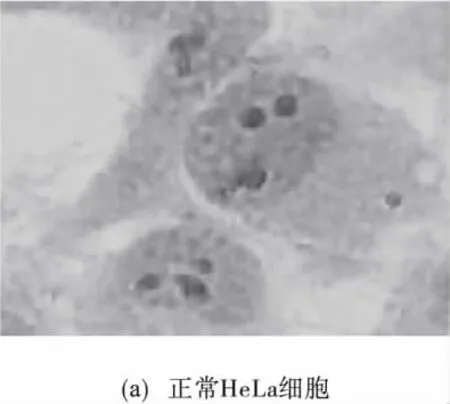
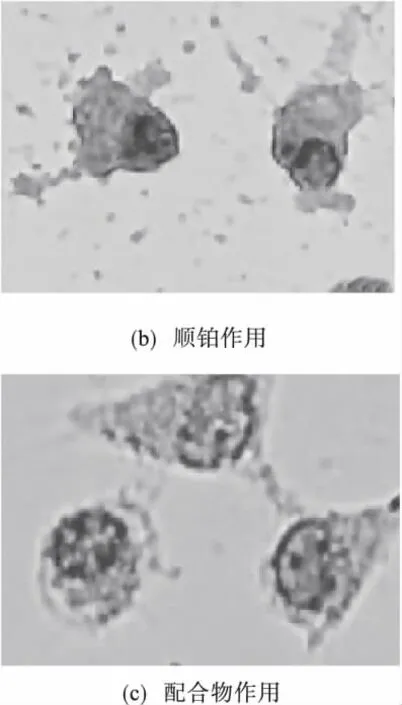
图6 染色后HeLa细胞在显微镜下的形态Fig.6 The shape of the staining of HeLa cells under the microscope
2 结束语
采用常温溶剂挥发的方法合成了1个锌(Ⅱ)配合物,分子式为[Zn(thca)(phen) (H2O)](其中thca:2,5-噻吩二羧酸,phen:邻菲啰啉).用X-射线单晶衍射技术测定了配合物的晶体结构单元.配合物与HC-DNA作用的紫外光谱研究表明:配合物在200~400 nm波长范围内有明显的特征吸收峰,表现为分子内π-π*电子越迁.加入HC-DNA后,配合物的紫外光谱均发生减色效应和红移现象,说明配合物能与HC-DNA发生嵌插作用.配合物与HC-DNA作用的荧光光谱研究表明:DNA/EtBr复合物中加入配合物后,发生荧光猝灭现象,这说明配合物能与溴化乙锭竞争插入DNA碱基对中.配合物电泳实验表明:配合物对pBR322-DNA具有一定的切割能力.细胞凋亡实验结果表明:配合物对HeLa细胞有一定的杀伤能力,对HeLa细胞呈现出明显的细胞凋亡现象.
[1] Gao Enjun,Sun Tiedong,Liu Shihua,et al.Synthesis,Characterization,Interaction with DNA and Cytotoxicity in Vitro of Novel Pyridine Complexes with Zn(Ⅱ)[J].Eur.J.Med.Chem,2010,45 (10):4531-4538.
[2] Zhang Wanzhong,Ma Shuang,Gao Enjun,et al.Synthesis,Crystal Structure,and Photoluminescence of Zinc Complex[Zn(Qina)2(DMSO)2]· 2DMSO[J].Russ.J.Coord.Chem,2009,35(12): 886-890.
[3] Gao Enjun,Liu Lei,Zhu Mingchang,et al.Synthesis,Characterization and Biological a Ctivity of an Intramolecular Stacking Zinc(Ⅱ)Complex[J].Chinese.J.Chem,2009,27(7):1285-1290.
[4] 张万忠,魏德州,高恩军,等.配合物[Zn(PSA)2(H2O)2]的合成及其晶体结构研究[J].光谱实验室,2007,24(2):149-152.
[5] Sun Yaguang,Ren Lingren,Gao Enjun,et al.Bis(1,10-Phenanthroline-k2N',N')(2-Phenethylmalonato-k2O,O')Zinc(Ⅱ)Octahydrate Acta Cryst[J].Acta.Chim,2006,62:2578-2580.
[6] Liu J G,Ye B H,Ji L N,et al.Synthesis,Characterization and DNA-binding Properties of Novel Dipyridophenazine Complex of Ruthenium(Ⅱ):[Ru (IP)2(DPPZ)]2+[J].J.Inorg.Biochem,1999,73 (1/2):117-122.
[7] Gao Enjun,Zhu Mingchang,Yin Hongxi,et al.Synthesis,Characterization,Interaction with DNA and Cytotoxicity in Vitro of Dinuclear Pd(Ⅱ)and Pt(Ⅱ) Complexes Dibridged By 2,2'-Azanediyldibenzoic Acid[J].J.Inorg.Biochem,2008,102(10):1958-1964.
[8] 吴红星,李风华,林华宽,等.二胺桥联邻菲罗啉衍生物的合成及其与DNA相互作用研究[J].无机化学学报,2005,21(1):117-122.
[9] 宋玉民,康敬万,高锦章,等.钴(Ⅲ)配合物与DNA作用研究[J].无机化学学报,2000,16(1): 54-57.
[10]Holder A A,Swavey S,Swavey K J.Design Aspects for the Development of Mixed-metal Supramolecular Complexes Capable of Visible Light Induced Photocleavage of DNA[J].Inorg.Chem.,2004,43(1): 303-308.
[11]张黔玲,刘剑洪,任祥忠,等.新型双核配合物的形成、与DNA的作用机制及荧光性质研究[J].化学学报,2006,64(10):968-974.
[12]王得宝,祁国荣.核酸上册[M].北京:科学出版社,1987.
[13]袁彩霞.DNA断裂剂的合成、与识别基寡聚脱氧核苷酸的偶联及其作用机理[D].太原:山西大学,2004.
[14]张彦,蒋纪恺,刘小珊,等.苦参碱诱导K562白血病细胞分化和凋亡的实验研究[J].癌症,2000,19 (8):756-758.
[15]Santiago G R,Goran N,Kaluderovic S P,et al.Cytotoxic Studies of Substituted Titanocene and Ansatitanocene Anticancer Drugs[J].J.Inorg.Biochem,2008,102(8):1558-1570.
[16]张丽,商学军,滕文荟.葡萄籽提取物诱导前列腺癌PC-3细胞凋亡的实验研究[J].南京理工大学学报(自然科学版),2008,32(6):782-787.
[17]李莹,药立波,王立峰,等.仗提取物白藜芦醇诱导胃癌细胞HGC27凋亡[J].第四军医大学学报,2004,25(19):1797-1799.

