黑曲霉对菲共代谢降解的影响
侯雪敏, 臧淑艳, 李盼盼, 王 娟, 秦晓龙, 林 乐
(沈阳化工大学应用化学学院,辽宁沈阳110142)
多环芳烃是一类广泛存在于环境中的有机污染物,其主要来源为矿物燃料不完全燃烧及火山活动等,也是最早被发现和研究的化学致癌物.菲是典型的多环芳烃类有机污染物之一,具有毒性大和降解性较差等特点.含菲废水主要来源于酸性矿山废水,而酸性矿山废水主要来自于矿井水、选煤废水、焦化厂废水等.这些矿山废水排放量大,持续性强,排放地点分布广泛,不易控制与处理,对环境的污染十分严重.因此,处理废水中的菲成为当今的热点问题,有研究报道[1-2]国内某些重要水域已受到不同程度的污染.
针对难降解的高浓度有机污染物的工业废水,必须采取科学和先进的技术方法进行处理.这些处理技术主要有物理法、化学法和微生物法[3].微生物法是国内外处理酸性废水的最新方法,这种方法有成本低、适用性强、无二次污染等优点,成为国内外研究的热点[4-8].而针对传统方法所确定的微生物难降解物质有必要将共代谢作用考虑在内.共代谢过程提出了一种新的代谢现象,而且降解主要是真菌、细菌等.魏明宝[9]等人以蒽为代表研究了环境微生物对其降解过程.祝儒刚[10]等人对分离的菌株进行了培养条件的优化和对不同浓度菲降解率的测定.许丽[11]等人研究了细菌对多环芳烃的降解能力.胡顺利[12]等人研究了降解菲方面生物的可利用性.文献[13-15]在不同情况下研究了共代谢对微生物降解速率的影响.本实验将微生物降解作用与共代谢作用相结合,利用真菌黑曲霉降解模拟废水中的多环芳烃菲,对实验条件进行探讨.
1 实验部分
1.1 仪器及材料
1.1.1 主要仪器
FT-IR470型红外光谱仪,美国Nicolet公司; HZQ-C双层气浴振荡器,金坛市杰瑞尔电器有限公司;YXQ-LS-18SI型自动手提式灭菌器,上海博讯实业有限公司医疗设备厂;SW-CJ-1D(1G)型单人净化工作台,苏州净化设备有限公司等.
1.1.2 主要试剂
菲、丙酮,分析纯,天津市北方化工购销中心;二氯甲烷,分析纯,沈阳市亿泰贸易有限公司;水杨酸、邻苯二甲酸,分析纯,沈阳莱博贸易有限公司;琥珀酸钠,分析纯,沈阳国药化学试剂有限公司;乙酸乙酯,分析纯,康科德科技有限公司;蔗糖,分析纯,哈尔滨市化工试剂厂等.
1.1.3 菌种来源
实验选用的真菌黑曲霉来自中国科学院生态研究所.
1.1.4 培养基的制备
马铃薯培养基:马铃薯200 g,去皮,切成小块,加蒸馏水1 000 mL,煮沸30 min,过滤,滤液定容到1 000 mL,加蔗糖20 g.
无机盐培养基:NH4NO3,1 g;MgSO4·7H2O,0.2 g;CaCl2·2H2O,0.01 g;FeSO4·7H2O,0.01 g;KH2PO4,0.4 g;Na2HPO4·12H2O,0.6 g;葡萄糖,0.5 g;蒸馏水1 L.
1.2 实验方法
1.2.1 菲含量的测定方法
分别配置体积分数为0、0.5×10-6、1× 10-6、1.5×10-6、2×10-6、2.5×10-6、3×10-6、4×10-6、5×10-6、8×10-6的标准溶液,使用紫外分光光度计测量样品Abs,根据Lambert-Beer定律:A=εbc,光谱带宽1 nm,取样间隔1 nm,在253 nm处记录吸光度,保存数据,绘制曲线.
1.2.2 真菌黑曲霉生长曲线
将配置好的马铃薯培养基精确分装于16个250 mL锥形瓶中,每瓶50 mL,在无菌室将培养24 h的黑曲霉菌接到锥形瓶中,在摇床中培养5 d.用电子天平对烘干后的每张称量纸进行称质量,每6 h取2个平行样进行过滤、烘干、称质量,计算每6 h黑曲霉质量净增情况,绘制出黑曲霉生长曲线.
1.2.3 菲初始体积分数对降解的影响
配置体积分数为20×10-6、60×10-6、100× 10-6、140×10-6、180×10-6菲的溶液,然后每个锥形瓶接入体积分数10%黑曲霉,用纱布封好口放入摇床,培养5 d.过滤,用二氯甲烷萃取,定容.每份3个平行样,使用紫外分光光度计测量样品在253 nm处的吸光度,计算菲降解率.
1.2.4 不同共代谢底物对菲降解的影响
先按无机盐培养基配方配制1 000 mL培养基,精确分装5份于250 mL锥形瓶中,每份200 mL,之后分别称取水杨酸、琥珀酸钠、磷苯二钾酸、萘,使其与菲的体积比为1∶5,配制体积分数100×10-6菲溶液,然后每个锥形瓶接入体积分数10%上述培养的黑曲霉,每份3个平行样,用纱布封好口放入摇床,培养5 d.过滤,用二氯甲烷萃取,定容.使用紫外分光光度计测量样品吸光度,计算菲降解率.
1.2.5 菲与共代谢底物的最佳浓度比
先按无机盐培养配方配制1 000 mL培养基,精确分装5份于250 mL锥形瓶中,分别配置体积分数为0、20×10-6、60×10-6、100×10-6、140×10-6珀酸钠溶液,每个锥形瓶放入0.020 0 g菲(即体积分数100×10-6菲溶液),然后每个锥形瓶接入体积分数10%、培养24 h的黑曲霉,每份3个平行样,入摇床.培养5 d.过滤,用二氯甲烷萃取,定容.使用紫外分光光度计测量样品吸光度,计算菲降解率.
1.2.6 酸度对菲共代谢降解的影响
将1 000 mL无机盐培养基精确分4份装于250 mL锥形瓶中,配制出体积分数100×10-6菲溶液及琥珀酸钠溶液,调节每个锥形瓶pH值,使4瓶pH值分别为5.0、6.0、7.0、8.0,然后每个锥形瓶接入体积分数为10%的黑曲霉,每份3个平行样,用纱布封好口放入摇床.设定摇床温度28℃,转速为150 r/min,培养5 d.过滤,用二氯甲烷萃取、定容.测样:使用紫外分光光度计测量样品吸光度,计算菲降解率.
2 结果与讨论
2.1 菲检测标准曲线
由图1可知:线性方程为 y=0.340 6x+ 0.009 5,其中R2=0.998 8.当菲体积分数在0~8×10-6之间时,菲的吸光度呈良好直线形状,因此,之后测定菲浓度时用此菲的标准曲线,浓度太高则进行稀释,太低则进行浓缩.

图1 菲溶液的标准曲线Fig.1 Standard curve of phenanthrene solution
2.2 真菌黑曲霉生长曲线
从图2可以看出:黑曲霉在前12 h生长缓慢,从12 h到30 h生长极其迅速,成对数生长期,30 h后黑曲霉长势基本处于稳定状态,因此,黑曲霉最佳生长时间为30 h.

图2 黑曲霉的生长曲线Fig.2 Growth curve of the aspergillus niger
2.3 菲起始浓度对降解的影响
菲起始浓度对降解的影响如图3所示.

图3 菲起始体积分数对降解的影响Fig.3 Effect of initial concentration of phenanthrene on the degradation
由图3可知:起始浓度对菌株生长的影响较为明显.在一定范围内,随着菲起始浓度升高,有利于微生物降解,当菲体积分数达到100×10-6时,菲的降解率达到最高,但是随着菲浓度继续增大时,降解率随之降低.这可能是因为开始时未达到微生物的毒性耐受限度,当菲浓度过高的时候,菲毒性增大,达到微生物耐受限度,导致真菌活性降低,因此,真菌对菲的降解率降低.所以菲溶液的最佳体积分数为100×10-6.以下实验菲浓度均采用体积分数100×10-6.
2.4 不同共代谢底物对菲降解的影响
对比图3可以看出:在有共代谢底物的存在下,降解率有明显提高.由图4可以看出,共代谢底物对降解率影响:萘<邻苯二甲酸<水杨酸<琥珀酸钠,并且可以看出琥珀酸钠可以最大程度地提高菲的降解率.这可能是因为向废水中加入代谢中间产物能提高微生物酶的活性,而琥珀酸钠更好地提高了某些可诱导酶活性,使菲更具有亲和力,因此,能被迅速降解,促进共代谢降解过程.因此,选择琥珀酸钠作为共代谢的一级基质较好.
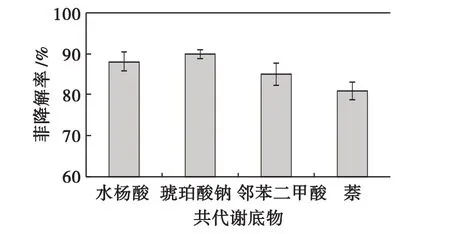
图4 不同共代谢底物对菲降解率的影响Fig.4 Influence of different metabolic substrate on the degradation of phenanthrene
2.5 菲与共代谢底物的最佳浓度比
图5可知:随着琥珀酸钠浓度升高,菲的降解率随之升高,当琥珀酸钠体积分数达到100× 10-6时,菲的降解率达到最高,在体积分数为140×10-6时下降.这可能是因为琥珀酸钠浓度在一定范围内为黑曲霉提供了良好的碳源,由于琥珀酸钠和菲有相似的结构,使黑曲霉在降解琥珀酸钠的同时所分泌的酶很好地降解了菲;但是,当琥珀酸钠体积分数大于100×10-6时,即达到140×10-6,菲和琥珀酸钠有竞争关系,琥珀酸钠毒性更小,比较容易降解,使菲的降解率有所降低.所以,在实验中作为共代谢底物的琥珀酸钠最佳体积分数为100×10-6,以下实验琥珀酸钠体积分数均采用100×10-6,即菲与琥珀酸钠最佳体积分数比为1∶1.
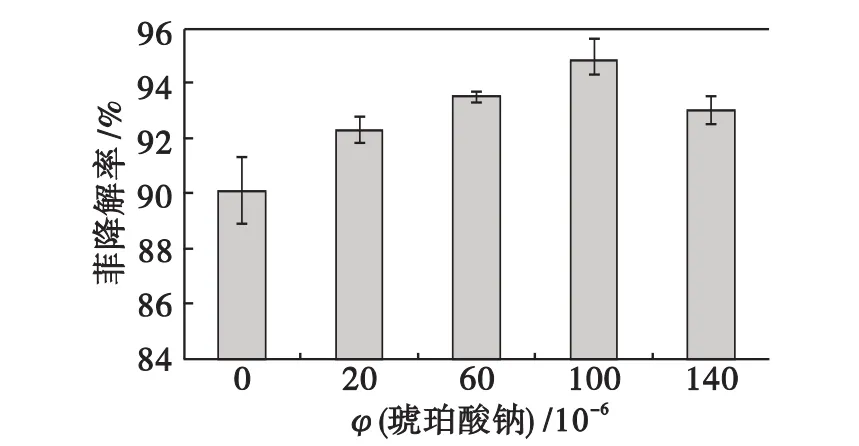
图5 不同琥珀酸钠体积分数对菲降解率的影响Fig.5 Influence of different succinic acid sodium concentration on the phenanthrene degradation
2.6 酸度对菲共代谢降解的影响
由图6可知:在pH值为5.0、8.0时,酸度对菲共代谢降解率变化影响不大,最佳pH范围是6.0~7.0.其原因可能是微生物更适合于弱酸性,在pH6.0~7.0左右时,微生物酶活性大大提高,使菲的降解率增大;当趋于碱性时,微生物酶活性受到抑制,降解率降低.最佳pH范围在6.0~7.0.

图6 不同pH值对菲降解率的影响Fig.6 Effect of different pH on the phenanthrene degradation
3 结论与展望
实验主要研究了优势真菌黑曲霉对模拟的含菲废水降解作用,主要结论如下:
(1)通过黑曲霉生长曲线的实验可知黑曲霉的最旺盛生长时间为30 h.
(2)通过对菲浓度的选择,得出黑曲霉降解菲的最佳体积分数为100×10-6.
(3)通过对不同共代谢底物的实验,得出最佳共代谢底物为琥珀酸钠.
(4)对不同的一级基质与二级基质的体积分数比实验,得出体积分数比为1∶1时效果较好.
(5)通过进行酸度对共代谢影响的实验,得到pH值在6.0~7.0左右,降解率最高.
由于时间和实验条件的关系,诸多新发现和新设想还未来得及进一步的验证.在今后的实验研究中,应把对降解产物的结构、特点及毒理性质的研究作为重点,从而选择降解方法和途径.
[1] Ho K C,Hui K C C.Chemical Contamination of the East River(Dongjiang)and Its Implication on Sustainable Development in the Pearl River Delta[J].Encironment Intermational,2001,26(5/6):303-308.
[2] 李惠敏,霍家明.海河流域水污染现状与水资源质量状况综合评价[J].水资源保护,2000(4):12-14.
[3] Wang Jian-long.Biosorption of Copper(Ⅱ)by Chemically Modified Biomass of Saccharomvces Cerevisiae[J].Process.Biochemistry,2002,37(8): 847-850.
[4] Zang S Y,Li P J,Li W X,et al.Degradation Mechanisms of Benzo[a]Pyrene and Its Accumulated Metabolites by Biodegradation Combined with Chemical Oxidation[J].Chemosphere,2007,67 (7):1368-1374.
[5] Zang S Y,Lian B.Bio-degradation of 2-naphthol and Its Metabolites by Coupling Aspergillus Niger with Bacillus Subtilis[J].J Environ Sci,2010,22(5): 669-674.
[6] 臧淑艳,李培军,张英,等.污染土壤中苯并(a)芘的微生物降解途径研究进展[J].生态学杂志,2006,25(8):978-982.
[7] 胡凤钗,苏振成,孙健,等.高效芘降解菌N12的分离鉴定与降解特性[J].应用生态学报,2011,22 (6):1566-1572.
[8] 白红娟,杨斌盛,贾万利,等.微生物降解土壤中农药残留的研究进展[J].工业安全与环保,2011,37 (11):35-36.
[9] 魏明宝,王纪军,刘海员,等.蒽生物降解及其动力学分析[J].环境科学与技术,2006,29(12):9-14.
[10]祝儒刚,李玉双,钟鸣,等.菲降解细菌L2的培养条件研究及菲降解率测定[J].安徽农业科学,2006,34(3):407-408.
[11]许丽,高振,罗霂,等.一株高效降解芘的细菌分离、鉴定及其降解效果[J].微生物学报,2011,51 (3):313-319.
[12]胡顺利,贾凌云,高慧鹏,等.土壤中不同有机质对菲的吸附行为及生物可利用性的影响[J].环境科学学报,2011,31(2):341-348.
[13]张卫,林匡飞,张巍,等.菲在土壤中的微生物降解研究[J].生态环境学报,2010,19(2):330-333.
[14]张晓健,瞿福平,何苗,等.易降解有机物对氯代芳香化合物好氧生物降解性能的影响[J].环境科学,1998,19(5):25-28.
[15]刘世亮,骆永明,吴龙华,等.污染土壤中苯并[a]芘的微生物共代谢修复研究[J].土壤学报,2010,47(2):364-369.

