不同光质对毛脉酸模根中白藜芦醇、白藜芦醇苷的影响*
王少庸 王振月 陈立超 郭 美 刘 奂 王宗权 唐先明
(黑龙江中医药大学 药学院· 哈尔滨 150040)
植物中药用有效成分主要为植物的次生代谢产物。次生代谢产物在处理植物与生态环境关系上充当着重要的角色[1,2]。次生代谢实际上是植物在长期进化中对生态环境适应的结果,在某种程度上,次生代谢产物的产生和变化比初生代谢产物与环境有着更强的相关性和对应性[3-6]。对于环境因子影响植物次生代谢产物的探讨,常常可以为某些具有重要药用和经济价值的次生代谢产物的高效生产提供理论依据和实践指导,因而这方面的研究工作显得尤为重要。
毛脉酸模(Rumex gmelini Turcz.)为蓼科(Polyonaceae)酸模属多年生宿根草本植物,因其根中含有具有抗癌、抗病毒、防止心血管疾病等显著功效的重要次生代谢产物白藜芦醇及白藜芦醇苷[7],而逐渐被研究人员所关注。目前关于毛脉酸模的资源调查、次生代谢产物(化学成分)的提取、分离、结构确定及含量测定分析等方面已有一些研究工作[8-12]。但光质对毛脉酸模根中的次生代谢产物的影响至今未见报道。为此,我们通过人工栽培实验,研究了光质对毛脉酸模根中白藜芦醇及白藜芦醇苷的影响。本项研究不仅对在生产实践中提高毛脉酸模根中重要次生代谢产物的产率具有重要意义,而且可以为研究植物次生代谢的途径和机理提供依据。
1 仪器与材料
美国Waters高效液相色谱仪(Waters 2695型泵,2996型二极管阵列检测器,Empower色谱工作站);Mettler电子天平AE 240;ZK-82B型真空干燥箱(上海市实验仪器总厂)。
白藜芦醇及白藜芦醇苷的对照品均由美国Sigma公司提供。甲醇,色谱纯,美国DIKMA试剂公司提供;磷酸,分析纯,天津市天河化学试剂厂出品;水,娃哈哈纯净水。
毛脉酸模根样品采于黑龙江中医药大学药用植物园。光质处理组中,红色、蓝色、绿色、黄色滤光膜其相对光强为全光照的53%、52%、50%、60%,遮荫组相对光强为全光照的51%。
2 实验方法
2.1 样品处理
对一年生及二年生毛脉酸模植株进行遮膜处理。遮膜处理组在四周靠近地面处留有通风空隙,并依照日光组的含水量适时浇水,保持土壤含水量基本相等。
2.2 样品采集
处理后每隔15天采样1次,共采样5次,每个处理组采样9株。
2.3 色谱条件
Planetsil C18 分析柱(5μm,200mm×4.6mm),预柱 Phenomenex ODS-C18(4×3.0mm);流动相:流动相A为甲醇,流动相B为水(磷酸调pH为2.0);线性梯度洗脱条件:流动相从甲醇30%到100%甲醇,时间为0-50 min;流速1 mL·min-1;检测波长:303 nm ;柱温:40℃;进样量:20μL。
2.4 对照品溶液的制备
精密称取白藜芦醇、白藜芦醇苷对照品适量,溶于甲醇配制成浓度依次为0.11,0.66mg/ml的标准溶液,分别精密吸取标准溶液,注入高效液相色谱仪,以进样量X(µg)为横坐标,峰面积Y为纵坐标绘制标准曲线,结果见表1。

表1 样品线性关系Tab1 Calibration curves of references
2.5 供试品溶液的制备
毛脉酸模根部阴干后,粉碎过80目筛,在50℃下干燥至恒重。每个样品精密称取0.5g,置索氏提取器内加50%乙醇70ml提取4h,滤过,滤液置蒸发皿中蒸干。残渣用25ml甲醇溶解并定容至刻度,此溶液再过0.45μm的微孔滤膜,弃去初滤液取续滤液作为供试品溶液。
2.6 精密度试验
取对照品溶液,连续进样5次,以白藜芦醇、白藜芦醇苷的峰面积计算,其RSD<1.0%。结果表明,精密度良好。
2.7 稳定性试验
取同一份供试品溶液,分别在0h,2h,6h,18h和24h进样测试,结果显示,按所检测的白藜芦醇、白藜芦醇苷的峰面积计算,其RSD<3.0%。表明样品在24h内稳定。
2.8 重现性试验
取同一样品粉末5份,每份精密称取0.5g,按“2.5”项下制成供试品溶液5份,各取20μL进行测定,以白藜芦醇、白藜芦醇苷的峰面积计算,其RSD<3.0%,表明该方法重现性较好。
2.9 加样回收率试验
精密称取已知白藜芦醇苷含量的样品粉末(过80目筛)5份,精密加入白藜芦醇苷对照品适量,按“2.5”项下制备供试品溶液,测定结果表明,回收率依次为100.31%,99.81%,99.12%,99.45%,103.30%,其平均回收率为100.40%,RSD<2.0%。
2.10 样品含量测定
各样品按“2.5”制成供试品溶液,精密吸取各样品的供试液20μl,注入高效液相色谱仪,测得不同样品中的白藜芦醇、白藜芦醇苷含量,结果见图1-4。利用SPSS软件,对上述含量测定结果进行方差分析,结果见表2。
3 结果与分析
3.1 光质对一年生毛脉酸模根中白藜芦醇及其苷含量的影响
遮荫和不同光质对一年生毛脉酸模根中白藜芦醇苷的含量有一定的影响。遮荫处理的毛脉酸模,其根中的白藜芦醇苷含量的变化趋势与日光组相反,且在处理15d和30d时,白藜芦醇苷的含量明显高于日光组,而在其它处理天数45d、60d、75d其含量略低于日光组(图1)。红膜处理使毛脉酸模根中的白藜芦醇苷含量显著提高,整个处理时期含量均高于日光组和遮荫组(图1A)。蓝膜处理的整个时期,除15d与日光组和遮荫组相差不大外,其它时间白藜芦醇苷含量均低于遮荫组和日光组(图1B)。绿膜处理15d可使该植物根中的白藜芦醇苷的含量略高于遮荫组和日光组,而其它处理时间其含量均低于日光组和遮荫组(图1C)。黄膜整个处理过程中,处理75d毛脉酸模根中的白藜芦醇苷的含量明显低于日光组,其它处理时间含量均在遮荫和日光之间,且差别不大(图1D)。
从图2中可知,遮荫对一年生毛脉酸模根中白藜芦醇含量的影响较大,整个处理时期含量均高于日光组(图2)。红膜处理的毛脉酸模,其根中的白藜芦醇的含量除30d与遮荫组接近外,而其它处理时间其含量均高于日光组和遮荫组(图2A)。蓝膜处理的整个时期内,白藜芦醇的含量均低于日光组和遮荫组(图2B)。绿膜整个处理时期变化趋势与遮荫相反,除60d、70d含量于日光组接近外,其它处理时间含量均高于日光组(图2C)。黄膜处理的整个时期内,白藜芦醇的含量均低于日光组和遮荫组(图2D)。
从表2可见,红膜处理的,其根中的白藜芦醇及其苷的含量显著高于日光组与遮荫组;而其它3种滤光膜处理的均低于日光组和遮荫组。

3.2 光质对二年生毛脉酸模根中白藜芦醇及其苷含量的影响
从图3看出,遮荫处理的毛脉酸模,其根中的白藜芦醇含量的变化趋势与日光组相似,含量差别不大(图3)。红膜处理30d、45d使毛脉酸模根中的白藜芦醇含量高于日光组和遮荫组,而其他处理时间含量低于日光组的和遮荫组(图3A)。蓝膜处理整个时期含量波动不大(图3B)。绿膜处理15d、30d该植物根中的白藜芦醇的含量与日光组和遮荫组相近,而其他处理时间其含量均低于日光组和遮荫组(图3C)。在黄膜的整个处理时期中,毛脉酸模根中的白藜芦醇的含量的变化趋势平稳,且与日光组的变化趋势相反(图3D)。
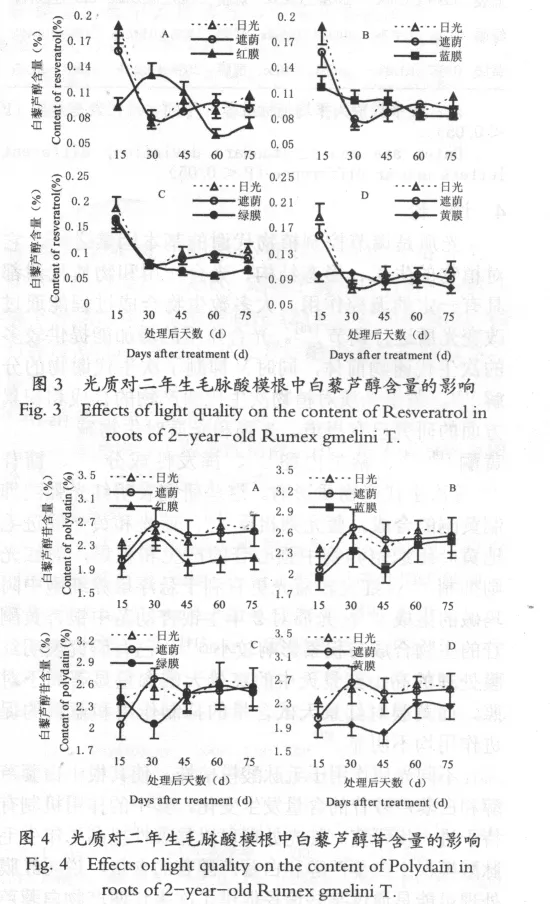
从图4可知,遮荫组与空白组变化趋势相似,且白藜芦醇苷含量差别不大(图4)。红膜、蓝膜、黄膜处理整个时期含量均低于日光组和遮荫组(图4A、B、D)。绿膜处理除30d
白藜芦醇苷含量明显低于日光组和遮荫组外,其他处理时间含量与日光组和遮荫组相近(图4C)。
表2可知,日光组和遮荫组白藜芦醇和白藜芦醇苷含量均显著性高于4种滤光膜。

4 讨 论
光质是调节控制植物代谢的基本因素之一,它对植物的生长、形态结构、光合作用和物质代谢都具有一定的调控作用。大多数生物合成过程能通过改变光质进行调节[13]。光合作用的增加能提供较多的次生代谢物前体,同时又抑制了次生代谢物的分解[14]。关于光质对植物次生代谢产物的合成和积累方面的研究已有报道。光强和光质对生物碱[15-17]、黄酮[18,14]、萜类内酯[14]、挥发性成分[19]、糖苷[20]等次生代谢物质影响。这些研究表明红光强烈抑制黄酮的合成,蓝光则相反[18];蓝光和黄光促进毛地黄叶组织培养物中强心苷的产生和积累,而红光则抑制[21];红光较蓝光更有利于悬浮培养细胞中阿玛碱的生成[22];光质对2年生银杏幼苗中银杏黄酮苷的生物合成与积累影响较小[14]。已有研究表明红膜处理的高山红景天中的红景天甙含量显著高于对照,而黄膜对红景天甙含量的抑制作用和蓝膜的促进作用均不明显[20]。
不同光质作用于毛脉酸模植株,使其根中白藜芦醇和白藜芦醇苷的含量发生变化,其中的作用机制有待于进一步研究。红光处理可以显著性提高一年生毛脉酸模根中白藜芦醇和白藜芦醇苷的含量,说明红膜处理可能是通过某些途径促进了次生代谢产物白藜芦醇和白藜芦醇苷的生物合成。而4种滤光膜处理并没有提高二年生毛脉酸模根中白藜芦醇和白藜芦醇苷的含量,可能是由于其合成受到了抑制。
次生代谢是一个研究难度大但又极具潜力的研究领域。随着对次生代谢生理生化及生态适应方面认识的深入,以及分子生物学手段的渗透,植物次生代谢分子调控的研究发展迅速,人们已着手从次生代谢角度在分子水平上探讨植物与环境因子的关系。因此,环境因子对植物次生代谢产物作用的研究,具有很大的理论和实践意义。
[1]Chen X Y, et al. Plant secondary metabolism and its adjustment,Li C S eds, Advances in Plant Sciences (植物科学进展). Beijing: China Higher Education Press. 1998.
[2]Liang Z, et al. The secondary metabolism of higher plant,Plant Physiol Commun (植物生理学通讯), 1981, (1): 14-21
[3]Gershenzon J. Changes in the levels of plant secondary metabolites under water and nutrient stress. Recent Adv Phytochem, 1984, 18: 273-320.
[4]Josep P, Joan L. Effects of carbon dioxide, water supply,and seasonally on terpene content and emission by Rosmarinus officinalis. J Chem Ecol, 1997, 23: 979-993.
[5]Shelton A L. Variable chemical defences in plants and their effects on herbivore behaviour, Evol Ecol Res,2000, 2: 231-249.
[6]Wink M. Functions of plant secondary metabolites and their exploitation in biotechnology, annual plant reviews,Volume 3. Boca Raton: CRC Press. 1999.
[7]Yan J, Wang Z Y, Liu D N. Advances in study on biological active of resveratrol and polydatin[J]. Acta Chin Med Pharm (中医药学报), 2000, 28(2): 39-40.
[8]Kan Y H, Wang Z Y, Li J K, et al. Separation and identification of two anthraquinone glucosides in Rumex gmelini[J]. China J Chin Mat Med (中国中药杂志), 1996,21: 741-742.
[9]Ren S Z, Wang Z Y, Liu L M, et al. Determination of resveratrol and polydatin contents in root of Rumex gmelini by HPLC[J]. Info Traditional Chin Med (中医药信息), 2000, 17(1):59-60.
[10]Wang Z Y, Cai X Q, Kang Y H, et al. Studies on the chemical constituents of two compounds in Rumex gmelini[J]. Chinese Traditional and Herbal Drugs (中草药), 1996, 27: 714-716.
[11]Wang Z Y, Li Y B, Kuang H X , et al. Separation and identification of chrysophenol and emodin in Rumex gmelini [J]. Acta Chin Med Pharm (中医药学报), 1996,24(2): 54.
[12]Wang Z Y, Ye W H, Yang R F. study on resource research of Rumex gmelini[J]. J Chin Med Materi (中药材), 1996,19: 603-605.
[13]Shen Y W,Zhu Y Z,Liu Y D. Effects of different light quality on Richelia sinica[J]. Acta Hydrobiologica Sinica(水生生物学报), 1999, 23(3): 285-287.
[14]Leng P S , Su S C , Wang T H, et al. Effect of light intensity and light quality on photosynthesis, flavonol glycoside and terpene lactone contents of Ginkgo biloba L. seedlings[J]. Journal of Plant Resources and Environment, (植物资源与环境学报), 2002, 11: 1-4.
[15]Mulder K T, Verpoorte R, van Der KM , et al. Identification of alkaloids and anthra quinones in Cinchona pubescens callus cultures the effect of plant grow th regulators and light on the alkaloid content[J]. Planta Medica, 1984, 50: 17-20.
[16]Hoeft M, Verpoorte R, Beck E. Grow th and alkaloid contents in leaves of Tabernaem ontana pachysiphon Stapf (Apocynaceae) as influenced by light in tensity, water and nutrient supply[J]. Oecologia,1996, 107: 160-169.
[17]Liu Z J, Carpenter S B, Constantin R J. Camp tothecin production in Camp to theca acuminata seedlings in response to shading and flooding[J]. Canadian Journal of Botany, 1997, 75: 368-373.
[18]Zhao D X, Li M Y, Xing J M, et al. Effects of light on cell grow th and flavonoids biosynthesis in calls cultures of Saussurea medusa Maxin[J]. Acta Phytophysiologica Sinaca(植物生理学报), 1999,25: 127-132.
[19]Gouinguene S P, Turlings T C J. The effects of abiotic factors on induced volatile emissions in corn plants[J].Plant Physiology , 2002, 129: 1296-1307.
[20]Yan X F, Wang Y, Shang X H, Effects of greenhouse light in tensity and quality on biomass and salidroside content in roots of Rhodiola sachalinensis[J]. Acta Ecologica Sinica(生态学报), 2003, 23: 841-849.
[21]Feng M, Mao X W, Chen Q. The influences of different light quality and medium composition on the glucoside content in Digitalis purpurea leaves in vitro culture[J]. Journal of Shaoguan University (Natural Science) (韶关大学学报自然科学版) , 1994, 15 (4) : 70-73.
[22]Zheng Z G, Miao H, Yang W J, et al. Effects of nutritional and environmental factors on cell growth and ajmalicine production of full habituated Catharanthus roseus cells[J].Acta Botanica Sinica(植物学报), 1999, 41: 184-189.

