醇析分级和酶法去蛋白对甜菜膳食纤维性质的影响*
朱思明 王文婷 于淑娟
(华南理工大学轻化工研究所,广东广州510640)
膳食纤维(DF)是21世纪最具开发潜力的人体“第七大营养素”.甜菜粕(绝干)含纤维约80%,包括可溶性膳食纤维(SDF,如果胶)和不溶性膳食纤维(IDF)[1].甜菜粕分湿粕、压粕和颗粒粕,其中湿粕是甜菜丝渗出提糖后得到的甜菜废粕,湿粕压榨挤出大部分水分后得压粕,压粕干燥造粒后得颗粒粕.目前,70%甜菜粕作为饲料廉价处理,约30%生产甜菜颗粒粕,附加值可提高20倍.若以甜菜粕为原料提取DF初级品,附加值是废粕的280~420倍.甜菜果胶持水性好,成胶能力强,原料廉价易得,保健作用和生理疗效明显,可用作低热量食品基料,是最好的DF之一.国内外有关甜菜DF的研究[2-5]包括:(1)对人体生理机能的影响;(2)解毒能力和解毒机理;(3)化学结构和抗癌能力的关系;(4)DF的工业化制备技术;(5)DF的改性;(6)重金属废水治理.酸提醇沉法是常用的果胶提取方法[6],Phatak和 Yapo等[7-8]分离了糖用甜菜渣中果胶,并对其结构进行表征,但有关甜菜粕提果胶的预处理方法、甜菜粕种类和果胶分级沉淀对果胶品质的影响无明确结论;酶法去蛋白是IDF的常用脱蛋白方法[2],但鲜见有关IDF的去蛋白率对IDF的结构和形貌影响的研究报道.
为获悉甜菜粕预处理方法对所提取果胶的品质和得率的影响,本研究比较了不同原料提取果胶的最佳工艺条件;分析了果胶提取液悬浮层和沉淀层不同相对分子质量的级分组成和黏度特性;探讨了去蛋白对IDF显微结构的影响.本研究可为甜菜DF品质和应用性能的提高、甜菜粕的高值化资源利用提供参考.
1 材料和方法
1.1 材料、仪器和设备
甜菜湿粕、压粕和颗粒粕,含水量分别为94.2%、7%~8%和3%~5%,甜菜粕干物质中含膳食纤维73%,主要成分是纤维素(20%)、半纤维素(25%)、果胶(28%)及少量蛋白质、木质素和灰分,新疆绿翔糖业有限责任公司生产;木瓜蛋白酶,CAS#9001-73-4(酶活为100万U/g),上海蓝季科技发展有限公司生产;Waters600型高效液相色谱仪,美国Waters公司生产;RS600型流变仪,德国HAKEE公司生产;TM3000型扫描电子显微镜,日本株式会社日立制作所生产.
1.2 实验方法
1.2.1 甜菜果胶的酸溶醇析法提取
果胶提取采用酸溶醇析法:称取经挑拣、粉碎或绞碎、过60目筛的废粕172g(其水分含量为94.2%)或压粕10 g或颗粒粕10 g放入烧杯中,经预处理后加入一定量盐酸,置于恒温水浴锅中在一定温度下提取若干时间,之后趁热过滤,调节滤液pH值至4.5~5.0.待滤液冷却到20~30℃时,加入95%乙醇溶液,使乙醇体积含量达到50%~55%.混合液静置、沉淀1.0~1.5 h,过滤,沉淀物在低于60℃条件下烘干后称重.
1.2.2 甜菜粕预处理方法的选择
甜菜粕用于果胶提取时的预处理方法包括:(1)温水漂洗法,即50℃温水漂洗数次至水清;(2)稀酸浸泡法,即按液料比30∶1(每克料加30mL酸液,余下类推)加入0.02~0.06mol/L的盐酸,浸泡30min,过滤,水洗至清;(3)无预处理.原料经上述过程处理之后,按液料比30∶1(湿粕含水94.2%,计入料液体积)加入pH=1.5的盐酸溶液,在提取温度80℃和提取时间1 h的工艺条件下提取果胶,根据得率和颜色选择预处理方法.
1.2.3 果胶提取工艺条件的优化
在单因素预实验基础上,设计L9(34)正交试验,优化酸溶醇析法提取果胶的工艺条件.考察因素为:浸提温度θ、液料比R和提取时间t.各因素水平因废粕不同而略有差异,变化区间是:温度70~90℃、液料比15∶1 ~35∶1、时间2.0 ~4.5h.
1.2.4 酶法去蛋白
称取含蛋白13.7%的2g IDF置于烧杯中,加入26mL pH 6.0、0.20%的木瓜蛋白酶液(即液料比为13∶1),在65℃保温酶解60min,再在85~90℃灭酶10min,在4000 r/min条件下离心30 min,测定清液中蛋白溶出量(g),去蛋白率等于溶出蛋白量除以0.274(0.274指IDF质量和蛋白含量之积).在研究酶解时间、液料比、酶解温度、酶含量和pH值对IDF结合蛋白水解的影响时,仅变化其中某一因素,其它因素不变.在单因素实验中,酶解时间设为40、50、60、70 和80min,酶解温度为 50、55、60、65 和 70℃,液料比设置为11∶1、12∶1、13∶1、14∶1 和15∶1,酶含量为0.16%、0.18%、0.20%、0.22%和0.24%,pH值为6.0、6.2、6.4、6.6、6.8 和7.0.
1.2.5 果胶的纯度、相对分子质量组成和流变性分析
果胶的纯度采用咔唑比色法分析[9];果胶的相对分子质量组成采用液相色谱分析,色谱条件:Waters 600型高效液相色谱仪配2414型示差检测器,色谱柱为葡聚糖凝胶柱(7.8 mm×300 mm),柱温30℃,进样体积20μL,流动相为水,流速0.5mL/min;用HAKKE RS600型流变仪分析果胶流变性:使用PP35Ti平板,在测量单元间距1000 μm的条件下测定不同剪切速率下(0~100 s-1)1 mL样品的黏度,扫描时间为3.00min,测定温度为25℃.
1.2.6 蛋白质含量的测定和甜菜膳食纤维的扫描电镜分析
参照《食品中蛋白质的测定》(GB5009.5—2010),采用凯氏定氮法测定不溶性膳食纤维中总蛋白质的含量.酶解液离心后采用考马斯亮蓝法测定可溶性蛋白含量[2,10].用于扫描电镜(SEM)分析的甜菜膳食纤维样品包括甜菜压粕、提果胶后压粕IDF、灭活酶处理提果胶后压粕IDF和去蛋白压粕IDF,用双面胶布将经过粉碎的甜菜粕和IDF粘牢在镀金台上,镀膜后进行2000倍扫描观察.对于灭活酶处理提果胶后IDF,用木瓜蛋白酶在85~90℃灭活10min,再在65℃下对提果胶后压粕作去蛋白处理1 h,之后过100目筛并洗净残留失活蛋白酶,最后将IDF干燥后用于SEM分析.去蛋白压粕IDF的SEM分析与灭活酶处理提果胶后IDF类似,差别在于酶反应1h后再对酶灭活.
2 结果与讨论
2.1 甜菜粕的预处理对果胶色泽和得率的影响
用于甜菜果胶提取的原料有湿粕、压粕和颗粒粕.有关甜菜粕果胶提取条件对果胶品质影响的报道较多[8],但有关甜菜粕原料和预处理方法对提取果胶品质的影响报道较少.按1.2.1和1.2.2所述方法分析甜菜粕的预处理对果胶色泽和得率的影响.由表1可知,稀酸浸泡法提取果胶的得率偏低,颜色最浅,原因可能是稀酸既溶解了杂质,也去掉了部分果胶;3种原料不经预处理直接用于果胶提取,果胶得率最高,但颜色相对深;温水漂洗法处理压粕和颗粒粕时,其颜色和得率介于稀酸浸泡法和无预处理之间.由于3种预处理方法所得果胶颜色相差不大,但得率相差大,且残留的少量制糖色素一般具有天然抗氧化活性[11],故认为原料可不经预处理,直接用于果胶提取.
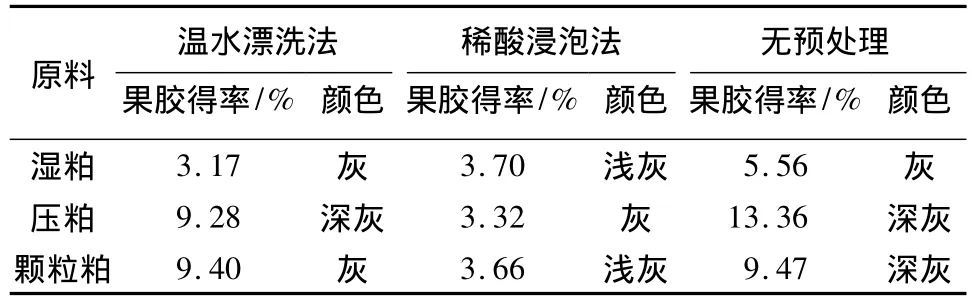
表1 甜菜粕预处理对果胶色泽和得率的影响Table 1 Effect of pretreatment of beet pulp on the color and yield of beet pectins
2.2 不同甜菜粕原料提取果胶的工艺条件比较
3种甜菜粕都可用于果胶的提取,不同废粕水分含量不同,品质不同,提取果胶的工艺条件也不同.在预实验基础上,固定提取液pH值为1.0,按1.2.3方法探讨不同原料果胶得率和纯度随浸提温度、液料比、提取时间的变化规律,得出各甜菜粕原料提取果胶的最佳工艺条件.由表2可知,原料不同果胶提取工艺条件基本相同,其中甜菜湿粕干燥后液料比最大(30∶1),而颗粒粕提取时间最长,这可能与其造粒后颗粒结构致密有关;就果胶得率和纯度而言,甜菜湿粕果胶得率最高但纯度最低,压粕果胶得率最低但纯度最高;就果胶得率和纯度乘积而言,颗粒粕的最大,与甜菜湿粕差别不大,但远大于压粕,说明由湿粕加工为压粕过程中存在果胶损失,即压粕水中富含一定量果胶.

表2 不同甜菜粕原料提取果胶的最佳工艺条件Table 2 Optimal operational conditions of extracting pectins from various beet pulps
2.3 分级沉淀果胶的相对分子质量与流变性
2.3.1 分级沉淀果胶的相对分子质量组成
实验过程中发现,酸溶醇析法提取甜菜颗粒粕果胶,果胶在醇中会分级为絮状的悬浮层果胶和沉淀层果胶,且悬浮层果胶比沉淀层果胶颜色浅.甜菜粕中提取出来的总果胶,以及悬浮层、沉淀层果胶的液相色谱如图1所示.从图1中可看出,该果胶的相对分子质量主要分布在3个范围内,且不同相对分子质量的果胶所占比例互不相同.高效液相色谱图中,相对分子质量大的果胶分子先出峰,相对分子质量小的分子后出峰.经对比可知,悬浮层、沉淀层絮状物都是果胶,悬浮层的相对分子质量大的果胶较沉淀层多,而相对分子质量小的果胶较少.果胶最重要的性质就是胶凝化作用,同一凝胶条件下,果胶的相对分子质量越大,其凝胶强度越大,形成凝胶越迅速,弹性也越好[12-14].由此推断,悬浮层果胶的品质更好.果胶之所以分层析出,原因有二:一是乙醇夺水促使果胶析出;二是悬浮层果胶的密度较小,相对分子质量大的果胶比例大、导致果胶分层得到两种不同品质的果胶产品.

图1 颗粒粕的总果胶、悬浮层和沉淀层果胶色谱图比较Fig.1 Chromatograph comparison of total pectin,the suspended and deposited pectin layer of grain pulp
2.3.2 甜菜果胶的黏度分析
图2示出了25℃时,0.1%、0.2%、0.3%、0.4%和0.5%的甜菜压粕果胶溶液的表观黏度与剪切速率的关系.从图2可知,随着剪切速率的增加,表观黏度先急剧下降,然后逐渐趋向平缓,表现出剪切变稀的假塑性.此现象主要是由于果胶溶液中多糖大分子在浓度梯度场中的定向所致,而且剪切速率越大,定向作用越强,分子的流动方向越趋于一致,大分子之间的相互作用减弱[12-14].

图2 剪切速率和果胶含量对果胶黏度的影响Fig.2 Effect of shear rate and pectin content on the viscosiy of pectin
从图2中还可看出,果胶溶液随其浓度的增大表观黏度也增大,大多数聚合物在浓度较稀时均符合此变化规律,因为随着溶液浓度的增大,溶液中大分子数量增加,分子间联结和缠结程度大大增加,果胶分子间分子作用力增大,流体流动阻力增大,溶液黏度增加.
在剪切速率为0~100 s-1的条件下,分别比较含量均为0.5%的颗粒粕总果胶、颗粒粕悬浮层果胶和颗粒粕沉淀层果胶的流变学特性,结果如图3所示.从图3中可看出,3种果胶均表现出表观黏度随剪切速率增大而减小、最后趋于平缓的趋势.且悬浮层果胶的黏度值最大,总果胶的黏度值居中,沉淀层果胶的黏度值最小.通过对各果胶流变学特性分析可推测出,悬浮层果胶的品质最好,沉淀层果胶的品质最差.

图3 剪切速率对不同颗粒粕果胶黏度的影响Fig.3 Effect of shear rate on the viscosities of different grain pulp pectins
2.4 不可溶性膳食纤维的去蛋白纯化
甜菜粕提取果胶后剩余的残渣为粗的IDF,其主要杂质为蛋白质,含量为13.7%.去蛋白质是纯化IDF的主要工序之一,主要目的是提高DF的纯度,改善DF的生理功效,减少对食品品质的影响,方便在食品加工中的应用,增大DF在食品及医药行业的应用范围,以及便于储藏[15].本研究采用酶法去蛋白纯化甜菜粕IDF,探讨了酶解时间、酶解温度、液料比、酶含量和酶液pH值对去蛋白率的影响.
由图4可知:最佳酶解温度和酶液pH值分别为65℃和6.8;随着酶解时间、液料比和酶含量的增加,相应的去蛋白率增加,在其分别大于60min、13∶1和0.22%后,相应的去蛋白率保持稳定或增加缓慢,所以选定60min、13∶1和0.22%为相应量的最佳值.在上述最佳工艺条件下,IDF去蛋白率为67.42%,高于文献[2]报道的一次酶法去蛋白率,这可能和酶来源及工艺条件等因素有关.
2.5 不溶性膳食纤维的微观结构
由于所提取压粕果胶的纯度最高,为进一步比较压粕提取DF的微观结构差异,用扫描电镜对甜菜压粕、提果胶后压粕IDF、灭活酶处理提果胶后压粕IDF、去蛋白压粕IDF的微观结构进行观察,所得结果分别如图5所示.
由图5可知,甜菜压粕呈现孔状骨架结构.压粕提果胶前,骨架结构的表面会覆盖一些颗粒类物质,孔内也会充填一些小颗粒,见图5(a).压粕提果胶后,骨架结构出现一定程度受损但更为光洁,孔内填充小颗粒消失,这说明孔状骨架结构表面覆盖和孔内填充颗粒物可能为果胶,类似“游离水”,与骨架结构无结合或结合不紧密,见图5(a)和(b);作为对照,用SEM分析灭活酶处理提果胶后压粕IDF,发现IDF孔状骨架结构更完整,这说明蛋白类似“结合水”,失活酶蛋白和IDF存在相互作用,IDF结合更多蛋白有助于骨架结构完整,见图5(b)和(c);压粕IDF去蛋白后,孔状骨架结构的空隙变宽,出现层状骨架结构,但没有对照样的骨架结构完整,说明存在IDF去蛋白现象,见图5(b)、(c)和(d).但部分蛋白与残渣结合紧密不易脱除,蛋白部分与半纤维素结合,且酶法去蛋白反应条件温和,对纤维素结晶区渗透不充分,对半纤维素影响不大,因此IDF一次酶法去蛋白不完全[2].
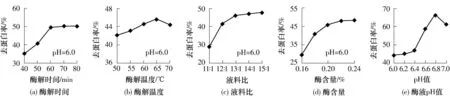
图4 工艺条件对不溶性膳食纤维的酶法去蛋白率的影响Fig.4 Effect of operating conditions on the protein removal rate of insoluble dietary fibre
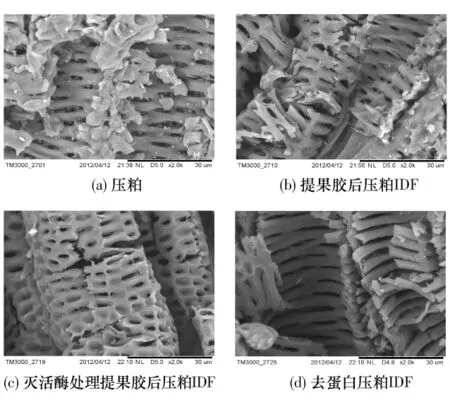
图5 压粕及其IDF的SEM照片Fig.5 SEM photos of pressed beet pulp and its IDFs
3 结论
(1)优化了甜菜湿粕、压粕和颗粒粕3种原料的酸溶醇析法提取果胶工艺条件,最佳条件下颗粒粕提取果胶得率和纯度之积最大,湿粕果胶得率最高,其纯度最低但与颗粒粕接近,压粕果胶得率最低但纯度最高;为保证果胶得率,保留部分功能性制糖色素,所用甜菜粕最好是湿粕,且可不经过稀酸浸泡或温水漂洗预处理,直接用于果胶提取.
(2)酸溶醇析法提取甜菜果胶时,果胶提取液分为悬浮层和沉淀层,均由3种相对分子质量级分组成;相对沉淀层而言,悬浮层色泽浅,密度小,相对分子质量大的级分比例大,黏度高.
(3)IDF酶法去蛋白的最佳工艺条件为:时间60min,液料比 13∶1,温度 65℃,酶含量 0.22%,酶液pH6.8,此时IDF去蛋白率为67.42%.甜菜粕提取果胶后,压粕孔状骨架结构更光洁,覆盖骨架或填充孔隙的颗粒物消失;失活酶蛋白对IDF骨架结构有稳定作用,但脱蛋白处理使骨架结构孔隙增大,呈现层状骨架结构.
[1] Aksu Z,Isoglu I A.Use of dried sugar beet pulp for binary biosorption of Gemazol Turquoise Blue-G reactive dye and copper(Ⅱ)ions:equilibrium modeling[J].Chemical Engineering Journal,2007,127(1/2/3):177-188.
[2] 龚冉.甜菜废粕中膳食纤维的提取及其改性的研究[D].乌鲁木齐:新疆农业大学动物科学学院,2004:25-32.
[3] Mata Y N,Blazquez M L,Ballester A.Optimization of the continuous biosorption of copper with sugar-beet pectin gels[J].Journal of Environmental Management,2009,90(5):1737-1743.
[4] Leontowicz M,Gorinstein S,Bartnikowska E,et al.Sugar beet pulp and apple pomace dietary fibers improve lipid metabolism in rats fed cholesterol[J].Food Chemistry,2001,72(1):73-78.
[5] Levigne S,Ralet M C,Thibault J F.Characterization of pectins extracted from fresh sugar beet under different conditions using an experimental design [J].Carbohydrate Polymers,2002,49(2):145-153.
[6] Yapo B M,Wathelet B,Paquot M.Comparison of alcohol precipitation and membrane filtration effects on sugar beet pulp pectin chemical features and surface properties[J].Food Hydrocolloids,2007,21(2):245-255.
[7] Phatak L,Chang K C,Brown G.Isolation and characterization of pectin in sugar-beet pulp [J].Journal of Food Science,1988,53(3):830-833.
[8] Yapo B M,Robert C,Etienne I,et al.Effect of extraction conditions on the yield,purity and surface properties of sugar beet pulp pectin extracts [J].Food Chemistry,2007,100(4):1356-1364.
[9] Kintner P K,van Bure J P.Carbohydrate interference and its correction in pectin analysis using the m-hydroxyl diphenyl method [J].Journal of Food Science,1982,47(3):756-759.
[10] 陈毓荃.生物化学实验方法和技术[M].北京:科学出版社,2002:95-97.
[11] Michael Saska,Chung Chi Chou.Antioxidant properties of sugarcane extracts [J].Journal of South China University of Technology:Natural Science Edition,2009,37(10):108-111.Michael Saska,Chung Chi Chou.甘蔗提取物的抗氧化性能[J].华南理工大学学报:自然科学版,2009,37(10):108-111.
[12] Arslan N.Extraction of pectin from sugar-beet pulp and intrinsic viscosity-molecular weight relationship of pectin solutions[J].Journal of Food Science and Technology,1995,32(3):381-385.
[13] Turquois T,Rinaudo M,Taravel F R,et al.Extraction of highly gelling pectin substances from sugar beet pulp and potato pulp:influence of extrinsic parameters on their gelling properties [J].Food Hydrocolloids,1999,13(3):255-262.
[14] Arslan N,Kar F.Filtration of sugar-beet pulp pectin extract and flow properties of pectin solutions[J].Journal of Food Engineering,1998,36(1):113-122.
[15] 郑建仙.功能性食品[M].北京:中国轻工业出版社,1997:9-73.

