冻藏对面筋蛋白二级结构的影响*
刘国琴 阎乃珺 赵雷 李冰 李琳 杨晓泉
(华南理工大学轻工与食品学院,广东广州510640)
目前市面上冷冻食品销量越来越大,其中冷冻面制品在冷冻食品中的比例占40%以上[1].大量研究表明,冷冻面筋蛋白的品质对最终的冷冻面制品的质量有重要影响[2].而面筋蛋白在冷冻贮藏过程中,由于水分的重新分配和重结晶,导致了冰晶的形成和长大,这会挤压面筋蛋白的基质或肌纤维结构,弱化面筋蛋白的网络结构,影响面制食品的最终品质[3].蛋白质的结构包括一级结构、二级结构、超二级结构、结构域、三级结构和四级结构等结构层次[4-6].蛋白质的二级结构与功能之间存在着紧密的联系[7],其结构的变化会影响最终产品的质构特性.因此研究在冻藏过程中面筋蛋白的二级结构的变化对分析冻藏过程面团和最终产品的品质变化有十分重要的指导意义.
目前,蛋白质结构分析的常用方法各有其局限性.核磁共振技术只能测定小分子蛋白质的结构;荧光和紫外光谱只能测定少数带有发色团的氨基酸残基(Trp、Tyr等)的蛋白质结构[8];蛋白质在红外区有若干特征吸收带,酰胺Ⅰ带(1600~1700cm-1)对于研究二级结构最有价值,而H2O在1640 cm-1附近的影响可以采用吹扫、差减及氘代等方法消除,但都不能达到十分满意的效果.近年来,圆二色光谱(CD)法的出现解决了研究蛋白质二级结构的困难,CD法可以灵敏地反映出蛋白质构象的变化,具有很强的优越性,已被广泛应用于蛋白质的构象研究[9-13].圆二色的产生是由光学活性物质对左右圆偏振光的吸光率之差引起的[14].蛋白质或多肽是由氨基酸通过肽键连接而成的、具有特定结构的生物大分子,其圆二色性主要是活性生色基团及折叠结构两方面圆二色性的总和.
本研究采用CD分析不同冻藏模式和冻藏时间对面筋蛋白二级结构的影响,以期得到其对面筋蛋白二级结构的影响规律及对面筋蛋白微观结构的作用机制,为研究冷冻面团质量对最终产品品质的影响奠定基础.
1 材料与方法
1.1 材料与试剂
主要材料和试剂如下:加拿大硬红冬麦粉,南方面粉有限公司提供;十二烷基硫酸钠(SDS)、磷酸氢二钠、磷酸二氢钠、氯化钠均为分析纯;纯净水用Sartorius611超纯水系统自制.
1.2 仪器与设备
主要仪器和设备如下:JJJM54S型面筋洗涤仪,上海嘉定粮油仪器有限公司生产;Wizard2.0型真空冷冻干燥机,英国VirTis公司生产;FW100型高速万能粉碎机,天津市泰斯特仪器有限公司生产;ULT1386-5-V39型超低温冰箱,美国Revco公司生产;BCD-245型冰箱,博西华家用电器有限公司生产;Kjeltec2300型半自动凯式定氮仪,FOSS公司生产;85-2型恒温磁力搅拌器,常州澳华仪器有限公司生产;Sigma3K30型超高速冷冻离心机,博劢行仪器有限公司生产;MOS450型圆二色谱(CD)仪,法国BIO LOGIC公司生产.
1.3 实验方法
1.3.1 湿面筋蛋白的制备和冷冻处理
准确称取10.0g小麦面粉缓慢倒入面筋洗涤仪的洗涤杯中,按动面筋洗涤按扭,开始和面与洗涤,洗涤分为两次,第1次采用5%的氯化钠溶液去除淀粉和球蛋白,第2次采用蒸馏水去除氯化钠和清蛋白.整个和面以及洗涤过程在10min内完成.洗涤完成后,小心取出面筋洗涤杯(不要让面筋遗留在搅拌轴上).将湿面筋蛋白在60000g的转速下离心10min,将水分含量控制在(60±1)%,如果水分含量低于55%,样品可能不均一,而水分含量高于65%会产生明显的缩水现象[15].
用镊子取出面筋放入超低温冰箱进行速冻,将速冻后的样品转移至特制的铝盒中,然后放置于温度可控的冰箱中冻藏,温度控制在(-18±1)℃.取其中一部分作为恒温冻藏的样品,在0、30、60、90和120 d分别取样.另一部分为冻融的样品,以10 d作为一个冻融的周期,将样品再升温至0℃,并在此温度下保持12h后降温至 -18℃冻藏;如此往复,在0、30、60、90和120d分别取样.对所取样品进行冷冻干燥,并将冻干后的面筋蛋白磨碎,过120目筛,备用.
1.3.2 面筋蛋白SDS溶液的配制
根据文献[16]中的结论,将冻藏和冻干处理后的面筋蛋白的测量分为易溶于SDS的部分和难溶于SDS的部分.
对于易溶部分,在漩涡振荡器的辅助下,将面筋蛋白缓慢地加入1%SDS(pH=7.0)的磷酸盐缓冲溶液,待完全加入后进一步搅拌10 min,超声15 s后,于12000 r/min离心20 min,取其上清液作为易溶部分.
对于难溶部分,将不溶的蛋白取出,加入到相同的溶剂中进一步溶解24 h,于12000 r/min离心20min,取其上清液作为难溶部分.
根据可溶蛋白的计算方法:可溶蛋白含量=总蛋白含量-不溶蛋白含量,可得易溶和难溶部分占面筋蛋白质的比例分别为(66.8±0.03)%和(14.2 ±0.04)%.
1.3.3 面筋蛋白二级结构的测定
将溶液稀释到蛋白质质量浓度为0.1g/L,采用MOS450CD仪在190~250 nm之间扫描,实验温度为20℃,样品池光程为2mm,灵敏度为100mdeg/cm,实验值为8次扫描的均值[17].利用CD仪测定面筋蛋白的二级结构,采用曲线拟合软件Selcon3[18-19]计算面筋蛋白的二级结构中α螺旋、β折叠、β转角和无规则卷曲的相对含量.
2 结果与分析
2.1 冻藏模式和冻藏时间对面筋蛋白圆二色光谱的影响
图1给出了不同冻藏模式和冻藏时间时SDS溶液中面筋蛋白的远紫外(UV)圆二色谱图.可以看出,不同冻藏模式和冻藏时间对面筋蛋白圆二色谱的影响程度不同.对照组中,易溶部分和难溶部分在195nm处均有一显著正峰,212 nm处有一较宽的负峰,这表明在SDS溶液中未经冻藏的面筋蛋白二级结构主要是β折叠和无规则卷曲.
与对照相比,经过恒温冻藏处理的面筋蛋白的CD谱线、谱峰峰位发生不同程度的变化.根据远紫外CD光谱的谱带特征[20],其中样品易溶部分在191nm处的峰位变化为:恒温冻藏90 d红移1 nm,恒温冻藏30、60、120 d谱峰消失;在208 nm处峰位变化为:冻藏90 d蓝移1 nm,恒温冻藏30、60、120 d谱峰消失.难溶部分在191 nm处的峰位变化为:恒温冻藏90 d出现肩峰,恒温冻藏30、60、120 d变化不明显;在206nm处峰位均发生红移,幅度在1~3nm之间,其中恒温冻藏90d的幅度最大,为3nm.

图1 不同冻藏模式和冻藏时间时SDS溶液中面筋蛋白的远紫外色谱图Fig.1 Far-UV spectra of gluten protein in SDS solution with different frozen storage modes in different frozen storage time
冻融冻藏模式下不同冻藏时间面筋蛋白的远紫外圆二色谱图显示,不同冻藏时间对面筋蛋白的圆二色谱的影响程度不同.与对照相比,样品易溶部分在191nm处峰位均发生了不同程度的红移,幅度在2~3nm之间,其中冻融冻藏60 d红移幅度最大为3nm;在208nm处峰位变化为:冻融冻藏60 d蓝移2nm,冻融冻藏30、90、120 d谱峰消失;冻融冻藏样品在212nm处均出现了较宽的谱峰.这是α螺旋特征谱峰消失,无规则卷曲谱峰出现的表征.难溶部分在冻藏60 d时由206 nm处的峰位红移2 nm到达208nm处,冻藏30、90、120d时206nm处的谱峰消失.
由上述分析可知,在恒温冻藏模式冻藏90 d时,谱峰的位移比较明显,而冻融模式下冻藏60 d时,谱峰的位移比较明显.而峰高变化没有规律性,这有待进一步研究.
2.2 恒温冻藏模式对面筋蛋白二级结构的影响
采用曲线拟合软件Selcon3[18-19]计算恒温冻藏模式下不同冻藏时间面筋蛋白的二级结构含量,结果见表1、2.分析可知,易溶部分对照组中,面筋蛋白二级结构主要是β折叠和无规则卷曲,分别占21.3%和44.7%.随着冻藏时间的延长面筋蛋白的二级结构含量在一定范围内发生了变化.冻藏初期各二级结构的变化不明显,冻藏90 d时发生显著变化.其中α螺旋含量减少了10个百分点,β折叠和β转角分别增加了7.9和1.9个百分点,无规则卷曲增加了0.1个百分点.难溶部分对照组中,主要的面筋蛋白二级结构也是β折叠和无规则卷曲,其含量分别为35.2%和42.5%.与对照相比,冻藏90d时发生显著变化:α螺旋含量增加了10.7个百分点,β折叠和β转角分别减少了12.6和1.4个百分点,无规则卷曲增加了3.2个百分点.
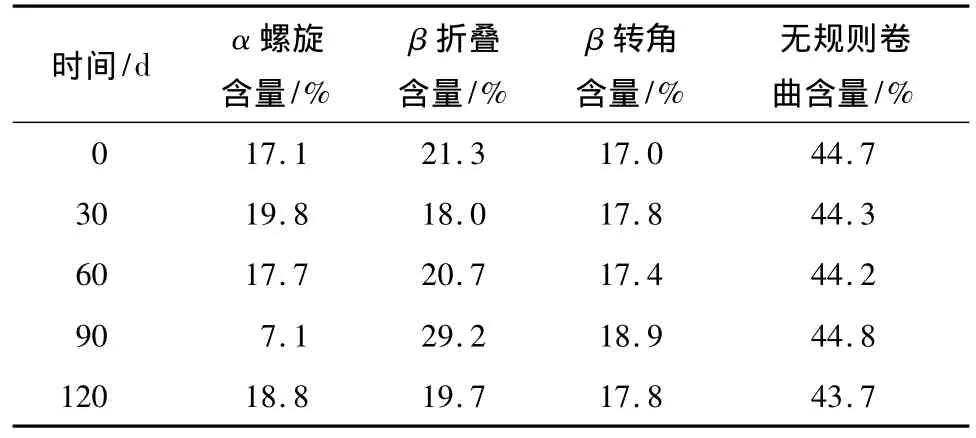
表1 恒温冻藏模式下不同冻藏时间SDS溶液中面筋蛋白易溶部分的二级结构含量Table 1 Secondary structure content of the soluble part of gluten protein in SDS solution with different frozen storage time in thermostatic frozen storage mode

表2 恒温冻藏模式下不同冻藏时间SDS溶液中面筋蛋白难溶部分的二级结构含量Table 2 Secondary structure content of the insoluble part of gluten protein in SDS solution with different frozen storage time in thermostatic frozen storage mode
综上所述,在恒温冻藏模式下,冻藏时间小于90d时,冻藏对面筋蛋白影响较小,只有当冻藏时间达到90d时,面筋蛋白的二级结构才发生显著变化:易溶部分面筋蛋白中,部分α螺旋转化为β折叠和β转角;难溶部分面筋蛋白中,部分β折叠和β转角转化为α螺旋和无规则卷曲.冻藏120 d时各二级结构的含量有恢复至初始含量的趋势,这有待进一步研究.
2.3 冻融冻藏模式对面筋蛋白二级结构的影响
采用曲线拟合软件Selcon3[18-19]计算冻融冻藏模式下不同冻藏时间面筋蛋白的二级结构含量,结果见表3、4.分析可知,冻藏30d时各二级结构含量开始发生变化,易溶部分冻藏60 d时变化最显著.与对照相比,易溶部分在冻藏60 d时α螺旋含量降幅最大,达到3.2个百分点,β折叠增加了0.2个百分点,β转角没有变化,无规则卷曲增加了3.0个百分点.难溶部分在冻藏30d时变化较为显著,其中α螺旋含量增幅最大,达到10.8个百分点,β折叠和β转角分别减少了13.7和1.5个百分点,无规则卷曲增加了4.4个百分点.

表3 冻融冻藏模式下不同冻藏时间SDS溶液中面筋蛋白易溶部分的二级结构含量Table 3 Secondary structure content of the soluble part of gluten protein in SDS solution with different frozen storage time in freeze-thaw storage mode

表4 冻融冻藏模式下不同冻藏时间SDS溶液中面筋蛋白难溶部分的二级结构含量Table 4 Secondary structure content of the insoluble part of gluten protein in SDS solution with different frozen storage time in freeze-thaw storage mode
综上所述,在冻融冻藏模式下,易溶部分在冻藏时间达到60 d时,面筋蛋白的二级结构就发生了显著的变化:部分α螺旋转化为β折叠和无规则卷曲.而难溶部分在冻藏30 d时面筋蛋白二级结构发生了显著的变化:部分β折叠和β转角转化为α螺旋和无规则卷曲.由于面筋蛋白中易溶部分占(66.8±0.03)%,因此面筋蛋白在冻融冻藏60 d时表现出主要变化,这与2.1中冻融冻藏60 d时谱峰变化明显相一致.冻藏后期各二级结构含量也有恢复至初始含量的趋势,这有待进一步研究.
3 结论
在SDS磷酸盐缓冲液中,采用CD分析不同冻藏模式和冻藏时间对面筋蛋白二级结构的影响,发现未经冻藏的面筋蛋白二级结构主要由β折叠和无规则卷曲组成.与对照相比,在恒温冻藏模式下,当冻藏时间达到90 d时,面筋蛋白二级结构才发生显著变化;而在冻融冻藏模式下,当冻藏时间达到60 d时,其二级结构就发生了显著变化.这说明无论是恒温模式还是冻融模式,当冻藏时间小于60 d时,冻藏基本上对面筋蛋白的二级结构没有影响,冻藏是一种非常好的贮藏面团的方法;与恒温模式相比,冻融模式明显缩短了面团的货架期.
[1] 赵雷,李琳,李冰,等.GPC-MALLS联用测定面筋蛋白分子量及其分布在冻藏过程中的变化[C]∥2010年中国农业工程学会农产品加工及贮藏工程分会学术年会暨华南地区农产品加工产学研研讨会论文摘要集.北京:中国农业工程学会,2010.
[2] 王怡然,王金水,赵谋明,等.小麦面筋蛋白的组成、结构和特性[J].食品工业科技,2007,28(10):228-231.Wang Yi-ran,Wang Jin-shui,Zhao Mou-ming,et al.The composition,structure and properties of wheat gluten[J].Science and Technology of Food Industry,2007,28(10):228-231.
[3] 宋国胜,胡松青,李琳.超声辅助冷冻对湿面筋蛋白中冰晶粒度分布及总水含量的影响[J].化工学报,2009,60(4):978-983.Song Guo-sheng,Hu Song-qing,Li Lin.Effects of ultrasound-assisted freezing on total water content and ice crystals size distribution in frozen wet gluten [J].CIESC Journal,2009,60(4):978-983.
[4] Evelina G Ferrer,Analía V Gómez,María C Anón,et al.Structural changes in gluten protein structure after addition of emulsifier.a Raman spectroscopy study[J].Spectrochimica Acta Part A,2011,79(1):278-281.
[5] Andrea Balan,Carolina Santacruz-Pérez,Alexandre Moutran,et al.Crystallographic structure and substrate-binding interactions of the molybdate-binding protein of the phytopathogen Xanthomonas axonopodis pv.citri[J].Biochimica et Biophysica Acta,2008,1784(2):393-399.
[6] Petras J Kundrotas,Emil Alexov.Predicting 3D structures of transient protein-protein complexes by homology[J].Biochimica et Biophysica Acta,2006,1764(9):1498-1511.
[7] 蔡燕,方云,夏咏梅.大豆脂氧酶的热失活动力学与其二级结构的圆二色谱表现[J].大豆科学,2011,30(1):150-152.Cai Yan,Fang Yun,Xia Yong-mei.Thermal inactivation of soybean lipoxygenase and its secondary structure performance of circular dichrosim specctroscopy[J].Soybean Science,2011,30(1):150-152.
[8] 宋国胜,胡娟,沈兴,等.超声辅助冷冻对面筋蛋白二级结构的影响[J].现代食品科技,2009,25(8):860-864.Song Guo-sheng,Hu Juan,Shen Xing,et al.Effects of ultrasound-assisted freeze on secondary structure of gluten protein[J].Modern Food Science and Technology,2009,25(8):860-864.
[9] Wallace B A,Janes W.Synchrotron radiation circular dichroism spectroscopy of proteins:secondary structure,fold recognition and structural genomics[J].Current Opinion in Chemical Biology,2001,5(5):567-571.
[10] Vincent Raussens,Jean-Marie Ruysschaert,Erik Goormaghtigh.Protein concentration is not an absolute prerequisite for the determination of secondary structure from circular dichroism spectra:a new scaling method[J].Analytical Biochemistry,2003,319(1):114-121.
[11] Sergey Y Tetin,Franklyn G Prendergast,Sergei Yu Venyaminov.Accuracy of protein secondary structure determination from circular dichroism spectra based on immunoglobulin examples [J].AnalyticalBiochemistry,2003,321(2):183-187.
[12] Sharon M Kelly,Thomas J Jess,Nicholas C Price.How to study proteins by circular dichroism [J].Biochimica et Biophysica Acta,2005,1751(2):119-139.
[13] Timothy A Keiderling.Protein and peptide secondary structure and conformational determination with vibrational circular dichroism [J].Current Opinion in Chemical Biology,2002,6(5):682-688.
[14] 段蕊,叶超,邢芳芳,等.采用圆二色谱法研究冬夏鲢鱼鳞胶原蛋白的稳定性[J].食品与发酵工业,2010,36(1):73-76.Duan Rui,Ye Chao,Xing Fang-fang,et al.Comparison on stability of scale collagens from silver carp(Hypophtha inichys molitrix)by circular dichroism [J].Food and Fermentation Industries,2010,36(1):73-76.
[15] 赵雷,刘国琴,李琳,等.超声对小麦湿面筋蛋白粘弹性模量和蠕变恢复性能的影响[J].河南工业大学学报:自然科学版,2007,28(5):5-9.Zhao Lei,Liu Guo-qin,Li Lin,et al.Effect on ultrasonic treatment on viscoelstecity module and creep-recovery properties of wet gluten protein [J].Journal of Henan University of Technology:Natural Science Edition,2007,28(5):5-9.
[16] Bean S R,Lookhart G L.Factors influencing the characterization of gluten proteins by size-exclusion chromatography and multiangle laser light scattering(SECMALLS)[J].Cereal Chemistry,2001,78(5):608-618.
[17] 尹寿伟,唐传核,温其标,等.微射流处理对芸豆分离蛋白构象和功能特性的影响[J].华南理工大学学报:自然科学版,2009,37(10):112-116.Yin Shou-wei,Tang Chuan-he,Wen Qi-biao,et al.Effect of micro-fluidization treatment on conformational and functional properties of kidney bean(Phaseolus vulgaris L)protein isolates[J].Journal of South China University of Technology:Natural Science Edition,2009,37(10):112-116.
[18] Yee Hsiung Chen,Jen Tsi Yang,Kue Hung Chau.Determination of the helix and β form of proteins in aqueous solution by circular dichroism [J].Biochemistry,1974,13(16):3350-3359.
[19] Sreerama H,Venyaminov S Y,Woody R W.Estimation of protein secondary structure from circular dichroism spectra:inclusion of denatured proteins with native proteins in the analysis[J].Analytical Biochemistry,2000,287(2):243-251.
[20] 沈琼,黄滨,邵嘉亮,等.运用圆二色谱研究酶与化合物相互作用的机理[J].中山大学学报:自然科学版,2006,45(4):62-64.Shen Qiong,Huang Bin,Shao Jia-liang,et al.Mechanism discussion of interaction between enzyme and several compounds with circular dichroism method[J].Acta Scientiarum Naturalium Universitatis Sunyatseni,2006,45(4):62-64.

