不同温度热解酸化蔗糖制备低聚焦糖*
王军 王忠合 薛晓丽 于淑娟
(华南理工大学轻工与食品学院,广东广州510640)
焦糖色素作为食品添加剂已被广泛应用于饮料、啤酒、酱油等领域[1],控制蔗糖的热处理温度、添加柠檬酸等有机酸催化剂,是大规模生产焦糖色素采用的最原始工艺.低聚焦糖(STOC)是在此工艺基础上得到的新型产品,是指用加热法从蔗糖降解合成的果糖低聚糖、蔗果三糖混合物,含有所有天然的蔗果三糖和3种新的α-果糖异构物[2].STOC具有焦糖色素的特性,国外用于酒精类饮料和软饮料着色,是天然色素添加剂和食品添加剂[3],还具有促进双歧杆菌增殖、预防和治疗痢疾等功能特性[4].
酸化蔗糖经加热后,加入氨水提供氨基,后经乙醇脱水、萃取分离,干燥得 STOC[5].STOC 含有 D-果糖、D-葡萄糖,是高支化和低相对分子质量物质[6].STOC的聚丙烯酰胺分离分析结果显示,其相对分子质量范围为162~5000,聚合度为1~31,葡聚糖分离分析结果显示,其聚合度为 25[7].目前,STOC制备工艺复杂且耗时长,产物得率及含量不稳定.因此,在STOC制备工艺和产物分离及其稳定性等方面有待深入研究.
STOC具有快速治疗痢疾的功能,并可预防痢疾的复发[8].Orban 等[9]的研究表明,STOC 有促进双歧杆菌增殖功能,并可作为抗生素替代品用于动物饲料中.但对STOC抗氧化特性的研究鲜见报道.
本研究以蔗糖为原料,热解酸化蔗糖制备STOC,在原有工艺基础上,探讨新工艺的可行性,并分析了不同温度制备的STOC的色度、总糖、还原糖含量、抗氧化特性、主要成分及其稳定性,以期为STOC作为新型功能性食品添加剂在实际生产中的应用提供依据.
1 主要材料及仪器
1.1 主要材料
主要材料如下:食品级无水蔗糖,大佳食品有限公司生产;食品级无水柠檬酸,广州冠球化工有限公司生产;氨水、氢氧化钠、无水乙醇、无水葡萄糖、蔗糖、苯酚、浓硫酸、3,5-二硝基水杨酸(DNS)、丙三醇,均为化学纯或分析纯;1-蔗果三糖、D-果糖、乙二胺四乙酸钙(EDTA-Ca)、1,1-二苯基-2-三硝基苯肼(DPPH),美国Sigma公司生产.
1.2 仪器设备
主要仪器设备如下:XA-1型高能粉碎机,姜堰市银河实验仪器厂生产;RE-2000A型旋转蒸发仪,上海亚荣生化仪器厂生产;DZF-6020A型真空干燥箱,上海一恒科学仪器有限公司生产;Scientz-18N型冷冻干燥机,宁波新芝生物科技有限公司生产;UV1810型紫外可见分光光度计,北京普析通用仪器有限责任公司生产;CR22GII型高速冷冻离心机,日本日立公司生产;4597型高压反应釜,美国PARR公司生产;WAY-Z型自动阿贝折射仪,上海精密科学仪器有限公司生产;MeterLab pHM250型pH计,美国哈希公司生产;Waters 600型高效液相色谱仪、Waters 2414型示差检测器、Sugar-pak1型色谱柱,美国Waters公司生产;Pyris1 TGA型热重分析仪、Clarus 600型气相色谱-质谱联用仪、Elite-1701型毛细管柱,美国PerkinElmer公司生产.
2 实验方法
2.1 低聚焦糖的制备
精确称取一定量无水蔗糖和无水柠檬酸(酸用量为总量1%),粉碎至细度为50目左右,按照料液比3∶2加蒸馏水溶解,放置于真空干燥箱(≤40℃、0.1MPa)除去95% ~98%的水分,作为原料备用[10].
干法(传统)工艺:取上述原料6.000 g于密闭容器中,不同温度下(100、120、140、160、180 ℃)于真空干燥箱中反应60min,取出立即冷却至玻璃态,逐滴滴加0.1mol/L氨水至完全溶解,添加无水乙醇至醇含量为95%,搅拌均匀放置冰箱冷冻过夜[5].
湿法工艺:取原料6.000 g,添加与干法同量氨水溶解,不同温度(100、120、140、160、180 ℃)于高压反应釜中反应60 min,取出反应液,添加乙醇,后同干法操作.
冷冻过夜后的溶液于4℃、9000 r/min离心10min,取上清液旋转蒸发(≤40℃)浓缩至15 mL,经阿贝折光仪测得锤度为50~80 Brx,经冷冻干燥得质量分数为30%~70%的、分别由两种工艺制备的黄色至褐色粉末状STOC.
2.2 pH值的测定
反应过程中伴随pH值的变化,检测不同温度所得产品pH变化趋势可判断反应的强度及变化趋势.称取STOC样品,配制质量分数为1%的溶液,用pHM 250型pH计测定样品的pH值.
2.3 特征吸收和色度的测定
STOC生成过程中伴随着有色物质的生成,具有特征吸收(294nm)及色度(420 nm)的变化.测定质量分数为1%的STOC溶液在294nm和420nm处的吸光度[11],为便于比较两种工艺,对超出测定范围的样品用蒸馏水稀释后进行测定,并计算吸光度.
2.4 总糖和还原糖含量的测定
采用苯酚-硫酸法测定总糖含量;采用DNS法测定还原糖含量[12].
2.5 抗氧化能力测定
取2 mL质量分数为1‰的 STOC溶液,加入2mL 1,1-二苯基-2-三硝基苯肼溶液,室温下避光反应30min,517 nm下测定值为Di;空白组为2 mL无水乙醇与2 mL STOC混合,测定值为Dj;对照组为2mL DPPH与2 mL蒸馏水混合,测定值为D0;无水乙醇作为空白调零.清除率(K)按以下公式计算[13]:
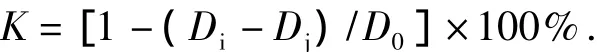
2.6 低聚焦糖的液相色谱分析
高效液相色谱(HPLC)条件:检测器为Waters 2414型示差检测器;色谱柱为Sugar-pak1(6.5mm×300mm);柱温为90℃;进样量为20 μL;流动相为50mg/L的EDTA-Ca水溶液;流速为0.5mL/min;运行时间为30min.
取不同温度制备的质量分数为1‰的STOC样品,过0.45μm微孔水系滤膜,经HPLC分析成分.
2.7 低聚焦糖的Py-GC-MS分析
热重分析仪(TGA)热裂解条件:取固体样品1~8mg,加入中空小石英管后,放置裂解探针中,以升温速率100℃/min从室温升到800℃.
气相色谱(GC)条件:采用Elite-1701毛细管柱(30 m ×0.25 mm ×0.25 μm);载气 He纯度为99.999%,进样口温度为210℃;压力为0.11Pa.升温程序:初始温度35℃,保持5min,以5℃/min升温至100℃,然后以20℃/min升温至260℃,并保持10min.
质谱(MS)条件:采用电子轰击离子源(EI),电离能量为70 eV,离子源温度为230℃,质量扫描范围(m/z)为45~300,采用全扫描(SCAN)工作方式.
2.8 数据处理
平行测定3次,数据以平均值±标准偏差表示,采用SPSS 17.0软件进行差异显著性分析(P<0.05).
3 结果与分析
3.1 低聚焦糖pH值的变化
不同反应温度制备的STOC的pH值见图1.干法工艺制备STOC时,随着温度的升高,pH值的变化趋势是先升高后缓慢降低.原因是[10]:在温度为100、120、140℃时,以酸催化蔗糖反应进程为主,柠檬酸逐渐被消耗,使pH值升高;140℃时反应较为剧烈,pH值为4.63;140℃之后,除了酸催化蔗糖反应外,可能存在反应产物的降解聚合反应,使pH值缓慢地降低,但降低得并不明显.湿法工艺制备STOC时,随着反应温度的升高,pH值逐渐降低.原因可能是:在水相体系中,焦糖化反应生成了部分酸性物质[14].

图1 反应温度对制备的STOC的pH值的影响Fig.1 Effects of reaction temperature on pH value of STOC a、b、c、b'、c'表示差异显著(P <0.05)
3.2 低聚焦糖的特征吸收和褐变程度
不同反应温度制备STOC的特征吸收(294 nm处)和褐变程度(420nm处)如图2所示.干法工艺制备STOC时,随着温度的升高,产物的特征吸收和褐变程度均上升,温度越高,294nm和420nm处的吸光值D(294)及D(420)上升得越快.温度为180℃时,D(294)及D(420)分别为1.819和1.208.上述结果表明,干法工艺制备STOC时,酸催化蔗糖反应与反应温度呈正相关.此外,反应产生色素类物质,温度越高,生成的色素类物质越多,褐变程度增加.湿法工艺制备STOC时,在反应温度不高于160℃时,产物的特征吸收和褐变程度呈较快上升趋势,160℃时,吸光值分别为3.151和2.128,160℃之后,D(294)及D(420)急剧降低,180℃时,吸光值分别为0.978和0.127.原因是:温度较高时,发生碳化作用和聚合反应,生成不溶于水的树脂化物质,或中间物进一步反应生成大分子化合物,使溶于乙醇中的低相对分子质量物质、色素等各种成分不再增加或减少,从而影响吸光值[15].

图2 反应温度对制备的STOC的特征吸收和褐变程度的影响Fig.2 Effects of reaction temperature on characteristic absorption and browning of STOC
3.3 低聚焦糖总糖和还原糖含量
不同反应温度制备的STOC的总糖和还原糖含量的变化如图3所示.随着反应温度的升高,干法和湿法工艺制备的STOC总糖含量减小,反应温度越高,糖消耗得越快;还原糖含量先上升后下降.原因可能是:随着反应的进行,蔗糖被消耗,同时伴随着蔗糖的降解聚合,生成部分单糖、低聚糖,如葡萄糖、果糖、蔗糖、蔗果三糖及其异构物等,随着糖的降解聚合反应的进行,非还原糖类(蔗糖、蔗果三糖等)和还原糖类(葡萄糖、果糖等)的生成和含量是不断变化的[16].
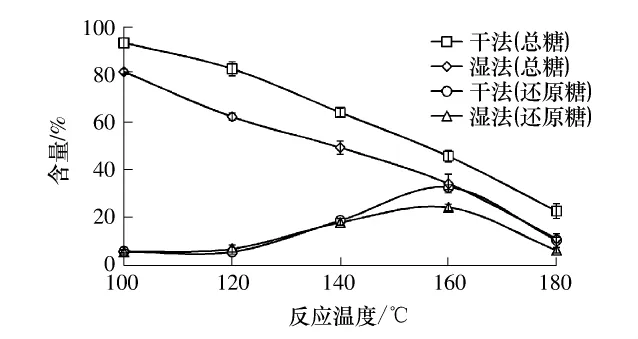
图3 反应温度对制备的STOC的总糖和还原糖含量的影响Fig.3 Effects of reaction temperature on total and reducing sugar contents of STOC
3.4 低聚焦糖的抗氧化能力
不同反应温度制备的STOC的清除DPPH能力如图4所示.随着反应温度的升高,干法和湿法工艺制备的STOC的DPPH清除能力增强.干法工艺制备STOC,温度小于120℃时,清除自由基能力增加缓慢,120℃之后,随着温度升高,清除自由基能力增强.原因是:较低温度时,酸催化蔗糖反应较弱,生成的单糖、低聚糖及活性色素类物质较少.湿法工艺制备STOC,温度小于140℃时,产物清除DPPH的能力得到较快的增强,之后缓慢增强.原因是:反应温度较高时,发生碳化作用和聚合反应,生成不溶于水的树脂化物质,或中间物进一步反应生成大分子化合物,使溶于乙醇中的低相对分子质量活性成分不再增加或减少[15];此外,干法反应的蔗糖碳化温度低于湿法反应.
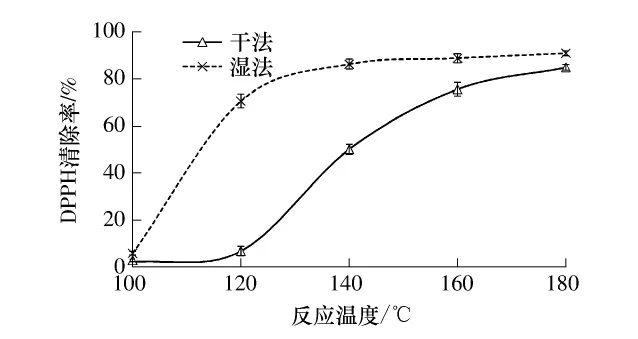
图4 反应温度对制备的STOC的清除DPPH自由基能力的影响Fig.4 Effects of reaction temperature on DPPH radical scavenging capacity of STOC
3.5 低聚焦糖的组分

图5 STOC糖组分的HPLC分析Fig.5 HPLC analysis of sugars in STOC
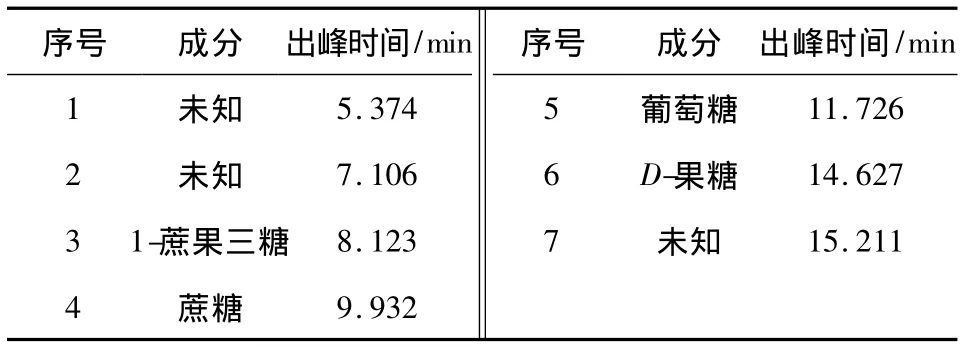
表1 STOC主要成分分析Table 1 Component analysis of STOC
STOC糖组分的HPLC分析结果见图5和表1.以1-蔗果三糖、萄萄糖、果糖、蔗糖为对照确定各成分保留时间.STOC含有的单糖有葡萄糖、D-果糖,双糖有蔗糖,三糖有蔗果三糖.表1中1、2、7为未知糖类.七糖及以上聚合度的低聚糖在水中的溶解度很小或不溶,且不能和六糖分开,推断1可能是六糖及以上聚合度低聚糖.出峰时间在5.374~8.123min的成分可能是蔗果四糖、蔗果五糖(较高温度时)[17].
3.6 低聚焦糖热稳定性
两种工艺制备STOC的热裂解失重和主要产物基本相同,仅以干法工艺为例进行说明.STOC裂解产物相对含量随温度变化曲线(失重曲线)和热裂解主要产物分别见图6和表2.在氮气下,STOC的热裂解有明显的失重现象,在100~500℃范围内尤其明显;500℃以后,裂解缓慢.不同温度(100、140、180℃)制备的 STOC的失重曲线发展趋势相似,100℃时STOC的最大失重温度约在280℃,随着制备温度的升高,最大失重温度提前;且100~500℃范围内,随着温度的升高失重速率增大.由表2可见,STOC热裂解产物主要有呋喃、呋喃酮、吡唑、吡咯烷、醛、烯和酸酐类.不同温度制备的STOC的部分热解产物有重现性:呋喃类有乙烯基呋喃、2-乙基-5-甲基-呋喃等;呋喃酮类有 5-甲基-2(3H)-呋喃酮;醛类有3-呋喃甲醛等.STOC样品相似性也形成了一些相似结构的产物,如烯类、呋喃酮类、酮类化合物等.部分产物结构可以直接反映出前体化合物的结构,如3-呋喃甲醛等特征醛,由中间化合物果糖类发生Strecker降解时分子结构中的氨基酸脱羧转化而来[18].
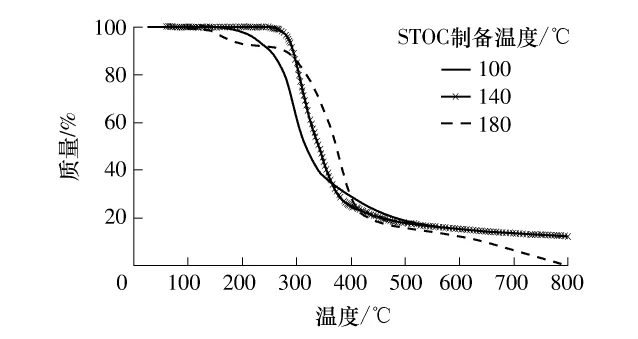
图6 STOC裂解产物相对含量随温度的变化曲线Fig.6 Change curves of relative contents of some STOC pyrolysis products with the temperature

表2 在不同温度下干法制备的STOC热裂解的主要产物1)Table 2 Major compounds from the pyrolysis of STOC prepared by dry process at different temperatures
4 结语
文中以蔗糖和柠檬酸(酸化蔗糖)为原料,分别采用干法和湿法工艺制备了新型功能性添加剂低聚焦糖,其中湿法工艺是本研究提出的.对不同温度制备的STOC的特性进行分析,结果表明:随着温度升高,干法工艺制备的STOC的pH值先升高后缓慢降低,140℃时反应较为剧烈,pH值为4.63,而湿法工艺的逐渐降低;温度越高,干法工艺制备的STOC的D(294)及D(420)上升得越快;制备温度不高于160℃时,湿法工艺制备的STOC的特征吸收和褐变程度呈较快上升趋势;随着温度升高,两种工艺制备的STOC的总糖含量逐渐减少,还原糖含量先上升后下降;120℃时干法和湿法工艺制备STOC的清除DPPH自由基能力分别为6.83%、70.62%.STOC的主要成分和热裂解分析表明,STOC含有蔗果三糖、蔗糖、葡萄糖、果糖等单糖和低聚糖成分,热裂解产物主要有呋喃、呋喃酮、吡唑、吡咯烷、醛、烯和酸酐类.
该研究为新型添加剂STOC的制备工艺及其产品特性、功能特性、稳定性提供了理论基础.下一步将对STOC的生成机理及抗生素功能进行深入研究与探讨.
[1] 冉艳红,于淑娟,杨连生,等.云芝菌用于糖厂废水生物脱色及生产多糖的研究[J].华南理工大学学报:自然科学版,2003,31(3):40-44.Ran Yan-hong,Yu Shu-juan,Yang Lian-sheng,et al.Decolorization of refinery effluent and polysaccarrides preparation by Polystictus versicolor[J].Journal of South China University of Technology:Natural Science Edition,2003,31(3):40-44.
[2] Godshall M A.Future directions for the sugar industry[J].International Sugar Journal,2001,103(1233):378-384.
[3] Defaye J,Garcia Fernandez J M.Protonic and thermal activation of sucrose and the oligosaccharide composition of caramel[J].Carbohydrate Research,1994,256(2):1-4.
[4] Manley H M,Richards G N.Thermolysis of sucrose for food products:a sucrose caramel designed to maximize fructose oligosaccharides for beneficial moderation of intestinal bacteria [J].Zuckerindustrie,1994,119(11):924-928.
[5] Manley H M,Richards G N.A novel fructoglucan from the thermal polymerization of sucrose [J].Carbohydrate Research,1993,240(2):183-196.
[6] Manley H M,Richards G N.Anhydro sugars and oligosaccharides from the thermolysis of sucrose [J].Carbohydrate Research,1994,254(2):195-202.
[7] Manley H M,Richards G N.Stereoselective thermal transfer of fructose from sucrose to cyclodextrins[J].Carbohydrate Research,1995,268(2):209-217.
[8] Campbelld C E,Richards G N.Methods for the treatment and prevention of diarrhea:US,5439893[P].1995-08-08.
[9] Orban J I,Patterson J A,Sutton A L,et al.Effect of sucrose thermal oligosaccharide caramel(STOC)on growth performance and intestinal microbial populations in growing pigs[J].European Association for Animal Production,1994,80(1):280.
[10] Manley H M,Richards G N.Formation of trisaccharides(kestoses)by pyrolysis of sucrose[J].Carbohydrate Research,1991,219(9):101-113.
[11] Wittayachai L,Soottawat B,Munehiko T.Characteristics and antioxidative activity of Maillard reaction products from a porcine plasma protein-glucose model system as influenced by pH [J].Food Chemistry,2007,100(2):669-677.
[12] Dubois M,Gilles K A,Hamilton J K,et al.Colorimetric method for determination of sugars and related substances[J].Analytical Chemistry,1956,28(3):350-356.
[13] Yoshimura Y,Iijima T,Watanabe T,et al.Antioxidative effect of Maillard reaction products using glucose-glycine model system [J].Journal of Agricultural and Food Chemistry,1997,45(10):4106-4109.
[14] Liu S C,Yang D J,Jin S Y,et al.Kinetics of color development,pH decreasing,and anti-oxidative activity reduction of Maillard reaction in galactose/glycine model systems[J].Food Chemistry,2008,108(2):533-541.
[15] 李国基,耿予欢,于淑娟.利用糖蜜生产焦糖色素的研究[J].甘蔗糖业,2005,8(5):38-41,49.Li Guo-ji,Geng Yu-huan,Yu Shu-juan.Study of producing caramel pigment from molasses[J].Sugarcane and Canesugar,2005,8(5):38-41,49.
[16] Christian T J,Manley Harris M,Field R J,et al.Kinetics of formation of Di-D-fructose dianhydrides during thermal treatment of inulin[J].Journal of Agriculture and Food Chemistry,2000,48(5):1823-1837.
[17] Zhang Y H P,Lynd L R.Toward an aggregated understanding of enzymatic hydrolysis of cellulose:noncomplexed cellulase systems[J].Biotechnology and Bioengineering,2004,88(7):797-824.
[18] Coleman W M,Chnng H L.Pyrolysis GC-MS analysis of Amadori compounds derived from selected amino acids and glucose[J].Journal of Analytical and Applied Pyrolysis,2002,62(2):215-223.

