糊化和凝沉玉米淀粉的消化性能*
高群玉 李佳佳 李云云
(华南理工大学轻工与食品学院,广东广州510640)
近年来,随着社会结构的变化、饮食习惯及食物构成的改变,慢性疾病,如糖尿病、肥胖症等胰岛素相关疾病不断上升.研究发现,淀粉的消化性能与人体的很多疾病密切相关,体外消化试验的结果与血糖指数有明显的相关性,而人体对食品的血糖反应与食物的营养价值很大程度上取决于食品的消化速度[1].选择消化速度较低的淀粉类食物有利于胰岛素和葡萄糖代谢的平稳化,对于控制糖尿病患者的病情十分有利[2-5],研究淀粉的消化速度进而确定其能被人体消化的程度对于现代人的健康显得尤为重要.
淀粉的消化速度和程度受很多因素影响,比如植物种类、淀粉类碳水化合物聚合物组成的本性、酶抑制剂、加工处理和储藏条件等.Frei等[6]对几种大米淀粉颗粒的消化性能进行了研究,发现直链淀粉含量及处理方式对淀粉的消化性能有显著影响;温其标等[7]研究了羟丙基化对淀粉颗粒及其糊的消化性能的影响,结果表明羟丙基化能够提高淀粉颗粒的消化速度,增加消化产物;陈渊等[8]研究了机械活化木薯淀粉及其乙酰化变性处理产品的消化性能,结果表明机械活化及乙酰化处理能显著提高淀粉颗粒的消化性能,消化速度增加.此前国内外的报道多集中在通过改性来调控淀粉的消化性能,而对保藏处理方式对淀粉消化性能及消化速度变化规律的影响鲜见报道.本研究以4种不同直链淀粉含量的玉米淀粉为原料,探讨了玉米淀粉糊化及保藏处理后淀粉消化产物及消化速度的变化规律,考察了保藏处理方式对食品消化性能的影响,以期为食品工业中淀粉保藏处理方式的选择提供理论依据.
1 材料与方法
1.1 实验材料
主要材料如下:普通玉米淀粉,吉林天成公司生产;蜡质玉米淀粉,甘肃雪晶生化有限责任公司生产;高链玉米淀粉(高链Ⅴ、高链Ⅶ),美国国民淀粉(化学)有限公司生产;标准马铃薯直链淀粉(Cat.No.A0512),美国 Sigma-Aldrich 公司生产;猪胰 α-淀粉酶(A3176-1 Mu,酶活为 30 U/mg,美国Sigma-Aldrich公司生产;葡萄糖淀粉酶G A07(酶活为100000U/mL),广州裕立宝生物科技有限公司生产;渗析袋,上海精科实业有限公司生产;麦芽糖,上海伯奥生物科技有限公司生产;其它试剂和药品均为分析纯.
1.2 仪器与设备
主要仪器如下:SHA-CA型恒温振荡器,常州澳华仪器有限公司生产;721型分光光度计,上海菁华科技仪器有限公司生产;DSC-2C型差示扫描量热仪(DSC),美国 PERKIN-ELMER公司生产;Brabender Viscograph-E型黏度计,德国Brabender公司生产.
1.3 实验方法
1.3.1 直链淀粉含量的测定
根据标准直链淀粉与支链淀粉纯样品制作直链淀粉的标准工作曲线.称取50mg淀粉样品,加少量无水乙醇,再加入10mL 0.5mol/L的NaOH溶液,沸水浴中使之充分溶解,冷却后用去离子水定容至50mL,摇匀.吸取2.5 mL的样品溶液于50 mL容量瓶中,加入20mL去离子水,用0.1 mol/L的HCl溶液调节pH值,使溶液的pH=3,然后加入0.5 mL 0.2%的碘试剂,定容至50 mL,室温下放置20 min,在620nm处测定其吸光度并绘制标准曲线.
1.3.2 Brabender曲线的测定
测定条件:测量盒扭矩为700 cmg,转子转速为250r/min,升降温速率为3℃/min.
测定步骤:称取一定质量的玉米淀粉,加适量蒸馏水配成100g质量分数为6%的淀粉乳,搅拌均匀后置于Brabender黏度仪的测量杯中,从30℃开始升温,以3℃/min的速度加热至95℃并保温15min,然后以3℃/min的速度降温至50℃并保温15 min,得到Brabender黏度曲线,黏度单位为BU.
1.3.3 热分析
准确称取一定量的淀粉样品置于样品盘中,用微量进样器加适量蒸馏水配成淀粉含量为30%的淀粉乳,然后将样品盘压紧密封,室温下平衡过夜.将样品盘放入仪器的样品座,以空白样品盘作参比物,通氮气,开通仪器进行扫描.扫描温度范围为30~140℃,扫描速度为5℃/min,通氮气的速度为20mL/min.
1.3.4 in-vitro 消化性能分析
(1)淀粉颗粒消化产物和消化速度的测定
根据Jenkins等[9]提出的人体消化速度in-vitro测定模型,准确称取一定量(m)的原淀粉样品,转移到渗析袋中,加入15 mL的pH=5.2的磷酸盐缓冲液溶解,加入4 mL的猪胰 α-淀粉酶(300 U/mL),1mL(2500U/mL)的葡萄糖淀粉酶,夹紧渗析袋口,上下反转若干次摇匀后将渗析袋放入装有400 mL缓冲液的烧杯中,连烧杯一起置于37℃、100 r/min的恒温摇床中水浴保温反应,并不时搅动渗析袋外液体,定时从烧杯中吸取0.4 mL的消化渗析液,稀释一定倍数后测定含糖量.含糖量的测定采用苯酚-硫酸法,用麦芽糖标准溶液制作标准曲线,并在490nm波长下测定其吸光度,进行比色分析,根据所测吸光度分别计算整个体系中的水解糖含量和消化速度:
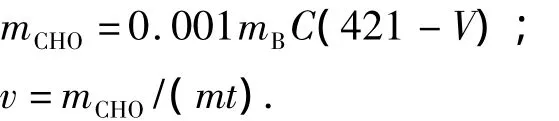
式中:mCHO为消化产物的量,mg;v为平均消化速度,mg/(g·h);mB为从标准曲线中查出标准麦芽糖量,μg;C为渗析液稀释倍数;m为以干基计的样品质量,g;t为反应时间,h;V为每次从体系中取出渗析液的体积,mL;0.001为将 μg换算成 mg的系数;421为in-vitro消化模型中整个体系的溶液体积,mL;
(2)糊化淀粉消化产物和消化速度的测定
称取一定量(m)的原淀粉样品于50 mL带旋转盖的离心管中,添加10mL的去离子水,涡旋混匀后在沸水浴中糊化40min.待冷却至室温后,添加5mL pH=5.2的磷酸盐缓冲液,搅拌均匀后转移至渗析袋中,加4mL的猪胰α-淀粉酶、1 mL的葡萄糖淀粉酶,其余步骤同(1).
(3)凝沉淀粉消化产物和消化速度的测定
将(2)中制备好的淀粉糊冷却至室温后,放入4℃冰箱中放置24h,第2天向离心管中添加5mL pH=5.2的磷酸盐缓冲液,其余步骤同(1).
1.3.5 数据统计与分析
各组实验数据均为3次重复测定之后的平均值,并使用Origin 8.0作图.
2 结果与讨论
2.1 玉米淀粉的糊化性质
2.1.1 Brabender数据分析
不同直链淀粉含量的玉米淀粉的糊化特征参数见表1.由表1可知,高链Ⅴ与高链Ⅶ玉米淀粉的糊化温度较高,均高于90℃;普通玉米淀粉与蜡质玉米淀粉的糊化温度较低,分别为74.7℃与69.2℃;最终黏度由大到小依次排列为:蜡质玉米淀粉、普通玉米淀粉、高链Ⅴ玉米淀粉、高链Ⅶ玉米淀粉.由表1还可以看出,直链淀粉含量越高,淀粉的峰值黏度越小,消减值越大.消减值为最终黏度与峰值黏度的差值,表示淀粉糊凝沉性质的强弱.当消减值为负值时,越大则表示凝沉性越弱;为正值时,越大则表示凝沉性越强.由表1可知,蜡质玉米淀粉与普通玉米淀粉的凝沉性较弱,高链Ⅴ与高链Ⅶ玉米淀粉的凝沉性相对较强.这是因为,黏度受多种因素的影响,支链淀粉引起淀粉颗粒的膨胀和糊化,直链淀粉和脂类物质抑制淀粉的膨胀[10].
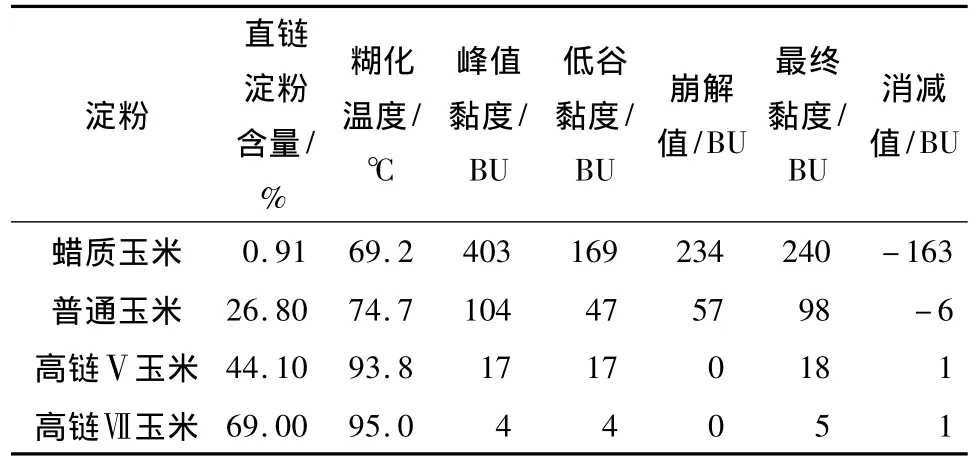
表1 不同直链淀粉含量的玉米淀粉糊的黏度特征值Table 1 Paste viscosity characteristics of corn starches with different amylose contents
2.1.2 DSC 数据分析
不同直链淀粉含量的玉米淀粉的热力学性质见表2.

表2 不同直链淀粉含量玉米淀粉的热力学性质1)Table 2 Thermaldynamic properties of corn starches with different amylose contents
由表2可知,与黏度曲线参数一致,蜡质玉米淀粉的糊化起始温度最低,高链Ⅶ玉米淀粉的糊化起始温度最高.高链Ⅴ与高链Ⅶ玉米淀粉的糊化温度范围较宽,蜡质玉米淀粉较窄,普通玉米淀粉的温度范围最窄.Shi等[11]将糊化后的淀粉重新扫描之后发现高直链玉米淀粉在100℃左右有峰出现,推测这是直链淀粉与脂类物质复合物的解体峰.高链Ⅴ与高链Ⅶ玉米淀粉的糊化温度范围较宽,这可能是因为高直链玉米淀粉中直链淀粉含量较高,能够与脂类形成更多的络合物,而这些络合物抑制了淀粉的糊化膨胀[12].由表2可见,蜡质玉米淀粉的 ΔH最大,高链Ⅶ玉米淀粉最小.DSC的焓值主要受支链淀粉结晶、直链淀粉与脂质复合物结晶以及直链淀粉结晶影响.
2.2 玉米淀粉的in-vitro消化性能
2.2.1 淀粉颗粒的消化产物与消化速度
不同直链淀粉含量的玉米淀粉颗粒在不同时间内的消化产物的量见表3,其消化速度见图1.

表3 不同时间内原淀粉颗粒的消化产物的量Table 3 Amount of digestion products of native starch granules with different digestion time mg
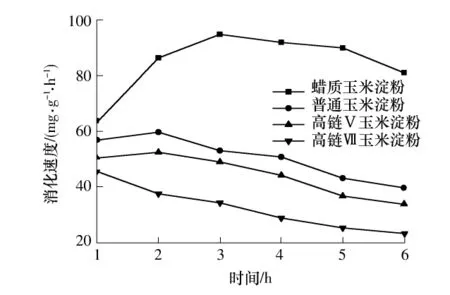
图1 原淀粉颗粒的in-vitro消化速度Fig.1 In-vitro digestion rate of native starch granules
由表3可知:随着反应时间的增加,4种玉米淀粉的消化产物逐渐增多,这是因为消化产物的量是累积的;消化产物总量由大到小依次排列为:蜡质玉米淀粉、普通玉米淀粉、高链Ⅴ玉米淀粉、高链Ⅶ玉米淀粉;在相同的消化时间内,蜡质玉米淀粉与普通玉米淀粉的消化产物的量显著高于高链(高链Ⅴ、高链Ⅶ)玉米淀粉.由图1可知,4种玉米淀粉相同时间内的消化速度由大到小依次排列为蜡质玉米淀粉、普通玉米淀粉、高链Ⅴ玉米淀粉、高链Ⅶ玉米淀粉.玉米淀粉的消化速度与原淀粉颗粒的直链淀粉含量有关,4种玉米淀粉中,原淀粉颗粒直链淀粉含量越高其消化速度越低.
不同玉米淀粉消化产物的量与消化速度的差异主要是由两方面原因引起的:首先,低直链淀粉含量的淀粉更容易被α-淀粉酶进攻,同一类型的淀粉中,直链淀粉含量越高,抗性淀粉含量越高[12].其次,淀粉颗粒内部及分子间的结构对抗酶解性能也有显著影响,高支链(普通、蜡质玉米淀粉)和高直链(高链Ⅴ、高链Ⅶ玉米淀粉)分别属于A型和B型结构,A型结构淀粉的抗酶解性能小于B型结构[13].
由图1可知,除了高链Ⅶ玉米淀粉,其它3种淀粉的反应速度均为先上升后下降.这是因为:酶分子首先从液相扩散到淀粉颗粒的表面,随后酶的活性部位与淀粉颗粒的特定区域结合并进行催化作用从而使淀粉颗粒发生降解[14];in-vitro消化体系中的消化速度主要是由淀粉酶与淀粉颗粒的酶促反应速度决定的[14];初始阶段,淀粉与淀粉酶接触造成淀粉颗粒结构破坏,酶作用的有效比表面积增加,消化速度增加;随着反应的进行,结晶区逐渐暴露出来,酶对淀粉结晶区的作用比无定型区要困难,故消化速度减小.
2.2.2 糊化淀粉的消化产物与消化速度
不同直链淀粉含量的淀粉糊在不同时间内的消化产物的量见表4,其消化速度见图2.
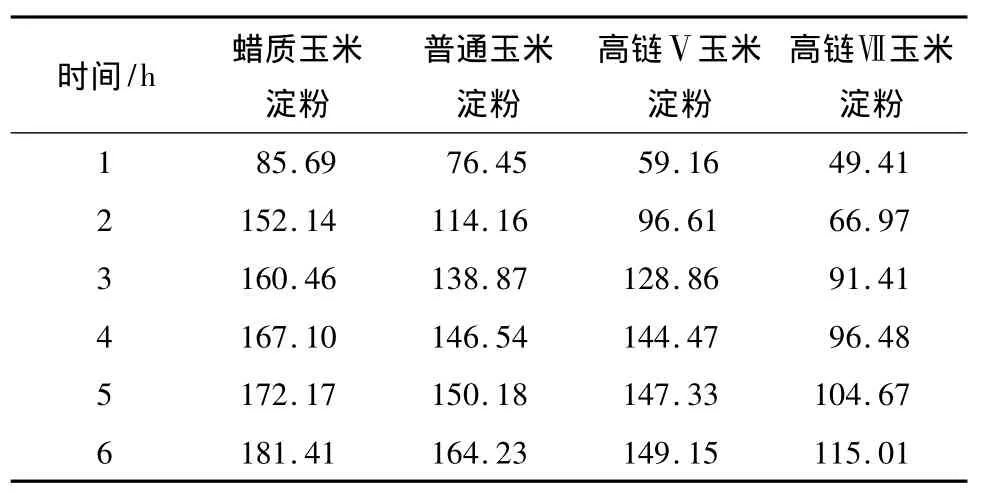
表4 不同时间内糊化淀粉的消化产物的量Table 4 Amount of digestion products of starch pastes with different digestion time mg
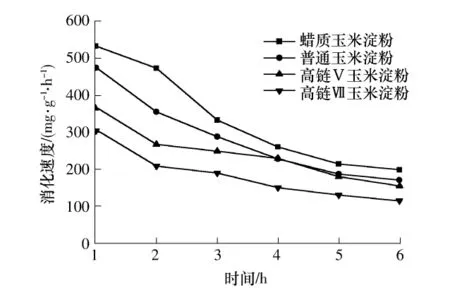
图2 糊化淀粉的in-vitro消化速度Fig.2 In-vitro digestion rates of starch pastes
由表4可知,4种玉米淀粉糊化后的消化产物的量均随着消化时间的延长而增加,与原淀粉颗粒保持一致.比较表4与表3、图2与图1发现,在相同时间内糊化淀粉消化产物的量与消化速度均明显高于原淀粉颗粒.Zhang等[15]认为淀粉的消化性能与其半结晶结构有关.原淀粉颗粒内部为无定型区,外层为结晶区且非常牢固[14],对酶及化学试剂等的抵抗能力强.糊化处理破坏其颗粒结构,妨碍淀粉酶作用的淀粉结晶结构不复存在,并使淀粉中的易消化淀粉比例增大,而慢消化淀粉和抗性淀粉含量降低[16].因此淀粉糊化后,更容易被α-淀粉酶水解,故消化产物的总量要比原淀粉高,消化速度也显著提高.
由表4还可以看出,高链Ⅴ与高链Ⅶ玉米淀粉糊化后的消化产物的量仍显著低于蜡质玉米淀粉.这是因为:高链Ⅴ与高链Ⅶ玉米淀粉的直链淀粉含量分别为44.10%、69.00%,含量较高且直链淀粉大部分分布在淀粉颗粒表面,在糊化过程中,淀粉颗粒表面的直链淀粉可以与支链淀粉紧密结合在一起形成网状结构,抗酶解作用强[17].另一方面,高链Ⅴ与高链Ⅶ玉米淀粉中含有比较多的脂类物质,脂类物质与直链淀粉分子结合形成络合物,对淀粉膨胀、糊化和溶解均有强的抑制作用[12].从表2中的DSC参数可知两种高链玉米淀粉的tc均超过100℃,这也印证了这一点.原因可能是络合物能明显降低in-vitro模型中淀粉酶对淀粉的水解利用率,抗酶解性强.
比较图2和图1可见,糊化后淀粉的消化速度并没有像原淀粉颗粒一样呈现出先升高后降低的现象,这主要是因为淀粉的半结晶结构被破坏,使得淀粉酶的水解变得更加容易.
2.2.3 凝沉淀粉的消化产物与消化速度
不同直链淀粉含量的凝沉淀粉在不同时间内的消化产物的量见表5,其消化速度见图3.
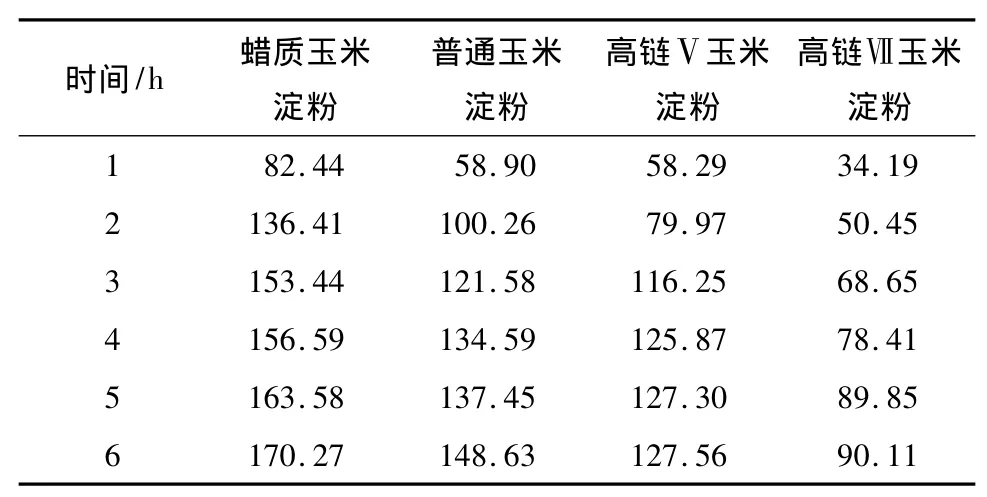
表5 不同时间内凝沉淀粉的消化产物的量Table 5 Amount of digestion products of retrogradated starch with different digestion time mg
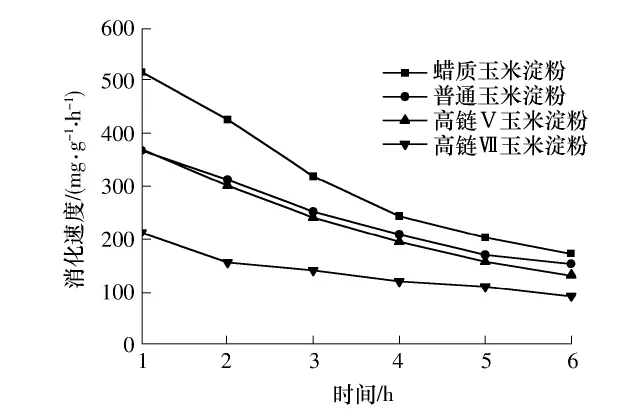
图3 凝沉淀粉的in-vitro消化速度Fig.3 In-vitro digestion rate of retrogradated starch
比较表5与表4、图3和图2发现,与糊化淀粉相比,4℃条件下保藏24 h后凝沉淀粉的消化产物总量与初始消化速度均有不同程度的降低.这可能是因为淀粉糊保藏处理后,淀粉分子在靠近分子链的末端区域相互缠绕形成双螺旋结构,并使得原来杂乱无章的淀粉分子链进一步延伸,发生折叠卷曲,从而形成紧密的螺旋与螺旋间聚集体,导致结晶区的形成[18].而结晶区的出现会阻止淀粉酶靠近结晶区域的D-葡萄糖苷键,并阻止淀粉酶活性中心与淀粉分子结合[19],因此,凝沉后的淀粉更不容易被淀粉酶作用,从而使消化产物的量降低.
比较表5与表4可知,4℃条件下保藏24h后高链Ⅴ和高链Ⅶ玉米淀粉消化产物总量明显降低,普通玉米淀粉变化较小,而蜡质玉米淀粉变化最小;同时由图3与图2可知,各玉米淀粉的初始消化速度与糊化淀粉相比均有不同程度的降低.这是由于保藏后,淀粉分子重新排列,淀粉分子之间通过氢键的连接堆积构成晶体产生凝沉.直链淀粉分子之间相互聚集形成有序结构的速度比较快,一般在3 h内完成,而支链淀粉分子之间的重结晶比较缓慢[20],这从表1中Brabender特征参数的消减值中也可以体现出来.蜡质玉米淀粉支链淀粉含量高,短期内(24h)淀粉分子有序程度变化不大[21],因此保藏24h之后,蜡质玉米淀粉的消化产物的量并没有发生显著变化.
3 结论
(1)直链淀粉含量对淀粉糊的黏度性质影响显著,直链淀粉含量越高,糊化温度越高,峰值黏度越低、消减值越高.
(2)糊化淀粉与4℃保藏24h后凝沉淀粉的消化产物总量以及消化速度均与其直链淀粉的含量有关,直链淀粉含量越高,消化产物总量与消化速度越低.
(3)玉米淀粉糊化后,消化产物总量与消化速度均显著高于原淀粉;与糊化淀粉相比,4℃保藏24h后凝沉淀粉消化产物总量与初始消化速度均低于糊化淀粉;高链Ⅶ的消化产物总量降低得最明显,普通玉米淀粉与高链Ⅴ玉米淀粉降低的幅度较小,蜡质玉米淀粉变化最小.
[1] K O’Dea,Snow P,Nestal P.Rate of starch hydrolysis in vitro as a predictor of metabolic response to complex carbohydrates in vivo[J].The American Journal of Clinical Nutrition,1981,34(10):1991-1993.
[2] Lehmann U,Robin F.Slowly digestible starch - its structure and health implications:a review[J].Trends in Food Science & Technology,2007,18(7):346-355.
[3] Pi Sunyer F X.Glycemic index and disease [J].The American Journal of Clinical Nutrition,2002,76(1):290S-298S.
[4] 缪铭,张涛,秦啸天,等.谷物淀粉的慢消化特性与餐后血糖应[J].营养学报,2009,31(3):218-221.Miao Ming,Zhang Tao,Qin Xiao-tian,et al.Slow digestibility of cereal starch and postprandial glycemic response[J].Acta Nutrimenta Sinica,2009,31(3):218-221.
[5] Jenkins D J A,Wolever T M S,Taylor R H,et al.Glycemic index of foods:a physiological basis for carbohydrate exchange[J].The American Journal of Clinical Nutrition,1981,34(3):362-366.
[6] Frei M,Siddhuraju P,Becker K.Studies on the in vitro starch digestibility and the glycemic index of six different indigenous rice cultivars from the Philippines[J].Food Chemistry,2003,83(3):395-402.
[7] 温其标,卢声宇.羟丙基淀粉消化性能的研究[J].华南理工大学学报:自然科学版,2002,30(11):134-137.Wen Qi-biao,Lu Sheng-yu.A study on the digestibility of hydroxypropyl starch[J].Journal of South China University of Technology:Natural Science Edition,2002,30(11):134-137.
[8] 陈渊,李家贵,黄祖强,等.机械活化木薯淀粉及其乙酰化淀粉的消化性能研究[J].食品科学,2010,31(7):61-65.Chen Yuan,Li Jia-gui,Huang Zu-qiang,et al.Digestibility of mechanical activated cassava starch and acetylated starch [J].Food Science,2010,31(7):61-65.
[9] Jenkins D J A,Jenkins A L,Wolever T M S,et al.Starchy foods and fiber:reduced rate of digestion and improved carbohydrate metabolism [J].Scandinavian Journal of Gastroenterology,1987,22(s129):132-141.
[10] Tester R F,Morrison W R.Swelling and gelatinization of cereal starches,effect of amylopectin,amylose and lipids[J].Cereal Chemistry,1990,67(6):551-557.
[11] Shi Y C,Capitani T,Trzasko P,et al.Molecular structure of a low-amylopectin starch and other high-amylose maize starches[J].Journal of Cereal Science,1998,27(3):289-299.
[12] Sievert D,Pomeranz Y.Enzyme-resistant starchⅡ:differential scanning calorimetry studies on heat-treated starches and enzyme-resistant starch residues[J].Cereal Chemistry,1990,67(3):217-221.
[13] Sevenou O,Hill S E,Farhat I A,et al.Organisation of the external region of the starch granule as determined by infrared spectroscopy[J].International Journal of Biological Macromolecules,2002,31(1/2/3):79-85.
[14] 史苗苗,高群玉.抗性淀粉直链淀粉含量测定及消化性研究[J].食品工业科技,2011,32(5):105-112.Shi Miao-miao,Gao Qun-yu.Amylose content and digestibility of resistant starch [J].Science and Technology of Food Industry,2011,32(5):105-112.
[15] Zhang G Y,Ao Z H,Hamaker B R.Slow digestion property of native cereal starches[J].Biomacromolecules,2006,7(11):3252-3258.
[16] 张斌,罗发兴,黄强,等.不同直链含量玉米淀粉结晶结构及其消化性研究[J].食品发酵与工业,2010,36(8):26-30.Zhang Bin,Luo Fa-xing,Huang Qiang,et al.Crystalline structures and digestibility of cornstarches with different amylose/amylopectin content[J].Food and Fermentation Industries,2010,36(8):26-30.
[17] Lineback D R.The starch granule:organization and properties[J].Bakers Digest,1984,58(2):16-21.
[18] 李晓玺,温其标.抗酶解淀粉的研究进展及其在食品工业中的应用[J].武汉工业学院学报,2000,3:12-15.Li Xiao-xi,Wen Qi-biao.The progress of studing enzyme-resistant starch and its application in food industry[J].Journal of Wuhan Polytechnic University,2000,3:12-15.
[19] Jane J L,Robyt J F.Strcuture studies of amylose-V complexes and retro-graded amylose by action of alpha amylase,and a new methord for preparing amylodextrins[J].Carbohydrate Research,1984,132(1):105-118.
[20] 王月慧,丁文平.大米淀粉凝胶储藏过程中消化特性的变化[J].食品科学,2005,26(1):64-66.Wang Yue-hui,Ding Wen-ping.Study on digestibility changes of rice starch gels during storage[J].Food Science,2005,26(1):64-66.
[21] 缪铭,江波,张涛,等.食品制造方法对膳食淀粉消化性能的影响(I)——保藏[J].食品与发酵工业,2010,36(8):22-25.Miao Ming,Jiang Bo,Zhang Tao,et al.Impact of food prepartion methods on the in-vitro digestibility of dietary starch sources(I)preservation[J].Food and Fermentation Industries,2010,36(8):22-25.

