凝溶胶蛋白在胃癌组织中的表达及临床意义
李俊华 袁向亮 沈立松
胃癌是我国常见的恶性肿瘤,也是致死率最高的恶性肿瘤之一。关于胃癌发生发展的分子机制目前仍不明确。GSN是胞质内重要的actin调节蛋白。GSN广泛表达于正常组织中[1],在机体生命活动中发挥重要作用,已有研究显示,GSN具有明显地肿瘤抑制作用,在多种肿瘤中其表达水平明显降低,与恶性肿瘤的发生发展密切相关,被认为是1种候选的抑癌基因[2]。本研究应用免疫组化蛋白印迹法,检测GSN在胃癌组织及其癌旁组织中的表达情况,并探讨其表达与胃癌发生、发展的关系及其意义。
1 材料与方法
1.1 临床资料
收集2008年1月至2010年12月本院收治的、28例胃癌患者手术切除的胃癌组织标本。男性17例,女性11例,平均年龄64.6岁。组织学分级:高分化10例,中分化8例,低分化和未分化10例;TNM分期:Ⅰ期8例,Ⅱ期7例,Ⅲ期6例,Ⅳ期7例。另收集2011年1月至2012年1月本院手术切除的新鲜胃癌组织及相应的癌旁组织各12例,其中男性6例,女性6例,平均年龄60岁。患者术前未行放、化疗及免疫治疗。
1.2 试剂和仪器
鼠抗人GSN单克隆抗体(美国Sigma公司);封闭液(Horse serum);二抗(anti-mouse IgG)和ABC液均采用VECTASTAIN ABC KIT(美国Vector Laboratories公司)中的试剂。组织蛋白提取液为T-PER Tissue protien Extraction Reagent(美国Thermo公司);二抗为Goat anti-Mouse IRDY 800CW(美国LI-COR Biosciences公司);Odyssey扫膜仪(美国LI-COR Biosciences公司)。
1.3 免疫组化
常规石蜡包埋,连续切片,免疫组化ABC法染色。常规脱蜡脱水后用柠檬酸钠(pH 6.0)作为抗原修复液,120℃高压修复3 min,3%过氧化氢灭活内源性过氧化酶,封闭30 min,一抗4℃过夜,一抗为鼠抗人GSN单克隆抗体,工作浓度为1∶1000,用PBS取代一抗作为阴性对照,以已知阳性切片作为阳性对照。二抗、封闭液和ABC液均采用VECTASTAIN ABC KIT中的试剂。DAB显色,苏木精复染,中性树脂封片。
1.4 蛋白印迹
新鲜组织手术切除后半小时内放置液氮内速冻,然后于-80℃保存,标本收齐后集中提取蛋白。200 mg组织中加入1000 μl蛋白提取液和10 μl蛋白酶抑制剂,剪碎后匀浆,高速离心后取上清加上样缓冲液煮沸冷却后上样电泳。常规电泳,用PDVF膜转膜,Odyssey封闭液封闭1 h,一抗4℃过夜,一抗为鼠抗人GSN单克隆抗体,工作浓度为1∶1000;二抗为羊抗鼠荧光二抗,工作浓度为1∶5000,二抗室温孵育1 h,洗膜后,用Odyssey扫膜仪扫膜。
1.5 免疫组化结果判定及分级标准
免疫组化结果采用双盲法。以已知阳性片作为阳性对照,每组均用PBS代替一抗作为阴性对照。根据阳性细胞百分比及染色强度进行综合评分,阳性细胞百分比为5个高倍镜(10 × 40)随机视野下阳性细胞百分比。按染色强度评分:无色为0分、浅黄色为1分、棕黄色为2分,棕褐色为3分。按阳性细胞百分比评分:0分为无阳性细胞,阳性细胞百分比≤10%为1分, 11%~50%为2分, 51%~80%为3分,﹥80%为4分。最后按以上两项评分的乘积进行综合评分。每张切片由两名高年资病理科医生分别计数评分。
1.6 统计学处理
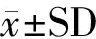
2 结果
2.1 GSN在胃癌组织中的表达情况
GSN表达水平在正常胃腺上皮细胞、部分异形性增生胃腺上皮细胞及胃癌肿瘤细胞中,呈逐渐下降趋势。GSN在正常胃腺上皮细胞中呈高表达,胞质呈棕黄色,胞核染成棕褐色;在胃癌肿瘤细胞中GSN普遍呈低表达,胞质染成淡黄色,胞核基本未着色。部分异形性增生腺上皮细胞,胞质染成淡黄色,胞核染成棕黄色,部分细胞胞核未着色。
2.2 不同临床分期胃癌组织中GSN表达情况
Ⅰ期胃癌组织中可见部分肿瘤细胞胞质和胞核均被染成棕黄色,阳性细胞百分率为34.7%,GSN表达得分为2.75±0.91。Ⅱ期胃癌组织中GSN表达明显减弱,部分肿瘤细胞胞质染成浅黄色,大多数肿瘤细胞胞核无明显染色,GSN阳性细胞百分率为26.3%,GSN表达得分为2.23±0.95。Ⅲ期胃癌组织中只有少数肿瘤细胞出现阳性染色,阳性细胞百分率为5.3%,GSN表达得分为1.07±1.10。Ⅳ期胃癌组织中GSN几乎无表达,阳性细胞百分率仅为2.2%,GSN得分为0.74±0.61。可见,GSN表达随着胃癌临床分期的增加而逐渐减弱,差异有显著统计学意义(P<0.05),见图1。
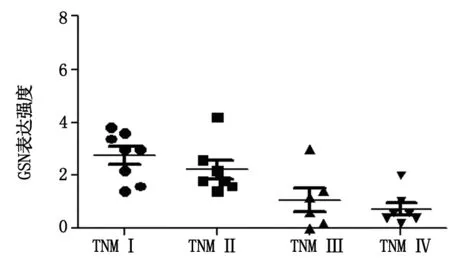
图1 GSN在TNM不同分期胃癌中的表达情况
2.3 GSN表达与胃癌临床病理特征的关系(表1)
GSN表达与胃癌患者年龄、性别无关(P>0.05),与肿瘤细胞的分化程度、浸润程度和淋巴结有无转移有一定相关性,其中中低分化胃癌组织GSN表达水平明显低于高分化胃癌患者,差异有显著统计学意义(P<0.01)(图2a)。肿瘤浸润至浆膜层及其以外的病例GSN表达水平明显低于肿瘤局限于浆膜层内的病例,差异有显著统计学意义(P<0.01)(图2b)。淋巴结转移者GSN的表达强度明显弱于无淋巴结转移者,差异有显著统计学意义(P<0.01)(图2c)。
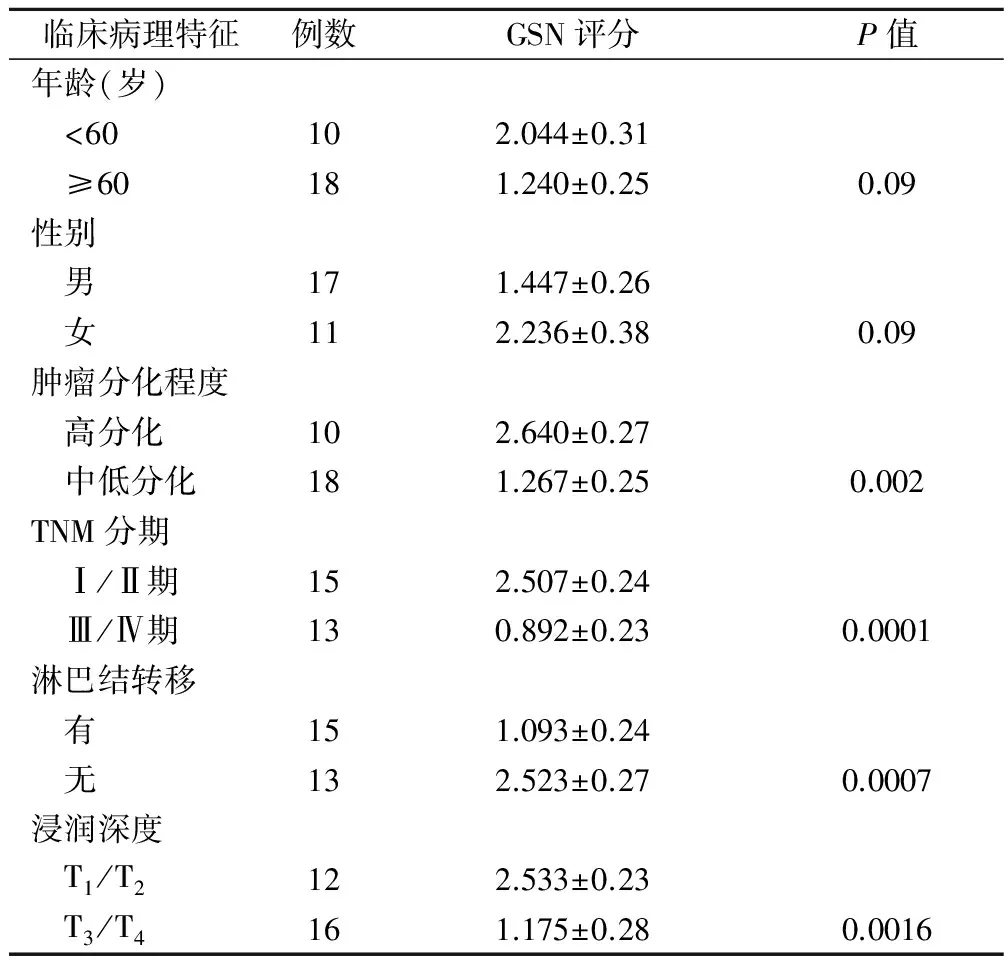
表1 GSN表达与胃癌临床病理特征的关系
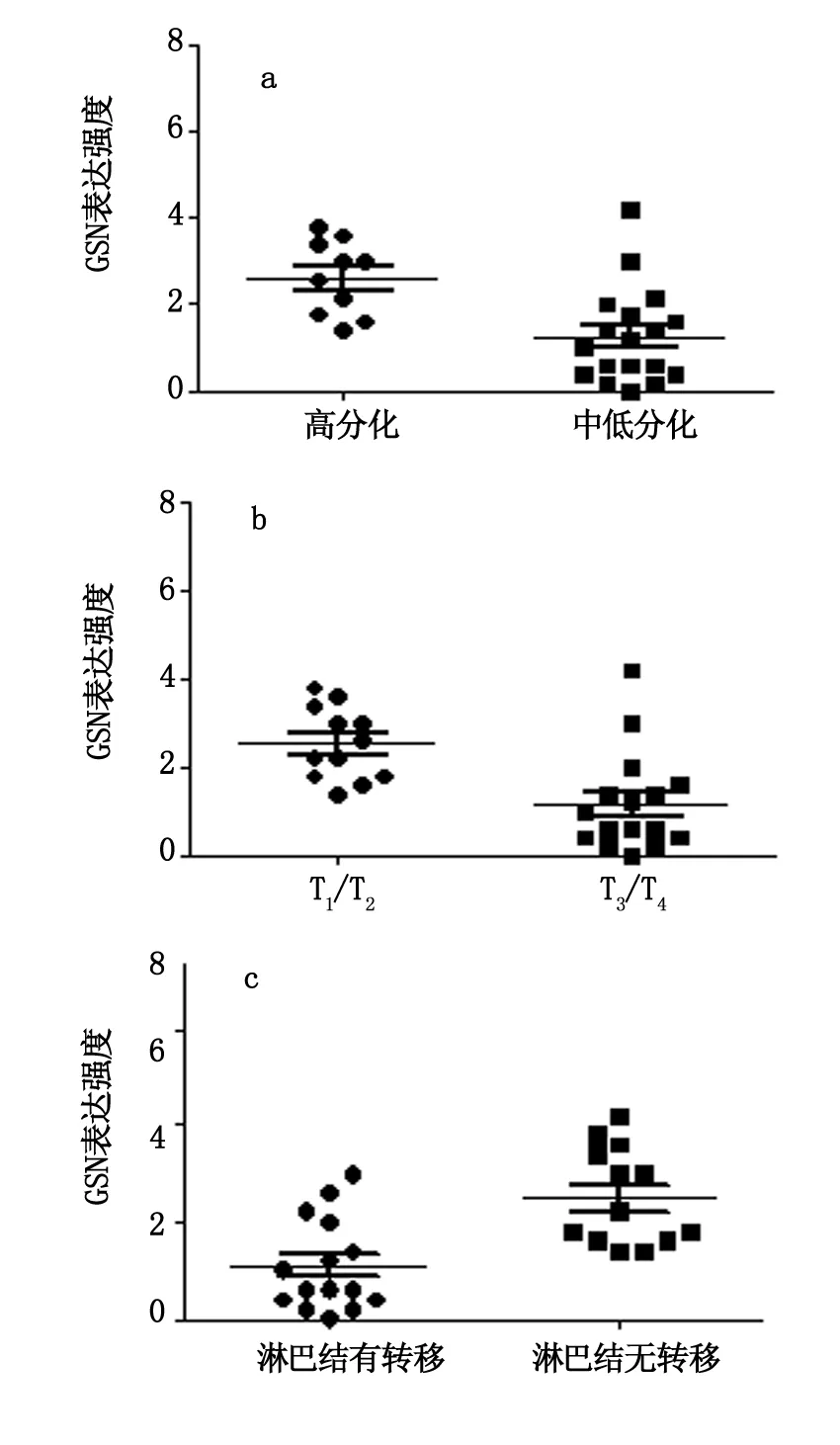
图2 GSN表达与胃癌临床病理特征的关系
2.4 GSN在胃癌组织及癌旁组织中的表达情况
由图3可见,胃癌组织中GSN表达水平明显低于相应的癌旁组织;本组12例胃癌组织中10例患者GSN表达量明显低于相应的癌旁组织,GSN低表达率为83.3%(10/12)。
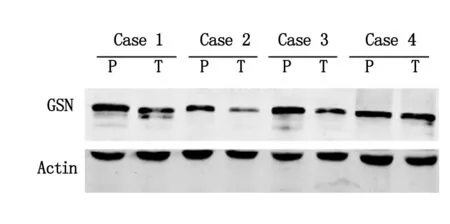
图3 GSN在胃癌组织及相应癌旁组织中的表达情况
3 讨论
GSN是胞质内重要的actin调节蛋白,可调节肌动蛋白的重组,参与多种与细胞骨架排列相关的细胞进程。更多研究表明,GSN在细胞信号传导中作为转录辅助因子对细胞周期、凋亡起调控作用[3]。GSN与恶性肿瘤的发生发展密切相关,被认为是1种候选的抑癌基因[2]。本研究发现GSN在胃癌细胞及肿瘤组织中的表达明显降低,并随着肿瘤进展及分化程度降低而降低,GSN在胃癌发生发展中可能起着抑制作用。
许多研究发现GSN在多种肿瘤中表达明显降低。在人膀胱癌中,GSN在6个膀胱癌细胞系和77.8%(14/18)的膀胱癌组织中表达缺失和明显降低[4]。在乳腺癌中,GSN的蛋白和mRNA的表达水平在乳腺癌细胞系中缺失或明显低于正常人乳腺上皮细胞和良性永生化细胞。免疫组织化学显示,GSN在70%的浸润性乳腺癌[5]、55%(48/68)的非小细胞肺癌[6]、68.1%(15/22)的胃癌[7]和62.7%(32/51)的口腔鳞癌组织[8]中表达明显降低。本实验中,采用免疫组化方法,我们发现在胃癌肿瘤组织切片中GSN在肿瘤细胞中的表达也明显低于正常腺上皮细胞。我们还通过蛋白印迹法检测到在新鲜的胃癌组织中GSN的表达明显低于与之对应的癌旁组织。但是GSN在肿瘤细胞中低表达的机制目前并不是很清楚。有研究表明,在人乳腺癌和非小细胞肺癌中,调控GSN的基因序列并没有发生突变、重组和缺失[5,6]。有关胃癌的研究中,研究者认为,在胃癌组织中组蛋白去乙酰化酶1的高表达与GSN的低表达密切相关,而组蛋白乙酰-去乙酰之间的转换对调控细胞周期、凋亡、分化有重要作用[7]。说明GSN在肿瘤中的低表达是由于基因外的机制调控的。另外有关胰腺癌的研究表明,泛素-蛋白酶体途径参与了GSN的降解,使得GSN在胰腺癌中呈低表达[9]。说明蛋白翻译后修饰也是GSN在肿瘤中低表达的一个重要因素。
有学者对GSN在肿瘤中表达明显降低的现象进行了深入的研究,发现将外源GSN cDNA全长转入膀胱癌细胞系过表达后,可抑制肿瘤细胞生长,降低肿瘤细胞的集落形成能力和裸鼠致瘤性。重组腺病毒编码的野生型GSN(Ad-GSN)转入膀胱癌细胞系后可以使细胞停滞于G/M期,原位膀胱癌动物模型经Ad-GSN治疗后,肿瘤体积缩小了90%[10],这些实验证据提示GSN具有明显地肿瘤抑制作用。许多研究证实,GSN低表达与肿瘤分化程度、淋巴结转移及不良预后等有关。有研究表明,GSN低表达与卵巢癌分化程度密切相关,在分化程度较高的肿瘤细胞中GSN表达水平明显高于未分化的肿瘤细胞[11]。在本实验中,我们发现,GSN表达与胃癌TNM分期、分化程度、淋巴结转移和浸润程度有关。晚期胃癌中GSN表达强度明显低于早期胃癌。中低分化和未分化的肿瘤细胞中GSN的表达水平明显低于高分化肿瘤细胞。肿瘤浸润到浆膜层及浆膜层之外的胃癌患者GSN表达水平明显低于局限于浆膜层之内的患者。说明GSN在胃癌肿瘤细胞发生发展中起着一定的调控作用,随着肿瘤的发展,GSN表达明显下降,失去了调控细胞周期、调节细胞凋亡的作用,使得肿瘤细胞生长失控,从而促进了肿瘤的发生发展。与之相反的是在膀胱移形细胞癌中,随着肿瘤分级和分期的增加,GSN表达逐渐增强,并且在肿瘤后期GSN表达的逐渐增强与肿瘤预后密切相关,研究者认为这与GSN可以增强细胞运动有关,进而促进肿瘤细胞的侵袭和转移[12]。而在本实验中,我们还发现,有淋巴结转移的病例中GSN表达水平明显低与无淋巴结转移的病例,表明GSN在肿瘤转移中可能起抑制作用,GSN表达的降低失去了对actin微丝细胞骨架的调控作用,使细胞的运动性、形状、生长以及凋亡发生了改变。这与Tanaka等[13]的研究一致,通过小RNA干扰乳房上皮细胞中GSN的表达后,乳房上皮细胞发生了明显的变化,成纤维细胞发生了类型转化,接触抑制现象消失,细胞成单层灶状生长,侵袭性和运动能力增强[11],说明对肿瘤的侵袭和转移GSN起着抑制作用。
综上,本实验证实了GSN在胃癌组织中表达缺失或明显降低,并且GSN表达与肿瘤分化、浸润及淋巴结转移密切相关,这可能是胃癌发生发展的重要机制之一。GSN作为一个候选的抑癌癌基因,在多种肿瘤中普遍呈低表达,可是GSN低表达的机制和其在肿瘤发生发展中的作用并不是很明确。另外GSN还是1种分泌型蛋白存在于血清中,因此检测血清中GSN的表达水平可能成为一个有价值的肿瘤诊断标志物[14]。GSN在胃癌中表达情况的研究国内暂无相关报道,国外的相关报道也较少,我们的研究或许对胃癌机制的研究提供了新的思路。
[1] Lueck A,Brown D,Kwiatkowski DJ.The actin-binding proteins adseverin and GSN are both highly expressed but differentially localized in kidney and intestine〔J〕.J Cell Sci,1998,18(111):3633.
[2] Shieh DB,Chen IW,Wei TY,et al.Tissue expression of GSN in oral carcinogenesis progression and its clinicopathological implications〔J〕.Oral Oncol,2006,42(6):599.
[3] Sakai N,ohtsu M,Fujita H,et al.Enhancement of G2checkpoint function by GSN transfection in human cancer cells〔J〕.Exp Cell Res,1999,251(1):224.
[4] Tanaka M,Müllauer L,Ogiso Y,et al.GSN:a candidate for suppressor of human bladder cancer〔J〕.Cancer Res,1995,55(15):3228.
[5] Asch HL,Head K,Dong Y,et al.Widespread loss of GSN in breast cancers of humans,mice,and rats〔J〕.Cancer Res,1996,56(21):4841.
[6] Dosaka-Akita H,Hommum F,Fujita H,et al.Frequent loss of GSN expression in non-small cell lung cancers of heavy smokers〔J〕.Cancer Res,1998,58(2):322.
[7] Kim JH,Choi YK,Kwon HJ,et al.Downregulation of GSN and retinoic acid receptor beta expression in gastric cancer tissues through histone deacetylase〔J〕.J Gastroenterol Hepatol,2004,19(2):218.
[8] Shieh DB,Chen IW,Wei TY,et al.Tissue expression of GSN in oral carcinogenesis progression and its clinicopathological implications〔J〕.Oral Oncol,2006,42(6):599.
[9] Ni XG,Zhou L,Wang GQ,et al.The ubiquitin-proteasome pathway mediates gelsolin protein downregulation in pancreatic cancer〔J〕.Mol Med,2008,14(9-10):582.
[10] Sazawa A,Watanabe T,Tanaka M,et al.Adenovirus mediated GSN gene therapy for orthotopic human bladder cancer in nude mice〔J〕.J Urol,2002,168(3):1182.
[11] Noske A,Denkert C,Schober H,et al.Loss of GSN expression in human ovarian carcinomas〔J〕.Eur J Cancer,2005,41(3):461.
[12] Rao J,Seligson D,Visapaa H,et al.Tissue microarray analysis of cytoskeletal actin-associated biomarkers GSN and E-cadherin in urothelial carcinoma〔J〕.Cancer,2002,95(6):1247.
[13] Tanaka H,Shirkoohi R,Nakagawa K,et al.siRNA GSN k-nockdown induces epithelial-mesenchymal transition with a cadherin switch in human mammary epithelial cells〔J〕.Int J Cancer,2006,118(7):1680.
[14] 倪晓光,赵 平.凝溶胶蛋白的结构和功能及其抑制肿瘤的作用〔J〕.实用癌症杂志,2007,22(1):105.

