VEGF-C及癌周淋巴管密度与头颈鳞癌颈部淋巴结转移的关系
邓莅霏 齐淑轶 刘学明 石冬梅 高 文
淋巴结转移是包括头颈鳞癌(HNSCC)在内的大多数恶性肿瘤的主要转移途径,是影响患者预后的重要因素之一。淋巴管的生成被认为是癌细胞转移至区域淋巴结关键所在。血管内皮生长因子C(vascular endothelial growth factors C,VEGF-C)是特异性的淋巴管生长因子,与肿瘤淋巴结转移相关;而淋巴管内皮细胞透明质酸受体-1(LYVE-1)则是新发现的特异性淋巴管内皮细胞标志物。本研究采用免疫组化法,检测HNSCC癌组织中VEGF-C表达情况及癌周组织中LYVE-1表达,并对淋巴管密度(lymphatic vessel density,LVD)进行计数,探讨淋巴管生成与头颈鳞癌淋巴结转移的关系。
1 材料与方法
1.1 临床资料
收集2005年6月~2009年2月本院收治的头颈鳞癌手术蜡块标本104例,所有病例为初治患者,术前未进行放化疗,临床病理资料完整,其中男性79例,女性25例,年龄33~75岁,中位年龄51岁。口腔癌37例,喉癌53例,下咽癌14例。肿瘤TNM分级、临床分期等均根据2002年版UICC标准而定,颈部淋巴结状态的判定,根据文献[1,2]分为临床阴性(cN0)、临床阳性(cN+),病理阴性(pN0)、病理阳性(pN+)。 T129例、T241例、T320例、T414例;Ⅰ期25例、Ⅱ期31例、Ⅲ期34例、Ⅳ期14例;cN0 71例、cN+ 33例,pN0 58例、pN+ 46例。病理类型均为鳞癌。组织学分化程度:高分化49例,中分化35例,低分化20例。另选取20例口腔、咽喉良性病变作为对照组。
1.2 免疫组化染色
蜡块行4 μm厚切片,免疫组化SP法检测LYVE-1、VEGF-C的表达,兔抗人淋巴管内皮透明质酸受体-1(LYVE-1)抗体购自北京博奥森生物技术有限公司,兔抗人VEGF-C多克隆抗体及通用型SP试剂盒均购自福州迈新生物技术有限公司,以试剂公司提供的阳性切片作为阳性对照,用PBS 替代一抗作为阴性对照,DAB显色,苏木精复染。
1.3 免疫组化染色结果判定
由两位病理医生在双盲状态下对免疫组化染色结果进行评价。
LVD计数:每例肿瘤标本均对癌周及癌内的淋巴管进行计数,参照文献[3]确定癌周和癌内的具体范围。将LYVE-1呈棕黄色染色的内皮细胞簇或内皮细胞形成的条状、隙状结构及有管腔者作为一个淋巴管计数。具体参照Weidner[4]推荐的方法:首先在低倍镜(×20)下浏览切片,选择淋巴管着色最为密集的3个区域(hot spot),然后在高倍镜(×40)下随机计数被染色的淋巴管数目,取3个高倍镜视野下淋巴管数目的均值作为微淋巴管密度(LVD)值。
VEGF-C表达:VEGF-C蛋白阳性表达于细胞质内,呈棕黄色颗粒样物,参照文献[5],阳性细胞数≤10%为阴性(-),>10%为阳性(+)。
1.4 统计学方法
2 结果
2.1 VEGF-C表达与头颈鳞癌临床病理特征的关系
VEGF-C蛋白在正常组织及癌组织中阳性表达率分别为0(0/20)、74.04%(77/104),P<0.05(χ2=39.067)。VEGF-C表达与肿瘤颈部淋巴结状态及临床分期有关,而与肿瘤组织学分化程度及肿瘤大小(T分期)无关,见表1。
2.2 头颈鳞癌癌周组织中LYVE-1表达及LVD计数
癌周、癌内组织及正常黏膜组织中均可见LYVE-1阳性表达,淋巴管管壁较薄,形态不规则,管腔呈扩张或塌陷状。癌周LVD明显大于癌内及正常黏膜组织,癌周LVD与肿瘤颈部淋巴结状态、临床分期及VEGF-C表达均相关,而与肿瘤组织学分化程度、肿瘤大小(T分期)无关,见表2。

表1 VEGF-C表达与头颈鳞癌临床病理因素的关系(例)
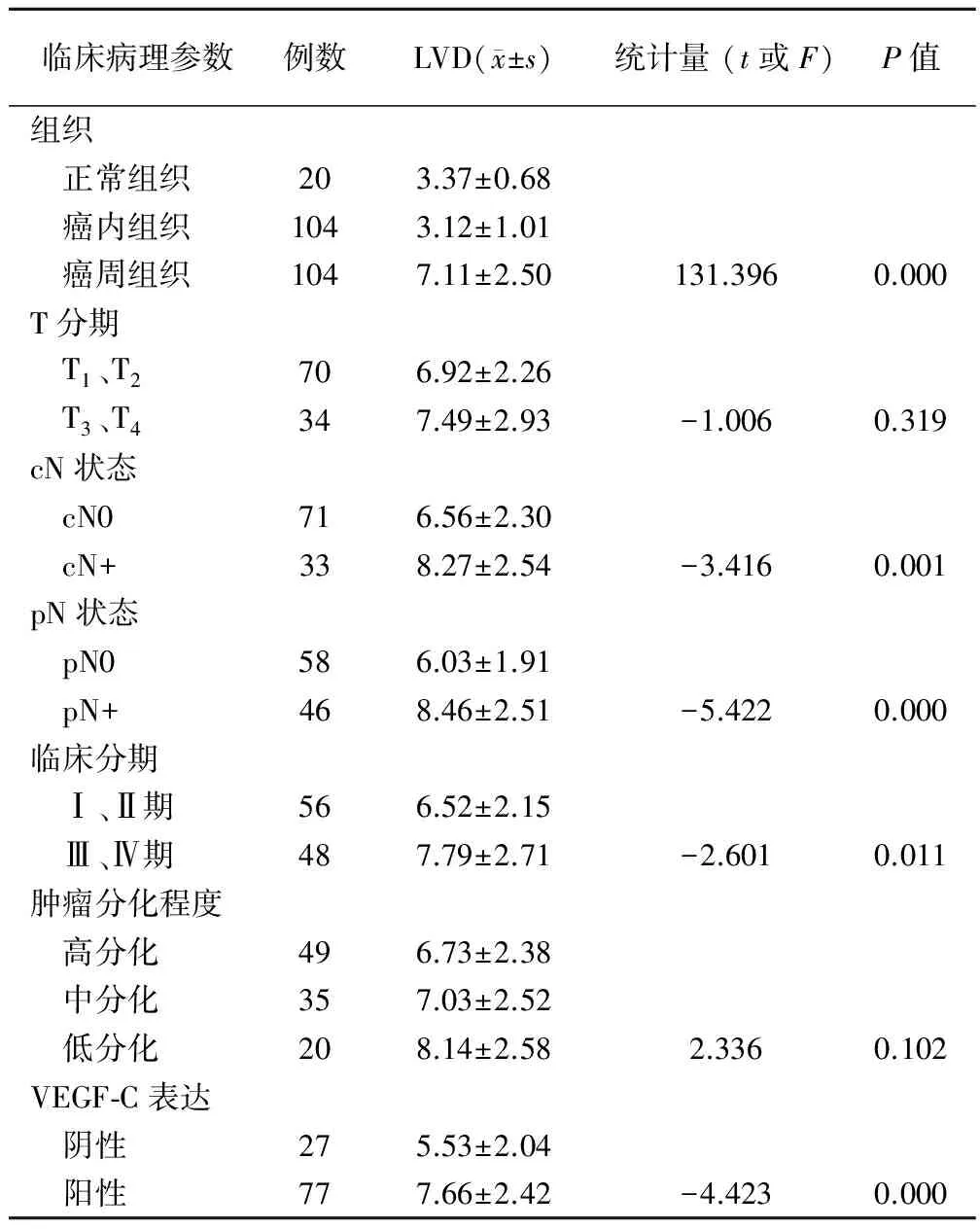
表2 癌周LVD与头颈鳞癌临床病理参数的关系
3 讨论
头颈鳞癌经根治性手术和放射治疗后总的5年生存率约在50%左右,其中颈部淋巴结复发、转移是治疗失败的主要原因之一,因而评估原发肿瘤的转移潜能及颈部淋巴结状态一直是头颈鳞癌治疗中极其重要的环节。各种癌细胞经淋巴道转移的基本过程为癌细胞在原发灶的快速生长并从原发灶脱落,浸润侵入毛细淋巴管,运行到区域淋巴结内大量增殖从而形成新的转移灶,而癌周毛细淋巴管的增殖与扩张则是肿瘤淋巴道转移过程的必要条件,了解肿瘤及其周围淋巴管的生成状态对于掌握其转移规律具有重要意义[6]。
由于缺乏可靠的淋巴管内皮标记物,长期以来对肿瘤淋巴管生成的研究进展缓慢。1999年Banerji等[7]发现的淋巴管内皮细胞透明质酸受体(LYVE-1)作为目前特异性最强的淋巴管标志物之一,使淋巴管的识别变得简单而准确,也使得肿瘤淋巴管生成的深入研究成为可能。
Tanigawa等[8]早在1981年就应用染料示踪技术,对人与动物肿瘤的淋巴管进行研究,显示实体瘤内无淋巴管存在。Leu等[9]和Padera等[10]也均在对动物肿瘤淋巴管的研究中观察到肿瘤内部缺乏功能性淋巴管或淋巴管呈塌陷状而无引流作用,而肿瘤周边距正常组织100 μm的范围内则可见形态接近正常或扩张的功能性淋巴管。以LYVE-1为淋巴管标记物,对子宫内膜癌和肺癌的研究[11]显示,肿瘤组织中缺乏淋巴管网,淋巴管的生成主要发生在肿瘤浸润前沿及肿瘤周围,肿瘤的淋巴道播散则通过癌细胞向癌周淋巴管的侵入而实现。近年来,有关胃癌[3]、乳腺浸润性导管癌[12]、子宫内膜癌[13]及甲状腺乳头状癌[14]的临床研究均显示,癌周淋巴管密度(peritoumoral lymphatic vessel density,PLVD)与淋巴结转移密切相关,且是影响预后的独立危险因素。本实验结果显示,头颈鳞癌PLVD明显高于正常组织及癌内组织,与肿瘤分期及颈部淋巴结状况有统计学意义的相关性,与以上的研究结果一致,说明多数恶性肿瘤的癌周淋巴管形态、数目的改变与肿瘤的淋巴结转移密切相关。
VEGF-C是特异性的淋巴管内皮生长因子,主要由肿瘤细胞和基质细胞分泌,经自分泌或旁分泌形式作用于其受体VEGFR-3,通过一系列细胞信号通路的激活,使淋巴管内皮细胞存活期延长,促进淋巴管内皮细胞分化、增殖和迁移,在肿瘤的淋巴管生成中起重要作用[5]。研究表明VEGF-C与人类原发性实性肿瘤转移能力之间存在统计学上的相关性,如鼻咽癌[15]、乳腺癌[5]和非小细胞肺癌[16]等。在关于胃癌[3]和非小细胞肺癌[16]的临床病理研究还发现,VEGF-C高表达者其癌周LVD及淋巴结转移发生率均相应增高,且在胃癌中,VEGF-C高表达者无复发生存期及总生存期也明显短于低表达者。就头颈鳞癌而言,文献报道[15,17]和本研究结果均表明,VEGF-C阳性表达与颈部淋巴结状态、临床分期密切相关。我们的结果还显示,VEGF-C阳性表达与较高的癌周LVD具有统计学意义的相关性,再次印证了VEGF-C具有刺激肿瘤淋巴管生成的作用。
综上,我们认为头颈鳞癌的VEGF-C表达及癌周LVD与肿瘤的淋巴结转移密切相关,对临床判断肿瘤的侵袭、转移潜能具有一定的参考价值。对两者的检测,有助于患者的预后判断及治疗方案的评价。
[1] 郭朱明,张 诠,曾宗渊,等.舌体鳞癌颈淋巴结转移的规律和治疗策略〔J〕.癌症,2003,22(3):282.
[2] Lee JG,Litton WB.Occult regional metastasis:carcinoma of the oral tongue〔J〕.Laryngoscope,1972,82(7):1273.
[3] Gao P,Zhou G,Zhang Q,et al.Lymphangiogenesis in gastric carcinoma correlates with prognosis〔J〕.J Pathol,2009,218(2):192.
[4] Weidner N,Semple JP,Welch WR,et al.Tumor angiogenesis and metastasis-correlation in invasive breast carcinoma〔J〕.N Engl J Med,1991,324(1):1.
[5] 叶晓霞,赵伟志,石 岚,等.乳腺癌组织中VEGF-C、flt-4的表达与淋巴结转移的关系〔J〕.诊断病理学杂志,2004,11 (5):348.
[6] 邓明佳,张灿珍,沈丽达.肿瘤淋巴管形成与淋巴结转移的研究进展〔J〕.实用癌症杂志, 2008,23 (5):548.
[7] Banerji S,Ni J,Wang SX,et al.LYVE-1,a new homologue of the CD44 glycoprotein,is a lymph-specific receptor for hyaluronan〔J〕.J Cell Biol,1999,144(4):789.
[8] Tanigawa N,Kanazawa T,Satomura K,et al.Experimental study on lymphatic vascular changes in the development of cancer〔J〕.Lymphology,1981,14(4):149.
[9] Leu AJ,Berk DA,Lymboussaki A,et al.Absence of functional lymphatics within a murine sarcoma:a molecular and functional evaluation〔J〕.Cancer Res,2000,60(16):4324.
[10] Padera TP,Kadambi A,di Tomaso E,et al.Lymphatic metastasis in the absence of functional intratumor lymphatics.Science〔J〕.2002,296(5574):1883.
[11] Koukourakis MI,Giatromanolaki A,Sivridis E,et al.LYVE-1 immunohistochemical assessment of lymphangiogenesis in endometrial and lung cancer〔J〕.J Clin Pathol,2005,58(2):202.
[12] Kandemir NO,Barut F,Bektas S,et al.Can lymphatic vascular density be used in determining metastatic spreading potential of tumor in invasive ductal carcinomas?〔J〕.Pathol Oncol Res,2012,18(2):253.
[13] Gao Y,Liu Z,Gao F,et al.High density of peritumoral lymphatic vessels is a potential prognostic marker of endometrial carcinoma:a clinical immunohistochemical method study〔J〕.BMC Cancer,2010,10:131.
[14] Chung MK,Kim JH,Ko YH,et al.Correlation of lymphatic vessel density and vascular endothelial growth factor with nodal metastasis in papillary thyroid microcarcinoma〔J〕.Head Neck,2012,34(6):846.
[15] 骆梅青,李锡清.VEGF-C和VEGFR-3在鼻咽癌组织中的表达及其意义〔J〕.实用癌症杂志,2010,25 (6):568.
[16] Feng Y,Wang W,Hu J,et al.Expression of VEGF-C and VEGF-D as significant markers for assessment of lymphangiogenesis and lymph node metastasis in non-small cell lung cancer〔J〕.Anat Rec (Hoboken),2010,293(5):802.
[17] Kyzas PA,Stenfanou D,Agnantis NJ,et al.COX-2 expression correlates with VEGF-C and lymph node metastases in patients with head and neck squamous cell carcinoma〔J〕.Mod Pathol,2005,18:153.

