非小细胞肺癌病灶大小及密度与PET/CT标准摄取值相关性研究
李建南,冯洪波,蔡博文,张延军
(大连医科大学 附属第一医院 核医学科,辽宁 大连 116011)
原发性支气管肺癌是中国首位恶性肿瘤死亡原因,由于恶性肿瘤细胞分裂增殖加快,葡萄糖代谢水平失常,18F-FDG可以高水平滞留在肿瘤细胞内,在PET图像上表现为病灶内放射性异常浓聚[1]。而作为反映FDG摄取半定量分析指标之一的标准摄取值(SUV),经研究与病灶体积呈明显正相关[2]。随着肺癌原发病灶的增大,SUV增高,但不同组织学类型及不同分化程度肺癌间SUV是否有差异为近期研究的趋势[3]。本研究旨在进一步探讨病灶大小及密度对肺癌SUV是否有影响,如有影响,将其扣除后,进一步研究不同组织学类型,不同分化程度肺癌间SUV是否存在差异。
1 资料与方法
1.1 临床资料
2010年6月—2011年4月在大连医科大学附属第一医院核医学科行PET/CT检查疑诊肺癌,未进行过任何肿瘤相关治疗,经病理或细胞学确诊为原发性肺癌(鳞癌、腺癌)患者51例,其中男32例,女19例,年龄41~87岁,平均69.8岁。经术后病理证实33例,穿刺证实5例(1例为肺内病灶,4例为肺外淋巴结及骨转移灶),纤维支气管镜活检证实9例,纤维支气管镜刷检1例,痰细胞学检查证实3例。其中鳞癌22例,腺癌29例。
1.2 分 组
将患者按照组织学类型及有无转移分成4组,分别为A0组:鳞癌无转移组9例,AM组:鳞癌有转移组13例(和/或淋巴结及远处病灶转移),B0组:腺癌无转移组13例,BM组:腺癌有转移组16例(和/或淋巴结及远处病灶转移)。肺癌无转移组患者均经手术证实,肺癌有转移组未经手术证实的患者检查后转移灶均经临床证实(患者均无其它原发性肿瘤,淋巴结或脑、肝、骨病灶手术或穿刺获得细胞学证实)。
1.3 显像方法及图像采集
设备:西门子biograph 64 PET/CT仪;药物西门子公司Eclipse RD回旋加速器及西门子公司药物合成系统Explora FDG4模块生产18F-FDG,放化纯>95%。
方法:患者均要求禁食6 h以上,测量患者身高、体重,休息10~20 min后测量空腹血糖均<7.8 mmol/L建立静脉通道,按照0.2 mCi/kg体重注射18F-FDG,注射后平静休息约60 min,排尿后取仰卧位,先进行体部图像采集,患者双手上举,自股骨上段至颅底,依次采集CT、PET 图像,CT依照自带caredose软件自动调节剂量,PET采集应用CT数据进行衰减校正,3D采集模式, 2 min/床位,矩阵128×128, TrueX重建方法,21个子集,3次叠代,高斯滤波,半高宽4 mm,依患者身高不同采集7~9个床位,得到PET全身断层图像;体部采集结束后,嘱患者放下双手,进行头部图像采集,范围头顶至颅底枕骨大孔,3D模式采集一个床位,CT采集依照caredose软件自动调节剂量,PET 3 min /床位,重建矩阵336×336,其他条件同于体部采集。在西门子MMWP工作站上显示CT、PET及融合图像。
1.4 图像分析
由两名核医学科医师共同进行图像分析,对肺部病灶按照感兴趣区ROI技术测量病灶SUVmax,并分别测量病灶最大径,最小径(常规病灶选纵膈窗测量,磨玻璃密度结节选肺窗测量),及CT值(ROI取病灶70%以上,3次测量结果取平均值),肺不张则以PET显像结合CT勾画病灶边界;空洞性病变则对病灶实性部分测量。
1.5 统计学方法
2 结 果
2.1 病灶最大径、最小径及病灶密度分别与病灶SUVmax进行单因素相关分析结果
结果显示P值均<0.001,差异有非常显著性意义,即最大径、最小径及病灶密度与病灶SUVmax呈明显正相关关系,见表1。
2.2 最大径、最小径及密度作为影响因素与SUVmax做多因素回归分析结果
分析可得P=8.63E-07 <0.001,R为0.692,R2为0.480,并得到回归方程式:Y=1.353+0.537×最大径+3.036×最小径+0.024×密度。
对病灶分组后,进行随机区组方差分析,可得结果F值为11.644,P值<0.001,差异有非常显著性意义,即4组SUVmax不同。
表1病灶最大径、最小径、密度与SUVmax间单因素相关分析
Tab 1 Univariate correlation analysis between SUVmax and influencing clinical factors (maximum diameter; minimum diameter; CT value) separately
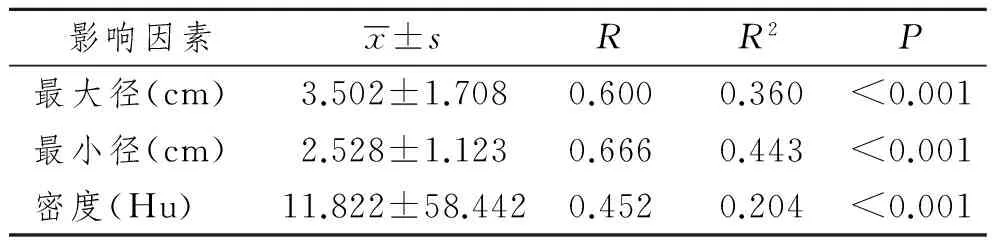
影响因素x±sRR2P最大径(cm)3.502±1.7080.6000.360<0.001最小径(cm)2.528±1.1230.6660.443<0.001密度(Hu)11.822±58.4420.4520.204<0.001
2.3 协方差分析结果
将病灶的密度、最大径及最小径分别作为协变量,对4组(A0组,AM组,B0组,BM组)SUVmax进行协方差分析,结果见表2。
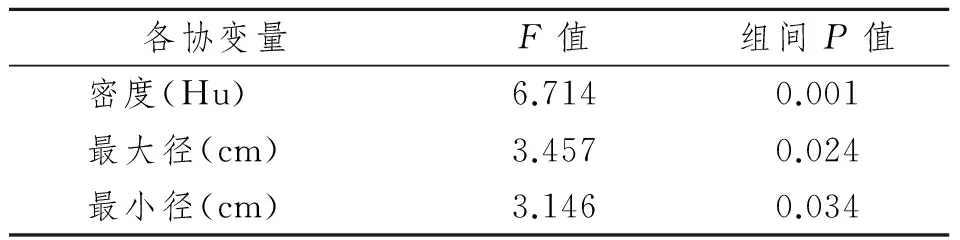
表2 四组间协方差分析结果Tab 2 covariance analysis of SUVmax between four groups
即只有将密度作为协变量时,P值<0.05,差异有显著性意义,4组SUVmax不同,而当将最大径及最小径作为协变量时,P值均>0.05,差异均无显著性意义,尚不能认为4组SUVmax不同。
将病灶的最大径,最小径及病灶密度均作为协变量,对4组(A0组,AM组,B0组,BM组)SUVmax进行协方差分析,可得组间F值为2.032,组间P值为0.123>0.05,即差异没有显著性意义,尚不能认为4组SUVmax不同。各组内比较P值见表3。

表3 4组各组内显著性分析Tab 3 Group differences of SUVmax
腺癌无转移组P值为0.023<0.05,差异有显著性意义,结合各组SUVmax统计描述可得,腺癌无转移组SUVmax较其他3组小。
3 讨 论
18F-FDG作为显像剂的功能呈像,能够较解剖学影像更早显示肿瘤的功能代谢状态[4]。研究表明肿瘤细胞凋亡、增殖活性、血管新生、糖代谢异常等因素均与肺癌的侵袭性生物学行为相关,而18F-FDG的摄取与肿瘤细胞的增殖活性、存活肿瘤细胞数、分化程度、微血管密度等均有关[5],因此18F-FDG摄取可以反映肿瘤的生物学侵袭性、预后等。而PET/CT将功能呈像与解剖呈像完美的结合,使其在肺癌的诊断、分期[6]、疗效评价及预后判断[7]等方面显示出巨大的优势。
国内外多项研究探讨了影响SUV的可能相关因素,较为一致的结论是反映病灶细胞数量的病灶最大径与SUV呈明显的正相关[8-9]。因为肺癌病灶为空间增长,各个方向上生长快慢不尽相同,单纯研究病灶的最大径并不能完全反映病灶细胞数量,尤其是细支气管肺泡癌[10],所以本实验另外引入最小径与密度两个因素,较全面的对肿瘤细胞数量与SUV进行单因素相关及多因素回归分析,结果(表1)显示上述三个因素与SUVmax之间均有正相关关系,差异有非常显著性意义,且最小径与SUVmax间相关系数最高,最大径其次,密度最小。多因素回归分析结果显示各相关因素与SUVmax间呈明显正相关关系,且得到回归方程式:Y=1.353+0.537×最大径+3.036×最小径+0.024×密度。
目前对于肺癌治疗方案的选择以及预后判断,仍依据传统肺癌TNM分期及肺癌的病理分型。刘芳颖等[11]报道肺癌18F-FDG PET显像SUV与增殖细胞核抗原(PCNA)有较好的相关性,提示肺癌的能量代谢状态可在一定程度上反映肿瘤的增殖活跃程度即肿瘤的恶性程度。Berghmans等[12]通过meta分析13组病例资料发现NSCLC患者原发癌灶的FDG摄取与非小细胞肺癌的预后密切相关,SUV是预测预后的一个较有价值的指标。李明焕等[9]对159例NSCLC腺、鳞癌患者分组进行回顾性回归分析得出病灶大小与SUV之间有正相关性,方差分析得出鳞癌SUV大于腺癌,腺癌随分期增高,SUV增高,鳞癌则仅与病灶大小有关。Jeong等[13]研究报道FDG摄取对于腺癌能够提供预后信息,而鳞癌的FDG摄取仅与肿瘤大小相关。Li M等[14]对107例NSCLC不同病理类型患者进行回顾性分析,研究结果显示随着原发癌灶SUV摄取值增加,分期增加,发生淋巴结转移和远处转移的可能性都将加大。杨衿记等[15]对92例NSCLC患者研究显示原发灶SUV与病理类型及病理分化程度无相关性,仅与病理分期相关。
本研究结果表明单纯的随机区组方差分析可以得出4组SUVmax间存在显著的差异性,由小到大依次为腺癌无转移组、鳞癌无转移组、腺癌有转移组,鳞癌有转移组。但是SUVmax与病灶最大径、最小径及密度呈正相关关系,所以本研究的进一步协方差分析结果显示,将病灶密度、最大径、最小径分别作为影响因素扣除后,结果(表2)显示只有将密度作为协变量扣除时,4组SUVmax不同,而当将最大径及最小径分别作为影响因素扣除时,P值均>0.05,4组SUVmax间差异无显著性意义。这也进一步说明病灶最大径、最小径对SUVmax影响较大。考虑到三种影响因素间有可能存在交互作用,所以最后作者将三种影响因素均作为协变量扣除,最终得到结果不同病理类型及不同分期SUVmax间差异无显著性意义。说明肺癌伴转移患者肺部病灶恶性程度不一定高于肺癌没有转移的患者,这与以往大部分研究结果不同[8,13-14]。但组内两两之间比较(表3)显示,肺腺癌无转移组较其它3组SUVmax低,差异有显著性意义,这恰好为早期腺癌预后相对较好做出较合理的解释。在临床的治疗中,无论对患者治疗方式的选择还是患者预后判断中,临床可能更关心的是病灶实际的恶性程度,而非病灶的细胞数量,而实际工作中所用的SUV受到各种影响因素的影响,因此,本研究所用的协方差分析结果更具有现实的临床意义,但回顾性分析方法、样本数量不足及相对较简单的疾病分期是本研究的不足之处,期待在此方面进一步的大样本研究。
[1] Warburg O, Posener K, Negelein E. The metabolism of cancer cells[J]. Biochem Zeitschr,1924,152:129-169.
[2] 符乙敏, 陈萍, 陈仰纯,等.病灶标准摄取值与病灶体积呈正相关[J].广州医学院学报,2009,4:11-14.
[3] 郑建国, 屈婉莹, 姚稚明,等.18F-FD GPET/CT 对不同大小孤立性肺结节的诊断价值[J].中华核医学杂志,2008, 3:170-173.
[4] Lardinois D, Weder W, Hany TF,et al.Staging of non-small-cell lung cancer with integrated positron-emission tomography and computed tomography[J]. N Engl J Med, 2003,348(25):2500-2507.
[5] Andreas K, Buck MD, Sven N, et al. Cellular Origin and Molecular Mechanisms of18F-FDG Uptake: Is There a Contribution of the Endothelium? [J].J Nucl Med,2004, 45(3):461-463.
[6] Sasaki R ,Komaki R ,Macapinlac H,et al.18F fluorodeoxyglucose uptake by positron emission tomography predicts outcome of non-small-cell lung cancer[J].J Clin Oncol,2005,23(6):1136-1143.
[7] Buck AK,Glatting G,Reske SN.Quantification of18F-FDG uptake in non-small cell lung cancer:a feasible prognostic marker? [J].J Nucl Med,2004,45:1274-1276.
[8] Hara T, Kosaka N, Suzuki T, et al. Uptake rates of18F-fluorodeoxyglucose and 11C-choline in lung cancer and pulmonary tuberculosis: a positron emission tomography study[J]. Chest, 2003, 124: 893-901.
[9] 李明焕,胡漫,张品良,等.T1期肺癌原发灶18F-FDG摄取与转移的关系[J].中华核医学杂志,2008,28(4):255-257.
[10] Kim HY, Young MS, Lee KS, et al. Persistent pulmonary nodular ground-glass opacity at thin-section CT: histopathologic comparisons[J]. Radiology, 2007, 245(1): 267-275.
[11] 刘芳颖,王全师,裴著果. 非小细胞肺癌18F-FDG PET显像与增殖细胞核抗原表达的关系[J].中华核医学杂志,2003,23(1):14-16.
[12] Berghmans T, Dusart M, Paesmans M, et al . Primary tumor standardized uptake value (SUVmax) measured on fluorodeoxyglucose positron emission tomography (FDG-PET) is of prognostic value for survival in non-small cell lung cancer (NSCLC): a systematic review and meta-analysis (MA) by the European Lung Cancer Working Party for the IASLC Lung Cancer Staging Project[J]. J Thorac Oncol, 2008, 3(1): 6-12.
[13] Jeong HJ, Min JJ, Park JM, et al.Determination of the prognostic value of18F fluorodeoxyglucose uptake by using positron emission tomography in patients with non-small cell lung cancer[J]. J Nucl Med Commun, 2002, 23(9):865-870.
[14] Li M, Liu N, Hu M, et al . Relationship between primary tumor fluorodeoxyglucose uptake and nodal or distant metastases at presentation in T1 stage non-small cell lung cancer[J]. Lung Cancer,2009,63(3):383-386.
[15] 杨衿记,吴一龙,陈刚,等. FDG-PET诊断非小细胞肺癌时影响原发灶最大标准化摄取值相关因素的回顾性分析[J]. 中国癌症杂志,2008,18(8):591-595.

