苯肾上腺素对早期放射损伤大鼠颌下腺MHCⅠ类分子表达的影响
车治萍,李秀秀,赵西博,曾常茜,张福胤,向 彬
(1.大连大学医学院 检验系,辽宁 大连 116622;2.大连医科大学 附属第一医院 口腔科,辽宁 大连 116011; 3.大连大学医学院 口腔系,辽宁 大连 116622)
头颈部恶性肿瘤患者术后放射治疗常引起涎腺结构及功能的损伤,导致放射性涎腺炎的发生,严重影响患者的健康和生活质量,甚至阻碍放射治疗的完成。苯肾上腺素为α1-肾上腺素受体(α1-adrenergic receptor, α1-AR)激动剂,研究表明它可减轻大鼠腮腺放射性损伤[1],该作用的机制尚不明确。主要组织相容性复合体(major histocompatibility complex, MHC)是一组广泛参与机体抗原提呈及免疫排斥反应的高度多态性基因群,其中MHCⅠ类分子表达范围最广,可提呈内源性抗原,启动免疫应答,从而杀伤靶细胞。正常大鼠涎腺腺泡细胞和导管细胞均有MHCⅠ类分子的表达[2-3],然而,放射损伤对颌下腺MHCⅠ类分子表达的影响以及苯肾上腺素对放射损伤早期颌下腺MHCⅠ类分子表达的作用,国内外均未见文献报道。本实验从蛋白质及基因水平研究放射性损伤早期大鼠颌下腺MHCⅠ类分子分布与表达的变化,为深入探讨α1-AR受体后信号分子通路在放射性涎腺损伤中的免疫分子机制奠定实验基础。
1 材料和方法
1.1 实验动物
健康成年Wistar大鼠27只,体重230~250 g,雌雄不限,购自大连医科大学SPF动物实验中心。
1.2 主要试剂及仪器
小鼠抗人HLA I单克隆抗体购自美国Sigma公司;生物素标记IgG、辣根酶标记链酶卵白素及浓缩型DAB(3, 3′-diaminobenzidine, DAB)试剂盒购自北京中杉金桥生物技术公司;Trizol试剂购自美国Invitrogen公司,Revert Aid First Stand cDNA Synthesis Kit购自美国Fermentas公司,2×Taq PCR Master Mix购自北京天根生化科技有限公司。直线加速器(Varian 23EX,美国),正置荧光落射显微镜(Nikon,日本),荧光凝胶成像系统(UVP,美国),PCR仪(Thermo,美国)。
1.3 研究方法
1.3.1 实验动物分组及处理:将27只Wistar大鼠随机分为3组(每组各9只):空白对照组、单纯照射组及照射给药组(腹腔注射苯肾上腺素5 mg/kg,2次/d,连续给药7 d;空白对照组和单纯照射组经腹腔注射等液量生理盐水)。氯胺酮(130 mg/kg)腹腔注射麻醉后,应用直线加速器给予单纯照射组及照射给药组大鼠颌下腺区域X线照射:照射野为3 cm×31 cm,照射靶皮距为100 cm,照射剂量率为5 Gy/min,总剂量为20 Gy。空白对照组仅腹腔注射氯胺酮,未实施照射。照射后7 d,常规麻醉下取大鼠颌下腺组织,分两部分:一部分多聚甲醛固定,石蜡包埋;另一部分液氮冷冻,-80℃保存。进行下列检测。
1.3.2 免疫组织化学(ABC法)染色检测各组大鼠颌下腺MHCⅠ类分子的表达:石蜡切片脱蜡水化;PBS洗3次,各5 min;3%H2O2甲醇溶液室温孵育20 min;PBS洗3次,各5 min;微波中火在枸橼酸盐溶液中煮沸10 min抗原修复;PBS洗3次,各5 min;马血清室温封闭30 min;滴加一抗MHCⅠ类分子(1∶200),37℃孵育1 h后4℃过夜;PBS洗3次,各5 min;生物素标记的二抗室温孵育1 h;PBS洗3次,各5 min;辣根酶标记的链酶卵白素室温下孵育30 min;PBS洗3次,各5 min;DAB显色,苏木素复染,封片。阴性对照使用PBS代替一抗。显微镜下观察阳性细胞表达情况。
1.3.3 RT-PCR检测各组大鼠颌下腺MHCⅠmRNA的表达:取各组大鼠颌下腺组织约100 mg,Trizol法提取总RNA。取5 μg RNA进行RT-PCR。引物根据文献[2]报道并由上海生工生物工程技术服务有限公司合成(表1)。PCR扩增循环:94℃ 30 s,54℃ 60 s和72℃ 60 s;35个循环后72℃ 5 min。PCR产物经1.5%琼脂糖凝胶电泳,DNA green结合后于紫外灯下观察。UVP BioChemi System荧光凝胶成像系统拍照,Quantity One 4.6.2软件对PCR产物进行光密度扫描和分析。
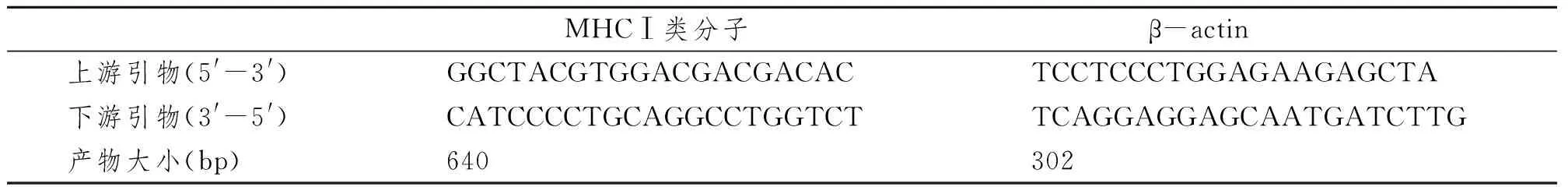
表1 RT-PCR引物序列及产物大小Tab 1 Primers’ sequence and production size used for RT-PCR
1.5 统计学方法
定量数据使用SPSS 13.0软件进行分析,两组间差异显著性比较采用t检验,多组资料分析采用单因素方差检验(One-way ANOVA)。
2 结 果
2.1 免疫组织化学染色结果
大鼠颌下腺腺泡及导管细胞的胞浆和胞膜中棕黄色颗粒为MHCⅠ类分子阳性染色(图1D)。单纯照射组大鼠颌下腺腺泡及导管细胞的胞浆和胞膜中MHC Ⅰ类分子染色较空白对照组明显增加,以胞膜和细胞间质的表达增多尤为显著(图1E)。照射给药组MHCⅠ类分子在腺泡细胞胞膜以及细胞间质中的表达较单纯照射组显著减少(图1F)。

图1 苯肾上腺素对放射损伤后大鼠颌下腺MHCⅠ类分子定位与表达的影响Fig 1 Effect of phenylephrine on the distribution and expression of MHC class Ⅰ in rat submandibular glands after irradiationA:腺泡细胞;D:导管细胞 A,D:空白对照组;B,E:单纯照射组;C,F :照射给药组。A 、B和C: HE染色 ×200; D、E和F:DAB染色 ×200
2.2 RT-PCR结果
单纯照射组MHCⅠ类分子 mRNA的表达较空白对照组增加了45.85%(P<0.05);照射给药组MHCⅠ类分子 mRNA的表达较单纯照射组减少了33.88%(P<0.05)(图2)。
3 讨 论
涎腺由于其解剖位置的特殊性及对放射线的敏感性,在头颈部恶性肿瘤术后放疗过程中常不可避免地受到损伤,导致放射性涎腺炎的发生。组织病理学主要表现为腺泡细胞变性萎缩、细胞水肿和空泡化,导管扩张,间质纤维化和血管内皮细胞改变,单核细胞及淋巴细胞浸润等[4-8]。研究发现,应用苯肾上腺素可显著减轻X线照射后早期和晚期大鼠腮腺损伤,并可维持腮腺的体积、重量和分泌功能与未照射的腺体相似[1]。然而,苯肾上腺素发挥保护涎腺抵御放射损伤的免疫机制国内外尚无文献报道。
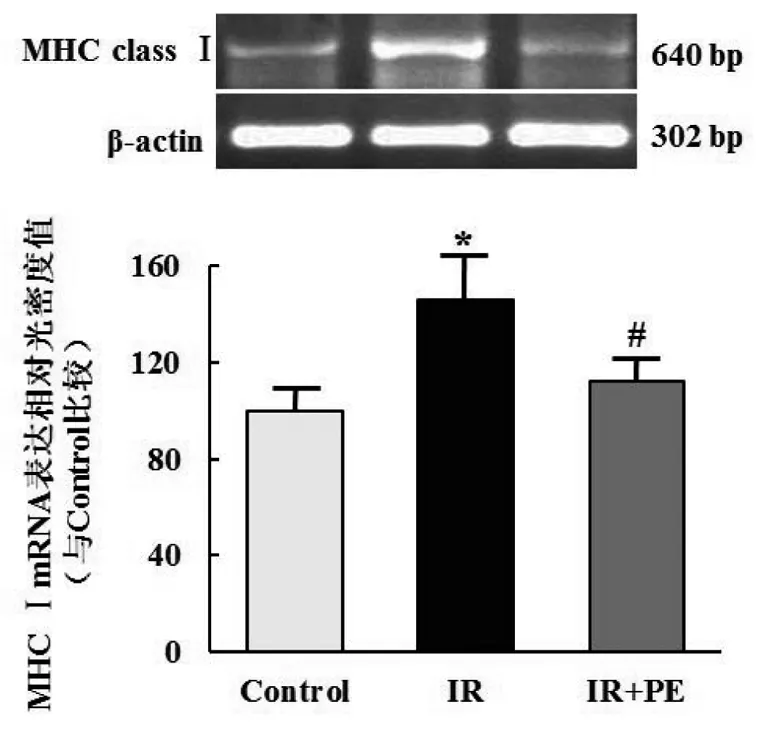
图2苯肾上腺素对放射损伤后大鼠颌下腺MHCⅠmRNA表达的影响
Fig 2 Effect of phenylephrine on the expression of MHCⅠmRNA in rat submandibular glands after irradiation
Control:空白对照组;IR:单纯照射组;IR+PE:照射给药组
*与空白对照组比较,P<0.05;#与单纯照射组比较,P<0.05。
苯肾上腺素在临床主要用于升高血压、减慢心率、抗休克及阵发性室上性心动过速的治疗。然而,其在涎腺中却起不同的作用。在涎腺的生理状态下,α1-AR通路活化,能够介导涎液中水分的主动运输[9]。近年的研究发现,苯肾上腺素对应激状态下涎腺具有两方面作用:涎液分泌促进作用及细胞保护作用[10]。在自体血管化移植家兔颌下腺,苯肾上腺素可上调Bcl-2的表达、下调Bax的表达,抑制caspase-3和p38 MAPK的活化,进而抑制细胞凋亡,减轻移植颌下腺细胞缺血再灌注损伤,保护移植家兔颌下腺[11]。最近的研究还表明,苯肾上腺素激活α1-AR信号通路参与了炎症的自主免疫调节,例如在脂多糖诱导的单核细胞炎症反应中,IL-1β表达降低,而苯肾上腺素可以使IL-1β表达增加,该作用可以被PKC抑制剂所阻断[12]。本课题组前期研究已发现苯肾上腺素可以减轻放射损伤导致的大鼠颌下腺细胞萎缩,本实验进一步探讨此作用是否与α1-AR信号通路激活的免疫调节机制相关。
组成MHC的基因传统上分为Ⅰ类、Ⅱ类和Ⅲ类分子,近年来倾向于分为两类:一是经典的MHCⅠ类和Ⅱ类基因,它们的产物具有抗原提呈功能,直接参与T细胞的激活和分化,调控特异性免疫应答;二是免疫功能相关基因,包括传统的Ⅱ类基因,以及除经典的Ⅰ类和Ⅱ类基因之外的新近确认的多种基因,它们主要参与调控固有免疫应答[13]。MHC Ⅰ类分子表达分布于大部分组织细胞表面,为α链与β2微球蛋白组成的异二聚体,8条反向平行的β折叠链及2条平行的α螺旋共同构成的抗原结合槽,其内可结合8~11个氨基酸残基的多肽,其化学成分是糖蛋白或脂蛋白,可通过与细胞间共刺激分子的协同作用,促进T淋巴细胞对内源性抗原的识别,从而杀伤靶细胞。
本实验发现,20 Gy X射线照射大鼠颌下腺后,MHC Ⅰ类分子蛋白质在腺泡细胞及导管细胞的胞浆和胞膜表达均增加,尤其以胞膜基底部和细胞间质的表达增加更为显著,提示MHC Ⅰ类分子可能在颌下腺受到放射损伤后发挥了抗原提呈的作用;RT-PCR结果从转录水平进一步证明了放射线损伤导致大鼠颌下腺MHC Ⅰ mRNA表达丰度明显增加。从而,从基因和蛋白质水平共同首次证明了放射线对颌下腺的损伤机制与免疫应答相关。本研究结果与Reits等[14]应用γ射线照射小鼠黑素瘤细胞及HLA-A2转基因小鼠肾细胞后发现MHC Ⅰ类分子表达均增加的结论相一致。放射线对颌下腺照射损伤后,连续给予苯肾上腺素7 d,MHC Ⅰ类基因和蛋白质在转录和翻译水平均发生了降低,提示苯肾上腺素减轻颌下腺细胞的放射线损伤的机制可能与α1-AR信号分子通路活化后介导的相关免疫调节机制相关。在本实验中,大鼠颌下腺经放射线照射后,MHC Ⅰ类分子的表达上调,可能增强了腺泡细胞和导管细胞向TC细胞提呈抗原的作用,从而促进TC细胞杀伤靶细胞的能力;而苯肾上腺素可能是通过下调MHC Ⅰ类分子的表达,减弱TC细胞对自身颌下腺细胞的识别及杀伤作用,从而起到对放射损伤早期颌下腺细胞的保护作用。然而,由于机体抗原提呈作用的发挥还需要其他辅助分子如Calnexin、ERp57、Calreticulin和Tapasin等的共同参与,因此,α1-AR活化在涎腺放射损伤中介导的相关免疫分子机制还需进一步研究。本研究将为从免疫分子水平寻找防治涎腺细胞放射损伤的新方法奠定实验基础。
[1] Coppes RP, Zeilstra LJ, Kampinga HH, et al. Early to late sparing of radiation damage to the parotid gland by adrenergic and muscarinic receptor agonists [J]. Br J Cancer, 2001, 85(7): 1055-1063.
[2] Hirozane A, Fujikura Y, Sawada T, et al. Analysis of major histocompatibility complex (MHC) class Ⅰ antigen in the rat salivary gland [J]. Arch Oral Biol, 1992, 37(2): 147-151.
[3] Matthews JB, Mason GI, Lawrence GM. Epithelial expression of major histocompatibility complex (MHC) antigens in normal rat salivary and lacrimal glands [J]. Arch Oral Biol, 1992, 37(2): 93-97.
[4] Urek M, Bralic M, Tomac J, et al. Early and late effects of X-irradiation on submandibular gland: a morphological study in mice [J]. Arch Med Res, 2005, 36(4): 339-343.
[5] Xu J, Yan X, Gao R, et al. Effect of irradiation on microvascular endothelial cells of parotid glands in the miniature pig [J]. Int J Radiat Oncol Biol Phys, 2010, 78(3): 897-903.
[6] Yu Y, Wu YW, Hao T, et al. Effects of radiation on the expression of nerve growth factor in rat submandibular gland [J]. Chin J Dent Res, 2010, 13(2): 127-132.
[7] Sullivan CA, Haddad RI, Tishler RB, et al. Chemoradiation-induced cell loss in human submandibular glands [J]. Laryngoscope, 2005, 115(6): 958-964.
[8] Chen FH, Chiang CS, Wang CC, et al. Radiotherapy decreases vascular density and causes hypoxia with macrophage aggregation in TRAMP-C1 prostate tumors [J]. Clin Cancer Res, 2009, 15(5): 1721-1729.
[9] Garrett JR, Ekstr m J, Anderson LC. Neural mechanisms of salivary gland secretion [M]. Vol.11. London: Front Oral Biol, 1999. 44-58.
[10] 向彬,张艳,李玉明,等.α1-肾上腺素受体在颌下腺的表达及苯肾上腺素对唾液分泌调节的动物实验 [J].中华口腔医学杂志,2007,42(2):114-117.
[11] Xiang B, Zhang Y, Li YM, et al. Phenylephrine protects autotransplanted rabbit submandibular gland from apoptosis [J]. Biochem Biophys Res Commun, 2008, 377(1): 210-214.
[12] Grisanti LA, Woster AP, Dahlman J, et al. α1-adrenergic receptors positively regulate Toll-like receptor cytokine production from human monocytes and macrophages [J]. J Pharmacol Exp Ther, 2011, 338(2): 648-657.
[13] 陈慰峰. 医学免疫学 [M].第4版.北京:人民卫生出版社,2007. 77.
[14] Reits EA, Hodge JW, Herberts CA, et al. Radiation modulates the peptide repertoire, enhances MHC class Ⅰ expression, and induces successful antitumor immunotherapy [J]. J Exp Med, 2006, 203(5): 1259-1271.

