体外培养不同代角膜缘干细胞特性分析△
李翠霞 洪晶 曲洪强
体外培养不同代角膜缘干细胞特性分析△
李翠霞 洪晶 曲洪强
[Rec Adv Ophthalmol,2012,32(7):601-605]
角膜缘干细胞;细胞移植;ABCG2;p63;CK3
目的比较不同代角膜缘干细胞的生物学特性,为角膜缘细胞移植在临床中的应用提供依据。方法组织块培养法体外培养角膜缘干细胞,光镜观察、HE染色和免疫荧光染色分析原代、第1代和第2代角膜缘细胞形态学特性;流式细胞技术定量检测原代、第1代和第2代角膜缘细胞ABCG2表达;MTT比色法测定体外培养原代、第1代和第2代角膜缘干细胞的增殖活性变化。结果倒置相差显微镜下可见原代细胞培养24 h有单个细胞从组织块边缘迁出,48 h细胞局部可见拉网样生长趋势,72 h出现大片细胞,细胞呈现多边形或多角形,96 h细胞几乎铺满整个培养板。随着传代次数的增加,细胞形态变得不规则,CK3单克隆抗体表达阳性率逐渐增强;p63单克隆抗体原代和第1代细胞间表达阳性率无明显差别,第2代细胞表达量明显减弱。流式细胞检测显示原代、第1代和第2代细胞ABCG2表达阳性率分别为13.41%、22.96%和4.43%。MTT结果显示随传代次数增加细胞增殖活性逐渐下降。结论原代和第1代角膜缘干细胞可以作为制备组织工程角膜上皮细胞膜片的较理想种子细胞。
[眼科新进展,2012,32(7):601-605]
角膜缘干细胞(limbal stem cells,LSC)是角膜上皮细胞的再生来源。Schermer等[1]首次通过实验证明,LSC是位于Vogt栅栏区(pallsades of Vogt)乳头状结构中的角膜缘基底细胞,具有长周期、低分化、高增生潜能及不对称分裂等生物学特性。LSC通过不断移行和增殖来完成对角膜上皮细胞的更新和创伤的修复,在维持眼表结构完整性和保持角膜透明性方面起着至关重要的作用[2-3]。LSC缺乏疾病是一种以LSC缺乏或功能障碍为特征的疾病,在临床中特别常见,其原因主要以眼部化学伤或热烧伤、Stenven-Johnson综合征、手术创伤和药物毒性为常见,是致盲性非常高的眼病之一[4-6]。对此种疾病的治疗,目前临床多采用体外培养的自体/异体角膜缘上皮细胞移植,进行眼表重建。此方法相对于传统的LSC移植,要求取材材料小,对供体造成的损伤轻,体外扩增允许小量材料治疗大范围的LSC缺失[7-9]。但是,目前角膜缘上皮细胞移植治疗LSC疾病的效果并不稳定,原代细胞很难获取且不能持久维持角膜上皮细胞的更新,因此,如何提高患者移植术后的临床效果成为目前研究的热点问题。Rama等[10]报道术后移植效果与LSC的质量有很大关系,那么如何方便获取既能保持角膜缘上皮细胞原有特性又含有较多LSC的种子细胞成为角膜缘上皮移植成功的关键。因此,在本实验中,我们通过对不同代角膜缘细胞的形态学、细胞蛋白表达及LSC含量等方面进行分析,寻找适合LSC移植的种子细胞,为角膜缘上皮细胞移植在临床方面的应用提供新的思路。
1 材料与方法
1.1 材料
1.1.1 实验动物健康成年新西兰大白兔30只(由北京大学医学部实验中心提供),雌雄不限,体质量1.0~1.5 kg。
1.1.2 主要试剂和仪器ABCG2单克隆抗体(美国MILLIPORE公司),细胞角蛋白(cytokeratin,CK)3单克隆抗体(美国MILLIPORE公司),ANTI-BCRP1 FITC(美国MILLIPORE公司),黏蛋白5AC (MUC5AC)单克隆抗体(美国Abcam公司),MTT(美国SCICREST BIOTECH公司)。倒置相差显微镜(OLIMPUS,日本),CO2培养箱(MCO-18AIC,SANYO公司,日本),流式细胞仪(BD公司,美国),酶标仪(SLT.SPETRAN公司,德国),共聚焦显微镜(Zeiss公司,美国),荧光显微镜(OLIMPUS公司,日本)。
1.2 实验方法
1.2.1 LSC的原代培养采用组织块培养法。将兔子以过量乌拉坦静脉注射处死后,用碘伏棉球消毒眼睑周围3次,迅速取出眼球,在显微镜下去除眼球周围肌肉组织,生理盐水冲洗3次。在无菌条件下将处理后的眼球用含硫酸妥布霉素的生理盐水(硫酸妥布霉素注射液∶生理盐水=1∶20配制)浸泡2次,每次15 min;剪下角膜片,去除结膜、虹膜等组织,在体视显微镜下剪去角膜中央部分。无菌条件下将兔角膜缘组织剪成约1 mm×2 mm的组织块,将3~5枚组织块蘸取少量培养基后上皮细胞面向下置于培养皿中,放入37℃、体积分数5%CO2培养箱中培养,2 h后待其贴附良好时加入适量含体积分数10%胎牛血清的DMEM/F12培养液,继续置于恒温CO2培养箱中培养。每2 d更换1次培养基,每日在倒置相差显微镜下观察细胞生长情况并拍照记录。
1.2.2 LSC的传代培养当细胞生长达到培养板的80%~90%时,PBS冲洗2次后,加入适量胰蛋白酶与细胞充分接触2~3 min,待细胞变圆、细胞连接松弛时,加入含体积分数10%胎牛血清的培养基终止消化,吸管吹打使细胞脱离培养皿底,收集细胞悬液,1000 r·min-1离心8 min,按照1∶2的比例接种于细胞培养皿及涂有多聚赖氨酸的细胞爬片上待测,每2 d更换1次培养基,待细胞融合后,以同样方式继续传代。
1.2.3 细胞形态学观察倒置相差显微镜下观察各代LSC的爬出过程及生长状态,并将不同代数LSC固定(体积比为甲醇∶丙酮=1∶1),进行HE染色,显微镜下观察并拍照。
1.2.4 LSC功能蛋白的表达细胞免疫荧光检测:用固定液(体积比为甲醇∶丙酮=1∶1)固定细胞爬片10 min,将固定后的LSC爬片用PBS洗3次,然后用进口山羊血清封闭液封闭爬片30 min,分别加入CK3(1∶100)、ABCG2(1∶100)、p63(1∶50)、MUC5AC(1∶100)单克隆抗体,并以PBS代替一抗设阴性对照,4℃过夜孵育后分别加入IgG荧光二抗,室温孵育1 h,DAPI复染细胞核,封片后激光共焦显微镜观察并照相,鉴定培养细胞CK3、p63、ABCG2及MUC5AC(1∶100)单克隆抗体的表达并拍照。
1.2.5 流式细胞仪检测将原代和传代后的LSC培养至形成单层,PBS洗2次,胰蛋白酶消化,1000 r·min-1离心8 min后,制成细胞悬液,用牛血清孵育30 min,1000 r·min-1离心8 min后,细胞计数,然后每106细胞加入ABCG2-FITC单克隆抗体10 μL进行标记,孵育30 min,每10 min摇匀1次,PBS洗2次,过细胞筛,流式细胞检测仪检测LSC ABCG2-FITC单克隆抗体在培养细胞中所占的比例,比较原代和传代后LSC ABCG2-FITC单克隆抗体的含量变化。
1.2.6 MTT比色法测细胞活性将50 mg MTT溶于10 mL PBS中,用0.22 μm滤膜过滤后配制新鲜MTT液。细胞达到对数生长期时,消化、离心细胞,按照每孔2000个细胞的密度接种于96孔板,分别设12 h、24 h、48 h、72 h共4个时间点,每个时间点设5个复孔。每个时间点分别加入5 g·L-1MTT溶液20 μL,CO2培养箱中继续孵育4 h后小心吸弃孔内培养液,每孔加入150 μL DMSO,脱色摇床振荡10 min,酶标仪测定各孔吸光度(A)值,参考波长为490 nm。以时间为横坐标,OD值为纵坐标绘制各代细胞的生长曲线图,比较原代和传代细胞的增殖活性。
2 结果
2.1 培养细胞形态学观察角膜缘组织块在置于培养皿上2~3 h后贴附良好。倒置相差显微镜下可见,24 h后有细胞从组织块边缘个体迁移,贴壁生长,呈多边形,体积较小,48 h后细胞局部可见拉网样生长趋势,72 h后出现大片细胞,细胞呈现多边形或多角形,96 h细胞几乎铺满整个培养板(图1)。显微镜下可见3种细胞形态:(1)圆形、卵圆形,类似基底的柱状细胞,核浆比大;(2)多边形,类似翼状细胞;(3)大而扁平状,类似表层上皮细胞。细胞以卵圆形或多边形为主,多为2~3个核仁,部分可见丝状骨架结构。
显微镜下可见,原代细胞生长状态良好,细胞以多边形及卵圆形为主,可见双核细胞、多核细胞及核分裂相,细胞间连接紧密;传代后第1代细胞呈规则多边形,可见双核细胞,细胞间连接紧密,类似上皮样细胞,可见少量纤维细胞;第2代细胞形态呈不规则状,几乎无双核细胞,无细胞间连接,完全失去上皮细胞的特性(图2)。

Figure 1 Observation of LSC with P0 at different time under inverted phase contrast microscope.A:At 24 hours,a few LSC migrated out from the cultured tissue edge;B:At 48 hours,the cells grew in mesh;C:At 72 hours,the cells grew in a sheet;D:At 96 hours,the cells grew in confluence(×200)原代培养细胞不同时间倒置相差显微镜下观察。A:原代培养24 h后,可见少量细胞从组织块边缘迁移出来;B:原代培养48 h后,细胞局部呈拉网样生长;C:原代培养72 h后,细胞成片爬出;D:原代培养96 h后,细胞几乎铺满整个培养板(×200)

Figure 2 Growth of LSC with different passages.A:LSC with P0 under inverted phase contrast microscope;B:LSC with P1 under inverted phase contrast microscope;C:LSC with P2 under inverted phase contrast microscope;D:HE staining of LSC with P0;E:HE staining of LSC with P1;F:HE staining of LSC with P2(×100)培养的不同代LSC生长情况。A:倒置相差显微镜下原代LSC;B:倒置相差显微镜下第1代LSC;C:倒置相差显微镜下第2代LSC;D:原代LSC HE染色图像;E:第1代LSC HE染色图像;F:第2代LSC HE染色图像(×100)
2.2 培养细胞免疫荧光染色和检测结果
2.2.1 细胞免疫荧光染色经鉴定,培养的细胞CK3、ABCG2、p63单克隆抗体染色均呈阳性,MUC5AC单克隆抗体染色呈阴性,证明为LSC细胞(图3)。原代LSC CK3单克隆抗体间接免疫荧光染色多数细胞不着色,少数细胞着色,细胞质呈红色荧光,细胞核呈蓝色荧光;第1代LSC CK3染色阳性细胞较原代细胞增多,第2代LSC CK3染色阳性细胞进一步增多。原代LSC p63单克隆抗体表达有很高的阳性率,圆形及卵圆形细胞的细胞核均呈红色荧光;第1代LSC p63的表达与原代细胞无明显差异,第2代LSC p63的表达明显下降(图3-4)。

Figure 3 Identification of LSC.A:Immunofluorescence staining of CK3;B:Immunofluorescence staining of ABCG2;C:Positive immunofluorescence staining of p63;D:Immunofluorescence staining of MUC5AC(×200)LSC的鉴定。A:细胞CK3免疫荧光染色;B:细胞ABCG2免疫荧光染色;C:细胞p63免疫荧光染色;D:细胞MUC5AC免疫荧光染色(×200)
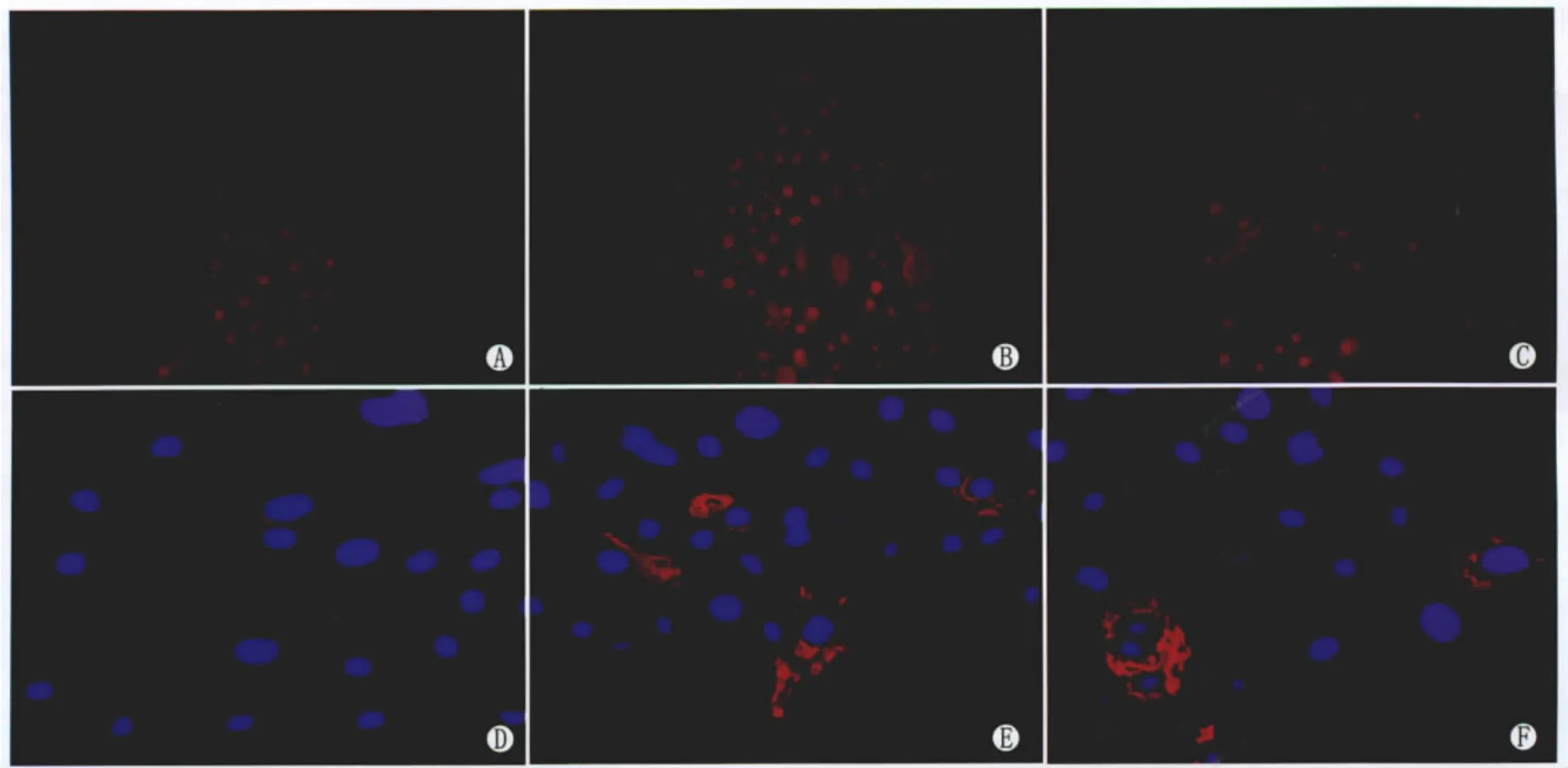
Figure 4 Immunofluorescence staining of CK3 and p63 in LSC with different passages.A:Immunofluorescence staining of p63 protein in LSC with P0;B:Immunofluorescence staining of p63 protein in LSC with P1;C:Immunofluorescence staining of p63 protein in LSC with P2;D:Immunofluorescence staining of CK3 protein in LSC with P0;E:Immunofluorescence staining of CK3 protein in LSC with P1;F:Immunofluorescence staining of CK3 protein in LSC with P2(×200)不同代LSC CK3和p63的免疫荧光染色。A:原代细胞p63的免疫荧光染色;B:第1代细胞p63免疫荧光染色;C:第2代细胞p63免疫荧光染色;D:原代细胞CK3免疫荧光染色;E:第1代细胞CK3免疫荧光染色;F:第2代细胞CK3免疫荧光染色(×200)
2.2.2 流式细胞仪检测流式细胞仪检测结果显示,原代、第1代和第2代LSC ABCG2单克隆抗体阳性率分别为13.41%、22.96%和4.43%。
2.3 细胞增殖活性检测传代后细胞与原代细胞比较生长曲线有明显的下降,而且原代细胞有明显的细胞增长期,但第1代细胞生长曲线对数增长期不明显,第2代细胞几乎无增长期。各代细胞增殖活性差别显著(图5)。
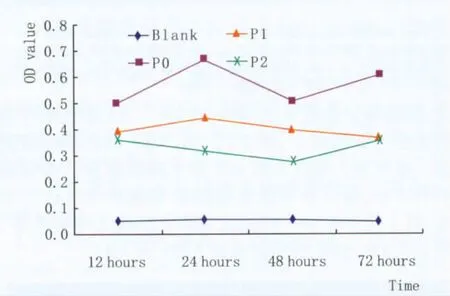
Figure 5 Proliferative activity examination of LSCLSC增殖活性检测
3 讨论
3.1 LSC的培养目前,LSC的培养方法主要有酶消化培养法和组织块培养法[11],其中,组织块培养法应用最为广泛。Short等[12]通过比较酶消化培养法和组织块培养法表明,组织块培养法培养的细胞能更好地保持细胞原有形态,具有更多的桥粒连接和更紧密的细胞连接,能更好的保持角膜上皮细胞的功能。有文献报道,组织块培养法培养的LSC并不是单一的细胞,而是混合细胞,细胞包含一定量的LSC、短暂扩充细胞、分化的角膜上皮细胞及少量纤维细胞。在本实验中,利用组织块培养法体外培养兔角膜缘上皮组织,培养4 d左右可达到80%~90%的融合状态,说明培养的角膜缘上皮细胞具有较强的分裂增殖能力;另外,形态学上细胞具有体积小,圆形或卵圆形,可见双核细胞、多核细胞及核分裂相,细胞间连接紧密等原始细胞生物学特性,说明组织块培养法培养的LSC具备作为LSC移植的种子细胞的特点。
3.2 LSC的鉴定现阶段国内外对LSC的基础研究仍然很薄弱,尤其是在LSC的标记物方面,迄今为止尚未找到一种LSC特异性表达分子标记物[1,6,13-14],因此,只能选择几种目前比较确切的标记物组合如ABCG2、p63、CK3来鉴定LSC;在LSC中ABCG2、p63表达呈阳性,而CK3表达为阴性。ABCG2蛋白在细胞膜和细胞浆内表达,阳性表达细胞分布于角膜缘上皮基底层的小细胞簇,其增生能力显著高于阴性细胞,最符合角膜上皮干细胞的特征。p63为一种核蛋白,表达于全角膜的基底层和基底细胞上层,其阳性表达是角膜缘强增殖能力细胞的标志[1,6,13-16]。CK3是一组非水溶性细胞骨架蛋白,在角膜上皮细胞特异地表达,被认为是角膜上皮分化细胞的标记物;然而CK3角膜基底层细胞不表达,呈现未分化的自然状态,为LSC鉴定的阴性标志物。MUC5AC是结膜细胞特异性表达标记物。本研究免疫荧光染色结果显示,培养的细胞CK3、ABCG2、p63抗体均呈阳性表达,而MUC5AC单克隆抗体为阴性表达,说明培养的细胞为角膜分化上皮细胞、LSC和短暂扩充细胞的混合细胞,且无结膜细胞的污染。本研究结果显示,p63在大部分原代细胞中表达阳性,第1代细胞p63表达与原代细胞比较无明显差异,而第2代细胞p63表达明显下降;CK3仅在少量原代细胞中表达,随着传代次数增加CK3表达阳性率逐渐增加。综合分析后表明,原代和第1代细胞能较好地保持LSC特性,可作为临床角膜缘上皮细胞移植的种子细胞。
3.3 LSC含量的测定荧光标记LSC表面标记物表达阳性的细胞,再运用流式细胞术将被标记细胞分选出来是干细胞分选最常用的方法之一[4,14,17-18]。ABCG2蛋白被认为是最能代表LSC生物学特性的标记物。通过多次重复实验,在原代、第1代和第2代细胞中ABCG2单克隆抗体表达阳性率分别为13.41%、22.96%和4.43%。分析结果表明,原代和第1代LSC ABCG2的表达量均较高,且第1代表达高于原代细胞。可能的原因为第1代细胞通过传代去除了更多的杂细胞,细胞进一步纯化使ABCG2表达增强。结合细胞形态学和细胞免疫荧光染色结果分析,体外培养原代和第1代LSC更好地保持了正常LSC的生物学特性,适合应用于临床制备LSC移植膜片。
综上所述,组织块培养法体外培养角膜缘上皮细胞原代和第1代细胞生长状态良好,增殖活性高,LSC含量多,且更好的保持了正常LSC的生物学特性,因此可作为临床制备LSC移植膜片的种子细胞,提高LSC移植后的临床效果。
1 Schermer A,Galvin S,Sun TT.Differentiation-related expression of a major 64K corneal keratin in vivo and in culture suggests limbal location of corneal epithelial stem cells[J].J Cell Biol,1986,103(1):49-62.
2 Schlotzer-Schrehardt U,Kruse FE.Identification and characterization of limbal stem cells[J].Exp Eye Res,2005,81(3):247-264.
3 李翠霞,孙荔,洪晶.低温冷冻对角膜缘干细胞生物学特性的影响[J].眼科,2010,19(3):189-193.
4 Tseng SC,Meller D,Anderson DF,Touhami A,Pires RT,Gruterich M,et al.Ex vivo preservation and expansion of human limbal epithelial stem cells on amniotic membrane for treating corneal diseases with total limbal stem cell deficiency[J].Adv Exp Med Biol,2002,506(Pt B):1323-1334.
5 Talbot M,Carrier P,Giasson CJ,Deschambeault A,Guerin SL,Auger FA,et al.Autologous transplantation of rabbit limbal epithelia cultured on fibrin gels for ocular surface reconstruction[J].Mol Vis,2006,12(1):65-75.
6 O’Sullivan F,Clynes M.Limbal stem cells,a review of their identification and culture for clinical use[J].Cytotechnology,2007,53(1-3):101-106.
7 Levis H,Daniels JT.New technologies in limbal epithelial stem cell transplantation[J].Curr Opin Biotechnol,2009,20(5):593-597.
8 Tseng SC,Chen SY,Shen YC,Chen WL,Hu FR.Critical appraisal of ex vivo expansion of human limbal epithelial stem cells[J].Curr Mol Med,2010,10(9):841-850.
9 Satake Y,Higa K,Tsubota K,Shimazaki J.Long-term outcome of cultivated oral mucosal epithelial sheet transplantation in treatment of total limbal stem cell deficiency[J].Ophthalmology,2011,118(8):1524-1530.
10 Rama P,Matuska S,Paganoni G,Spinelli A,De Luca M,Pellegrini G.Limbal stem-cell therapy and long-term corneal regeneration[J].N Engl J Med,2010,363(2):147-155.
11 张晓敏,孙慧敏,赵少贞,李筱荣,孙靖,袁佳琴.兔角膜缘干细胞两种培养方法的比较[J].眼科研究,2005(6):575-578.
12 Short AJ,Secker GA,Rajan MS,Meligonis G,Dart JK,Tuft SJ,et al.Ex vivo expansion and transplantation of limbal epithelial stem cells[J].Ophthalmology,2008,115(11):1989-1997.
13 Schlotzer-Schrehardt U,Kruse FE.Identification and characterization of limbal stem cells[J].Exp Eye Res,2005,81(3):247-264.
14 de Paiva CS,Chen Z,Corrales RM,Pflugfelder SC,Li DQ.ABCG2transporter identifies a population of clonogenic human limbal epithelial cells[J].Stem Cells,2005,23(1):63-73.
15 Joseph A,Powell-Richards AO,Shanmuganathan VA,Dua HS.Epithelial cell characteristics of cultured human limbal explants[J].Br J Ophthalmol,2004,88(3):393-398.
16 Watanabe K,Nishida K,Yamato M,Umemoto T,Sumide T,Yamamoto K,et al.Human limbal epithelium contains side population cells expressing the ATP-binding cassette transporter ABCG2[J].Febs Lett,2004,565(1-3):6-10.
17 Sun TT,Tseng SC,Lavker RM.Location of corneal epithelial stem cells[J].Nature,2010,463(7284):E10-11.
18 Tsai RJ,Tsai RY.Ex vivo expansion of corneal stem cells on amniotic membrane and their outcome[J].Eye Contact Lens,2010,36(5):305-309.
Characteristicanalysisofcorneallimbal stem cells with different passages in vitro
LI Cui-Xia,HONG Jing,QU Hong-Qiang
corneal limbal stem cells ;cell transplantation;ABCG2;p63;CK3
ObjectiveTo compare the biological characteristics of corneal limbal stem cells(LSC)with different passages,and provide the basis for LSC application in transplanation surgery.MethodsLSC were cultured in vitro.Morphological characteristics of LSC with different passages(P0,P1 and P2)were compared by light microscopy,HE staining and immunofluorescence.The quantitative expression of ABCG2in LSC with different passages(P0,P1 and P2)was examined by flow cytometry,and the proliferative activity of LSC with different passages(P0,P1 and P2)was determined by MTT.ResultsAt 24 hours,a few LSC migrated out from the cultured tissue edge;At 48 hours,the cells grew in mesh;At 72 hours,the cells grew in a sheet;At 96 hours,the cells grew in confluence.The morphology of LSC changed irregularly after several passaged.The number of CK3 positive cells increased,and the expression of p63 had no obvious difference between P0 and P1,however,it became weaker in P2;Flow cytometry test showed that the ABCG2positive expression in cell with P0,P1 and P2 were 13.41%,22.96%and 4.43%,respectively.MTT results demonstrated that the cellular proliferative activity gradually reduced after several passaged.ConclusionThe LSC with P0 and P1 are suitable as ideal seed cells for making corneal epithelium grafts during corneal tissue engineering.
date:Mar 10,2012
date:Apr 10,2012
NationalNatural Science Foundation ofChina(No: 31140025)
Responsible author:HONG Jing,E-mail:hongjing1964@sina.com
李翠霞,女,1984年9月出生,河北人,在读硕士研究生。联系电话:010-82266601(O);E-mail: kuailecuixia@163.com
About LI Cui-Xia:Female,born in September,1984.Tel:+86-10-82266601(O);E-mail:kuailecuixia@ 163.com
2012-03-10
2012-04-10
本文编辑:盛丽娜
国家自然科学基金资助(编号:31140025)
100191北京市,北京大学第三医院眼科
洪晶,E-mail:hongjing 1964@sina.com
From the Department of Ophthalmology,Peking University Third Hospital,Beijing 100191,China
【文献综述】
