香菜中天然抑菌成分的提取及其抑菌效果研究
潘红艳,高 唯,宫智勇
(武汉工业学院食品科学与工程学院,湖北武汉430023)
香菜(Coriandrum Sativu L.)学名芫荽。又名胡荽、香荽,属伞形科一年或二年生草本喜冷凉的绿叶蔬菜,耐寒性很强[1-2]。香菜在我国南北各地都有栽培,但是,我国的香菜生产一直以菜用为主,人们对香菜研究方面,只重视香菜作为蔬菜资源的栽培和育种研究,从香菜的利用方面可以发现,香菜在食品中的应用研究多处于初加工阶段,在天然抑菌剂方面未得到很好的开发应用[3-5]。
对于香菜成分的分析,陆占国等[6-7]采用气相色谱/质谱(GC/MS)对水蒸汽蒸馏得到的黑龙江产芜荽茎叶精油的芳香成分进行了分析。共检测出86个成分,其中49种被鉴定,占总成分的87.907%。醇类和醛类化合物最多,分别为39.598% 和31.955%;酯类化合物3.939%;碳水化合物6.582%。
对于香菜功能性的研究有周凌霄等[8-9]对香菜中所含抑菌成分进行了抑菌作用的初步研究,表明香菜浸出汁对部分细菌和霉菌的生长有较强的抑制作用,但是具体是什么成分起到的抑菌作用尚未明确,有待进一步研究。
实验探讨了乙醇提取法对于香菜中抑菌成分的提取效果,并研究了提取物对金黄色葡萄球菌和大肠杆菌的抑制作用,为香菜功能食品的开发提供一定依据。
1 材料和方法
1.1 材料
原料香菜(购置于武商量贩,4℃冰箱保存)。
试验用菌种:细菌金黄色葡萄球菌(Staphyloccocus aureus Rosenbach);大肠杆菌(E.coli)(由华中科技大学同济医学院提供)。
培养基配制:牛肉膏3 g,蛋白胨5 g,氯化钠3 g,琼脂 20 g,自来水1000 mL,调节 pH 7.2—7.4,灭菌 1.05 kg/cm2,25—30 min
1.2 仪器和设备
Ar2140型电子天平(上海精密科学仪器有限公司);旋转蒸发器RE52CS(上海亚荣生化仪器厂);HH-2数显恒温水浴锅(国华电器有限公司生产);冰箱BCD-207H(海信(北京)电器有限公司);高压灭菌锅(上海申安医疗器械厂);SW-CJ-2FD型双人单面净化工作台(苏州净化设备有限公司)。
1.3 试剂
无水乙醇(分析纯,天津市科密欧化学试剂有限公司)。
1.4 方法
1.4.1 香菜中抑菌成分的提取
将香菜洗净沥干,准确称取5 g,加无水乙醇溶液提取,提取液过滤后浓缩至干,残渣加水溶解配成抑菌实验所需原液(原液指1 mL提取液中含有1 g香菜材料的提取物)。
1.4.2 药敏纸片的制备
选用1号定性滤纸,用打孔机制作约为0.6 cm的圆片[10-11],置平皿内干热灭菌(170℃,90 min)取出后分装于灭菌锥形瓶内。放入质量浓度为1 g/ml的提取液中,浸泡12 h。
1.4.3 菌悬液的制备
接种环分别取金黄色葡糖球菌、大肠杆菌各1—2环接入装有1 mL生理盐水的灭菌试管中,充分混匀,制成菌悬液。
1.4.4 制平板
取灭菌过的平皿,按无菌操作法[12-13]分别倒入已融化的培养基各20 mL,摇匀,置水平位置使其凝固成平板。
1.4.5 提取物抑菌效力的测定-滤纸片扩散法
将经选择好菌液浓度的各试验菌菌液0.1 mL加入已倒好的平皿培养基中,涂布均匀,将已制备好的香菜原液滤纸片放入含菌平皿上,然后用无菌水作为对照。经37℃,24 h培养、每菌三组培养皿,量取抑菌圈直径,取平均值[15]。
1.4.6 抑菌成分提取方法的实验研究
为了探索提取工艺条件与提取物抑菌效果的关系,重点对香菜的提取温度A(30℃,40℃,50℃,60 ℃,70 ℃),提取时间 B(6 h,12 h,24 h,36 h,48 h)及提取剂料液比(溶剂/香菜 V/V=3∶1,6∶1,9∶1,12∶1,15∶1)等工艺参数做单因素实验,根据单因素实验结果选用L9(34)正交试验方案进行防腐物质的提取。然后按1.4.5的方法测定各组对各试验菌的抑菌效力并计算抑菌圈总值,作为判断各组位次的指标。
2 结果与分析
香菜提取物原液抑菌效力试验结果见表1。
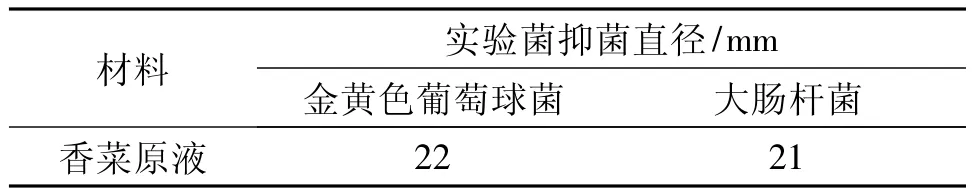
表1 香菜提取液原液对试验菌的抑菌效力比较
由表1可见,香菜原液对金黄色葡萄球菌的抑菌直径为22 mm,对大肠杆菌的抑菌直径为21 mm。根据NCCLS部分标准规定[17],抗微生物药物四环素的纸片含药量为30 μg时的抑菌直径为金黄色葡萄球菌≥19 mm,大肠杆菌≥19 mm,由此可见,香菜粗提物具有较好的抑菌效果。
2.1 香菜提取条件单因素结果与分析
提取温度对香菜抑菌效果的影响见图1。由图1可看出,当提取时间、提取溶剂料液比固定时,在提取温度为50℃时,香菜提取物的抑菌效果最好,温度升高时,其提取物的抑菌效果明显下降,可能由于温度导致了抑菌成分的改变,同时提取成分中所含有效成分也可能随着温度升高而蒸发。
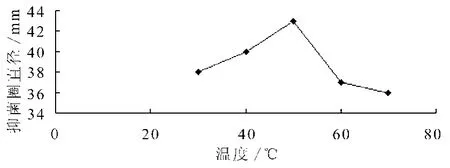
图1 提取温度对香菜提取液抑菌效果的影响
提取时间对香菜抑菌效果的影响见图2。由图2可看出,当提取温度、提取溶剂料液比固定时,提取时间为24 h香菜提取物的抑菌效果最佳,提取时间的延长可导致香菜的抑菌效果略微降低,说明香菜中所含抑菌成分在24 h时可基本浸出,随着时间延长可能会使有效抑菌成分部分挥发。
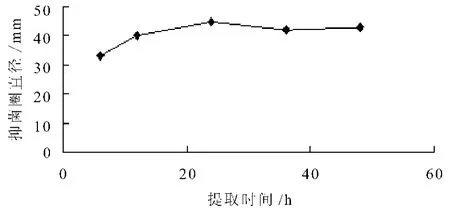
图2 提取时间对香菜抑菌效果的影响
提取溶剂料液比对香菜抑菌效果的影响见图3。由图3可看出,当提取温度和提取时间固定时,在提取溶剂料液比为12∶1(体积比)时,提取物的抑菌效果最佳,溶剂继续增加对香菜抑菌成分提取没有显著影响。

图3 提取溶剂料液比对香菜抑菌效果的影响
2.2 香菜抑菌成分提取L9(34)正交试验方案及结果
以提取温度、提取时间和料液比三个因素做正交实验,确定香菜抑菌成分提取的最佳条件。实验因素水平见表2,试验结果见表3。

表2 正交实验因素水平表
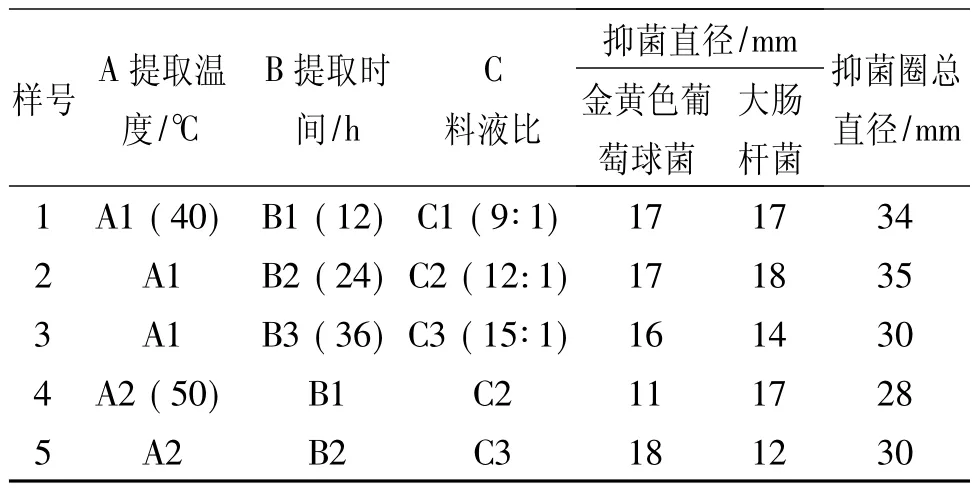
表3 香菜抑菌成分提取L9(34)正交试验方案和结果分析
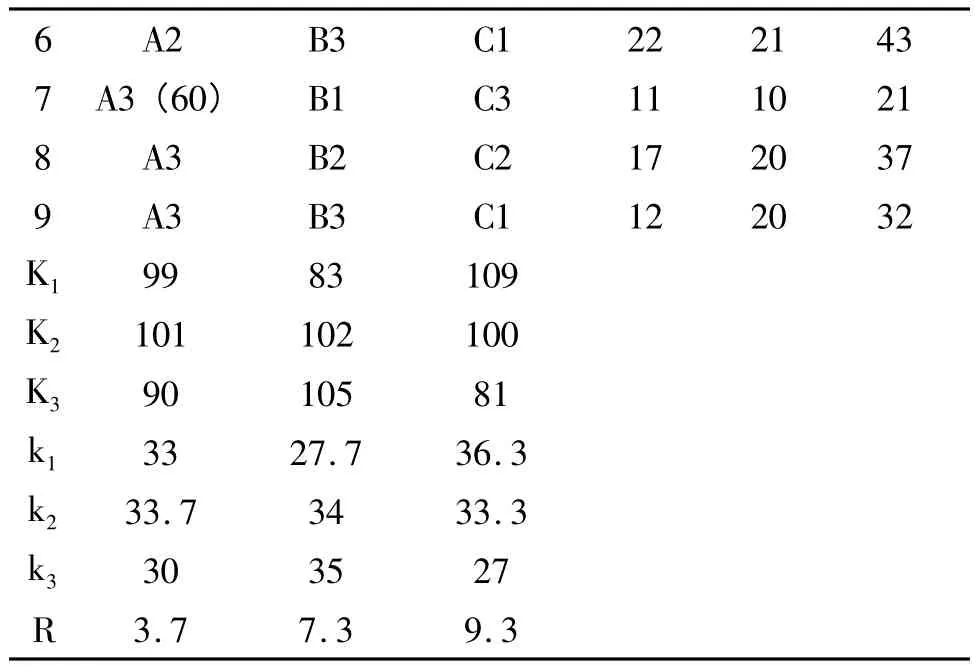
续表3
由表2可知,影响香菜抑菌成分提取的主次顺序为料液比(C)>提取时间(B)>提取温度(A),提取香菜中抑菌成分的最佳提取工艺参数为:A2B3C1,即提取温度50℃、提取时间为36 h、提取料液比为9:1(V/V)。在此条件下对香菜抑菌成分进行提取,测定得出其对金黄色葡萄球菌的抑菌直径为23 mm,对大肠杆菌的抑菌直径为23 mm,证明此提取条件下提取的香菜溶液具有较好的抑菌效果。
3 讨论
本实验证明香菜无水乙醇提取物对金黄色葡萄球菌和大肠杆菌有一定的抑制作用,最佳提取条件为提取温度50℃、提取时间为36 h、提取料液比为9∶1(V/V)。实验结果同周凌霄等[8],其对芫荽浸出汁的抑菌效果进行了初步的研究,结果表明,芫荽浸出汁对部分细菌和霉菌的生长有较强的抑制作用,对酵母的抑制作用不明显。关于芫荽的有效抑菌成分以及与食品组分的协同作用效果,有待进一步研究。陆占国等[9]以乙醚为溶剂,采用索式萃取法萃取新鲜香菜,以0.252% 的产率获得了芳香精油。与水蒸汽蒸馏法获得的精油以及香菜原汁的抗菌作用进行了比较,结果显示水蒸汽蒸馏法和索式法提取的精油对大肠杆菌,白葡萄球菌具有很强的抑制作用,但是香菜精油和原汁对米曲霉、黑曲霉完全没有抑菌作用。
由于香菜中具体抑菌成分尚未明确,无法对粗提取物中的功能成分进行鉴定,因此对香菜提取物的研究和产品开发尚需进一步探讨。目前,虽已知道许多植物的提取物具有抗菌防腐作用,且有不少已作为天然防腐剂开发利用并投放市场,但目前使用的大部分都是粗制品,其有效成分含量常随着季节和地理环境而改变。香菜全国各地种植,有效含量是否因地域不同有所不同也是可以作为探讨的课题。
[1] 李小梅,张丽茁,张景涛.芫荽营养与药理作用研究[J]. 黑龙江农业科学,2010,(3):121-123.
[2] 李良松,刘懿,杨丽萍.香药本草[M]北京:中国医药科技出版社,2000.
[3] 尤新.国际防腐剂市场及植物提取物防腐剂研究进展[J].中国食品添加剂,2008,(1):45-50.
[4] 张鹰,曾新安,温其标.生物防腐剂及其在食品中的应用[J].食品与机械,2006,22(1):77-79.
[5] 范永超,任顺成,李翠翠,等.天然植物源防腐剂研究进展[J].安徽农业科学,2010,38(12):6080-6081.
[6] 陆占国,郭红转,李伟.芫荽茎叶精油化学成分分析[J].食品与发酵工业,2006,32(2):96-98.
[7] 陆占国,郭红转,李伟,等.超临界CO2萃取芫荽芳香成分及GCMS解析[J].哈尔滨商业大学学报(自然科学版),2006,22(2):37-39.
[8] 周凌霄,杨荣华,岳富浩.芜荽的抗菌作用研究[J].中国调味品,2001,(3):20-22.
[9] 陆占国,郭红转,孙胜敏.索式法提取芜荽茎叶精油的化学组成及其抗菌活性[J].化学研究,2007,18(1):70-73.
[10] 刘信平,张驰,谭志伟,等.香菜地上部分挥发活性成分研究[J].食品科学,2008,29(8):517-519.
[11] 高磊,谢宇琪,王兴华,等.8种植物源农药的提取工艺及其抑制真菌作用研究[J].安徽农业科学,2010,38(34):19408-19410.
[12] 王兴华.多种药用植物抑菌效果研究[J].山西大学学报(自然科学版),2005,28(3):322-324.
[13] 周德庆.微生物学实验手册[M].上海:上海科技出版社,1986.
[14] 吴传茂,吴周和,曾莹,等.从植物中提取天然防腐剂的研究[J].食品科学,2000,(9):25-27.
[15] 彭家泽.天然食品防腐剂的研究及其应用[J].中国食品添加剂,2003,(z1):106-118.
[16] 刘振学,黄仁和,田爱民.实验设计与数据处理[M].北京:化学工业出版社,2005.
[17] 孙长贵,M100-S16微生物药物敏感性试验执行标准[Z].宾夕法尼亚,临床实验室标准化协会,2006.

