气导听觉剥夺幼鼠螺旋神经节NSE表达
王枫谢宁田建伟朱晓全武军
(1.空军总医院,100142;2.空军航空医学研究所附属医院,100089;3.空军工程大学机要系,100097)
研究发现,多种动物的感觉系统在发育的过程中都有一个关键时期,在这个时期内,去除或者改变传入神经冲动对中枢神经系统的结构和功能可以产生极大的影响[1-3]。听觉剥夺效应(auditory deprivation effect)是1996年由15位著名听力学家组成的Eriksholm工作组讨论提出,并定义为由于声学信息的减少导致的听觉功能的逐渐下降[4]。在现实生活中,越来越多的耳科医生注意到听觉剥夺对耳病患者的听觉产生了不良影响,包括听阈的提高和言语识别率的降低。大脑发生听觉剥夺效应后产生的解剖生理学改变,目前的研究都是通过动物实验间接获得。耳蜗切除是常用的听觉剥夺动物模型的造模方法,因其破坏了耳蜗毛细胞的完整性,不能通过听觉电生理的方法检测动物的听功能,同时使得对听觉传导通路的起始部位——螺旋器(Corti器)的研究无法进行。我们选择幼年动物进行气导听觉剥夺,一方面减少发育关键期听觉系统声音信号的输入,另一方面保持耳蜗的正常结构,目的在于获得听觉剥夺对听觉系统中螺旋神经节发育的影响结果。
1 材料与方法
1.1 材料
1.1.1 实验动物 实验动物采用清洁级SD乳鼠60只,雌雄不限,由第四军医大学动物实验中心提供。
1.1.2 试剂 兔抗神经元特异性烯醇化酶 (neuronal specific enolase,NSE)多克隆抗体、SABC试剂盒购自武汉博士德公司。
1.1.3 仪器 听觉电生理检测仪(Biologic,Traveler Express E,USA)。冰冻切片机(德国LEICA CM1850)。
1.2 方法
1.2.1 动物分组 实验动物随机分为对照组和AD(Auditary Deprivation)组。AD组大鼠饲养于密闭隔音室,生后12 d起行耳道填塞至生后42 d;对照组大鼠正常食水、在正常声音环境中饲养。
1.2.2 模型制备 采用文献[5]方法进行耳道填塞(图1)。
1.2.3 脑干诱发电位(ABR)检测 采用听觉电生理检测仪(Biologic,Traveler Express E,USA)于出生后42 d分别对对照组、AD组大鼠进行ABR检测。
将实验动物以2%戊巴比妥钠100 mg/kg行腹腔注射麻醉。记录电极刺入矢状缝与两外耳道连线交点头皮下,参考电极放置在刺激耳后皮下,接地电极放置在大鼠尾根部皮下。交替短声刺激,声源距外耳孔1.0 cm,刺激间隔为0.1 ms,滤波带通为100~2 000 Hz,扫描时间为10 ms,叠加次数为512次。大鼠ABR共有5个波,其中以Ⅱ、Ⅲ波为主,以刚刚出现可以辨认的Ⅱ或Ⅲ波为标准,记录ABR听阈值,并分别记录潜伏期和交替短声刺激后幅值。测试在双层屏蔽室内进行,环境噪声≤40 dB SPL。测试时注意对动物保温。
1.2.4 免疫组织化学染色
1.2.4.1 冰冻切片标本制备 于出生后42 d分别进行AD组和对照组大鼠耳蜗冰冻切片。实验动物如前法麻醉,4%多聚甲醛心内灌流固定,断头,取听泡置4%多聚甲醛后固定过夜。10%EDTA脱钙,30%蔗糖脱水至沉底,OCT包埋,冰冻切片机连续切片,层厚10μm。
1.2.4.2 螺旋神经节NSE染色及神经元计数 一抗为兔抗NSE多克隆抗体,浓度为1∶300,二抗为生物素标记的羊抗兔二抗。DAB显色,梯度酒精脱水,二甲苯透明,中性树胶封片。光学显微镜下观察,照相。阴性对照以PBS代替一抗。
每张切片选取耳蜗第二转螺旋神经节、随机取60个高倍视野进行细胞计数。
1.3 统计学方法 数据以均数±标准差 (x±s)表示,应用SPSS 13.0统计软件进行统计学处理,组间差异应用t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 ABR阈值及潜伏期比较 气导听觉剥夺至出生后42 d,对照组及AD组大鼠的ABR阈值分别为 (26.67±3.89)dB SPL和(38.18±5.54)dB SPL,经统计学分析P<0.01,差异有高度统计学意义。对照组和AD组Ⅰ波到Ⅴ波各波潜伏期统计结果P>0.05,差异无统计学意义;对照组和AD组Ⅰ波到Ⅴ波各波幅值统计结果Ⅱ波、Ⅲ波、Ⅴ波幅值P<0.05,差异有统计学意义(表1~2,图2~3)。
2.2 两组大鼠脑干传导时间比较 ABR各波中Ⅴ波最为稳定,且振幅最高。波Ⅰ~Ⅴ间期也称为脑干传导时间或中枢传递时间。AD组与对照组波Ⅰ~Ⅴ间期比较,对照组为(3.978±0.435)ms,AD组为(3.629±0.616)ms,P<0.001,差异有高度统计学意义。
2.3 螺旋神经节神经元NSE染色神经元形态及计数比较对照组大鼠螺旋神经节神经元NSE染色显示正常神经元NSE主要存在于胞浆,胞体着色明显,核着色略浅淡,胞体排列有一定密度,不能从形态上区分两型神经元。胞体发出的神经纤维着色较胞体略浅。AD组大鼠免疫组化显示神经元显色较对照组明显变浅,形态模糊,排列紊乱,神经纤维着色基本正常(图4)。
神经元计数结果对照组为(10.643±1.104)个/HP,AD组为(7.883±0.987)个/HP,两组比较,P<0.05,差异有统计学意义。
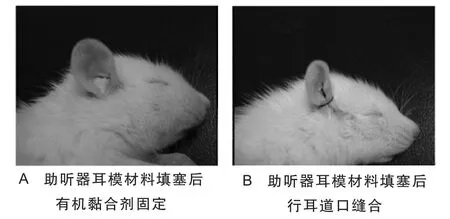
图1 SD大鼠气导听觉剥夺方法
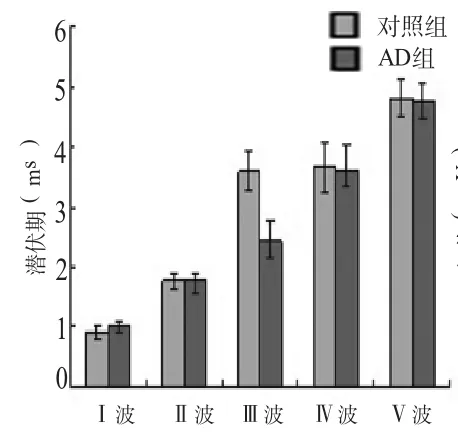
图2 ABR各波潜伏期
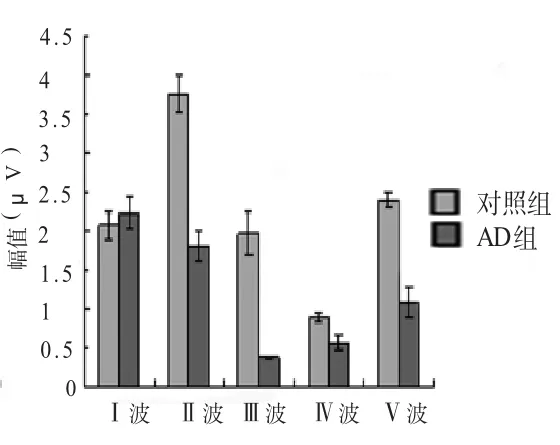
图3 ABR各波幅值
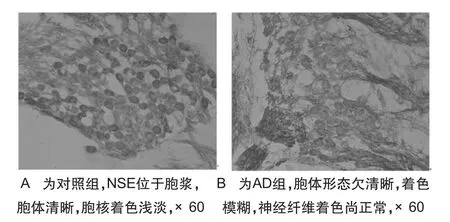
图4 螺旋神经节NSE免疫组织化学染色

表1 ABR各波潜伏期(m s)(n=30,x±s)

表2 ABR各波幅值(μV)(n=30,x±s)
3 讨论
人们早已发现,改变嗅觉、视觉和听觉系统中感觉输入信号会影响相应系统神经网络在形态和功能上的发育与成熟[1-3]。有研究证实听觉剥夺可以延缓大鼠上外橄榄核(LSO)神经元抑制性突触的发育。Sanes等发现,破坏出生后1周大鼠的耳蜗将导致与抑制性突触相关的、轴索和树突正常的形态学再变构过程的阻断[6]。通过破坏幼年砂鼠单侧耳蜗以阻断声输入则可以阻断LSO神经元抑制性突触和树突的形态发育[7]。目前的研究观察到听觉剥夺导致耳蜗螺旋神经节细胞发生退行性变,这可能归因于声刺激的减少。在完全缺乏声刺激(耳蜗毁损)较听觉剥夺对螺旋神经节细胞的影响更为明显[8]。大鼠生后发育“关键期”一般认为从第12天开始,到第30天结束[9-10],我们选择在生后12~42 d对大鼠进行听觉剥夺,目的在于减少发育关键期听觉系统声音信号的输入,希望从相反方向证明正常的声音刺激对螺旋神经节发育的促进作用。
ABR检测结果显示,AD组与对照组比较,听阈值升高约10 dB,ABR波幅降低,P<0.05,差异有统计学意义;两组大鼠ABR各波幅值比较,Ⅱ波、Ⅲ波、Ⅴ波幅值的差异有统计学意义,P<0.05。ABR检测中,Ⅰ波是辨认其他各波的基准,尤为重要。波Ⅴ常是最高的峰,改变给声重复率和降低声强,对波Ⅴ的出现率影响较少,在其他波消失后,波Ⅴ还继续存在。而峰间期中尤以Ⅰ~Ⅴ间期最为重要。因此,我们在计算了各波的幅值和潜伏期后,对Ⅰ~Ⅴ间期也进行了统计学分析,AD组与对照组相比,P<0.01,差异显著。AD组较对照组Ⅱ波、Ⅲ波、Ⅴ波幅值降低,说明其各自来源部位耳蜗核、上橄榄核、下丘功能受到影响。以上结果可以证实,气导听觉剥夺对动物的听觉功能造成了损害,进而可以推测其对听觉传导通路的相关部位产生了不良影响。
烯醇化酶是1934年Lohman和Mayerhof在研究肌肉提取物中磷酸甘油酸向丙酮酸转化的过程中发现的。烯醇化酶是糖酵解途径中的关键酶,普遍存在于生物体的糖酵解代谢中,它既可催化糖酵解过程中2-磷酸-D-甘油酸(PGA)向磷酸烯醇式丙酮酸(PEP)的转化,又可在糖原合成过程中催化逆向反应,即作为磷酸丙酮酸水合酶,使PEP向PGA转化,在细胞能量代谢中起重要作用[11]。在脊椎动物中,烯醇化酶存在3种同工酶:α、β、γ[12]。α、β、γ烯醇化酶分别由3种不同的基因所编码,所有的烯醇化酶活性形式均为二聚体,即由两个亚单位组成,目前已知有5种形式的组合:αα、ββ、γγ、αβ、αγ[13]。神经元特异性烯醇化酶(NSE)主要分布于神经元和神经内分泌细胞的胞浆中。周围神经中NSE含量远低于脑组织,相差10~100倍。在我们的观察中,AD组螺旋神经节神经元NSE染色着色变浅,ABR听阈较对照组明显提高,这可能是由于神经传入信号的减少诱导了NSE基因表达的下调,继发细胞能量代谢障碍,影响神经元细胞内正常糖酵解过程,使三磷酸腺苷减少,干扰神经元的正常功能所致。
听觉的产生和传导是一个复杂的过程,是听觉感受器和听觉传导通路共同作用产生的结果,在这个复杂的过程中,很难说听觉剥夺对听觉系统发育关键期的哪个部位产生了影响,很有可能多个部位同时受累,具体的结果还有待于今后的深入研究。
[1]Rochefort C,Gheusi G,Vincent JD,et al.Enriched odor exposure increases the number of newborn neurons in the adult olfactory bulb and improves odor memory[J].J Neurosci,2002,22(7):2679-2689.
[2]Rittenhouse CD,Shouval HZ,Paradiso MA,et al.Monocular deprivation induces homosynaptic long-term depression in visual cortes [J].Nature,1999,397(6717):347-350.
[3]Di Cristo G,Berardi N,Cancedda L,et al.Requirement of ERK activation for visual cortical plasticity[J].Science,2001,292 (5525):2337-2340.
[4]Arlinger S,Gatehouse S,Bentler RA,et al.Report of the eriksholm workshop on auditory deprivation and acclimation[J].Ear Hear,1996,17(Suppl):87-98.
[5]王枫,王方圆,黑任轶,等.早期气导听觉剥夺对幼鼠听觉发育的影响[J].听力学及言语疾病杂志,2011,19(2):141-143.
[6]Sanes DH,Markowitz S,Bernstein J,et al.The influence of inhibitory afferents on the development of postsynaptic dendritic arbors [J].JComp Neurol,1992,321(4):637-644.
[7]Kakazu Y,Akaike N,Komiyama S,et al.Regulation of in tracellular chloride by cotransporters in developing lateral superior olive neurons[J].JNeurosci,1999,19(8):2843-2851.
[8]Leake PA,Stakhovskaya O,Hradek GT,et al.Factors influencing neurotrophic effects of electrical stimulation in the deafened developing auditory system[J].Hear Res,2008,242(1-2):86-99.
[9]Games KD,Winer JA.Layer V in the rat auditory cortex:projections to the inferior colliculus and cintralateral cortex[J].Hearing Res,1988,34(1):l-25.
[10]Nakahara H,Zhang LL,Merzenich MM.Specialization of primary auditory cortex processing by sound exposure in the“critical period”[J].Proc Natl Acad Sci USA,2004,101(18):7170-7174.
[11]Subramanian A,Miller DM.Structural analysis of alpha-enolase. Mapping the functional domains involved in down-regulation of the c-myc proto-oncogene[J].J Biol Chem,2000,275(8):5958-5965.
[12]Piast M,Kustrzeba-Wojcicka I,Matusiewicz M,et al.Molecular evolution of enolase[J].Scta Biochim Pol,2005,52(2):507-513. [13]Fougerousse F,Edom-Vovard F,Merkulova T,et al.The muscle specific-enolase is an early marker of human myogenesis[J].J Muscle Res Cell Motil,2001,22(6):535-544.

