豚鼠耳颞部60Coγ射线照射对耳蜗核影响的实验研究
钟华林 唐安洲 谢利红
鼻咽癌是我国南方比较常见的恶性肿瘤之一,占头颈部肿瘤发病率的首位,目前放射治疗是鼻咽癌的主要治疗手段。感音神经性聋是鼻咽癌放疗后常见的并发症,其发病机理尚未明确,目前多数学者认为放疗后感音神经性聋与放射线引起的耳蜗损伤有关[1~3]。而鼻咽癌放射治疗后感音神经性聋除与耳蜗的损伤有关外,是否也有蜗神经核损伤,目前尚未见相关报道。本研究以豚鼠为动物模型,用60Coγ射线对豚鼠耳颞部进行照射,通过观察放疗后豚鼠ABR和蜗神经核形态学以及凋亡相关蛋白半胱氨酸天冬氨酸蛋白酶3(Caspase 3)在蜗神经核中的表达,初步探讨60Co照射对蜗神经核的影响,为放疗引起的感音神经性聋的中枢病变机制提供实验依据。
1 材料与方法
1.1动物分组 48只白色红目豚鼠,体重250~300克,耳镜检查耳道通畅,鼓膜完整,无中耳感染,耳廓反应灵敏,雌雄不拘。随机分为对照组(8只)与实验组(40只),实验组于60Coγ射线照射后1、4、7、14、30 d(每个时间点8只豚鼠)行ABR检查后立即处死,心脏灌流固定后取出耳蜗核,行HE及免疫组化染色。对照组不进行60Coγ射线照射,行ABR测试后,取耳蜗核行HE及免疫组化染色,方法同实验组。
1.2方法
1.2.160Coγ射线照射方法 豚鼠经1%戊巴比妥钠(3.5 ml/Kg)腹腔注射麻醉后固定于自制固定板上,用GWXJ80型60Co远距离治疗机对豚鼠右侧耳颞部做一次性40 Gy60Coγ射线照射,辐射深度2.0 cm,照射范围为2 cm×2 cm,自制铅板遮盖非照射部位。
1.2.2听性脑干反应检测 对照组与实验组于实验前、实验组于各时间点分别行双耳听性脑干反应检测。将豚鼠置于屏蔽室内,将针形正极插入颅顶正中皮下(两侧外耳道连线中点)斜向前约0.5 cm,负极置于两侧乳突,地极置于嘴唇脂肪垫;测试仪器用美国 TDT系统,声刺激为短声,最大强度90 dB SPL,频率10次/秒,耳机固定于距外耳道口0.5 cm处,带通滤波300~3 000 Hz,观察时程20 ms,叠加次数1 024次。以引出波Ⅲ的最低刺激强度确定反应阈。
1.2.3心脏灌注及组织切片 各组豚鼠完成ABR测试后,将豚鼠心脏灌流固定后,断头取出脑干,放置于4 %多聚甲醛磷酸缓冲液中固定24小时,常规脱水石蜡包埋,耳蜗核的定位按Voitenko等[4]制定的豚鼠脑干立体定位图谱,将蜡块修剪后沿面神经根平面向后做切片,片厚5 μm,行HE染色及免疫组化染色。
1.2.4HE染色 石蜡切片依次经二甲苯和梯度酒精脱蜡至水,苏木素液染5分钟,1%盐酸酒精分化,返蓝,1%伊红染1分钟,蒸馏水冲洗,常规脱水、透明、中性树胶封片。
1.2.5免疫组织化学染色 石蜡切片脱蜡至水,用pH6.0的0.01 mol/L的柠檬酸盐缓冲液煮沸修复抗原10分钟,3%H2O2室温20分钟,山羊血清封闭20分钟,加Caspase 3一抗(1:100)4 ℃孵育过夜,加通用二抗,室温下孵育10分钟,加三抗室温下孵育10分钟,DAB显色,苏木素复染,常规脱水、透明、封片。阴性对照染色切片用PBS 代替一抗,其他实验步骤一样。Caspase 3的阳性表达为细胞浆呈棕黄色染色。通过IPP6图像分析软件计算其灰度值,灰度值越低,表示细胞阳性表达越强。
1.3统计学方法 所有实验数据通过SPSS13.0统计软件进行统计分析,多组均数比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1ABR测试结果 实验组豚鼠60Coγ射线照射后1、4、7、14、30 d ABR反应阈均升高,其中,照射后4、7、14、30 d的ABR反应阈与对照组比较差异有统计学意义(P<0.05),实验组各时间点ABR波I、II、III潜伏期及I-II、II-III、I-III波间期延长,与对照组比较,差异有统计学意义(P<0.05)(表1)。
2.2耳蜗核HE染色结果 光学显微镜下见对照组豚鼠耳蜗核神经细胞数目较多,染色均匀, 胞浆丰富,尼氏体正常,胞核和胞浆无明显有皱缩,胶质细胞正常(图1a)。实验组豚鼠耳蜗核在60Coγ射线照射后1、4、7 d神经元细胞数目及染色改变不明显,但14 d出现神经细胞肿胀,胞浆减少,着色浅淡,胞核皱缩,尼氏体减少,胶质细胞增生,数量增多(图1b),30 d上述改变更加明显(图1c)。
2.3耳蜗核组织Caspase 3免疫组化染色表达结果 对照组豚鼠耳蜗核神经元未见明显阳性表达,实验组豚鼠耳蜗核神经元Caspase 3呈现较强阳性表达,60Coγ射线照射后不同时间点耳蜗核神经细胞的Caspase 3灰度值与对照组比较差异有显著统计学意义(P<0.01)(表2、图2)。

表1 实验组与对照组ABR 各波潜伏期(ms)、波间期(ms) 及反应阈( dB SPL) 比较
注:*与对照组比较,P<0.05
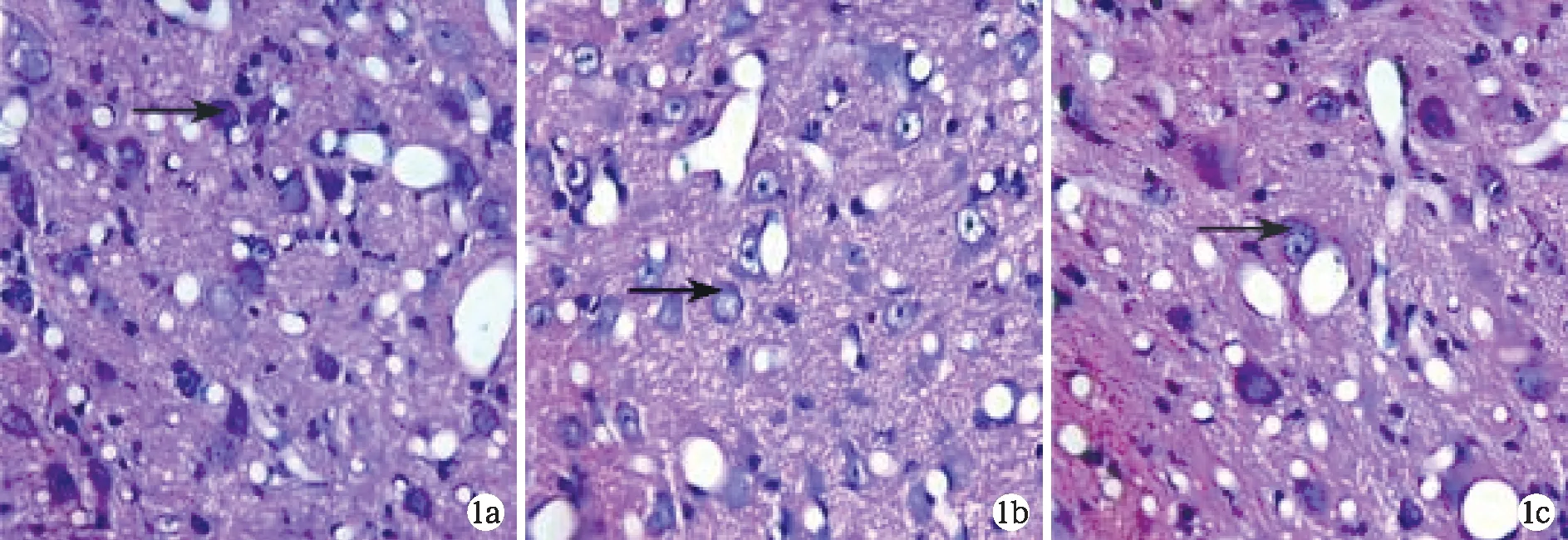
图1 对照组及实验组14、30天豚鼠耳蜗核HE染色结果a 对照组耳蜗核神经元胞浆丰富,尼氏体正常(箭头);b 照射后14天耳蜗核神经元胞浆减少着色浅淡,尼氏体减少(箭头);c 照射后30天 耳蜗核胞浆减少着色浅淡,尼氏体减少(箭头)(HE×400)
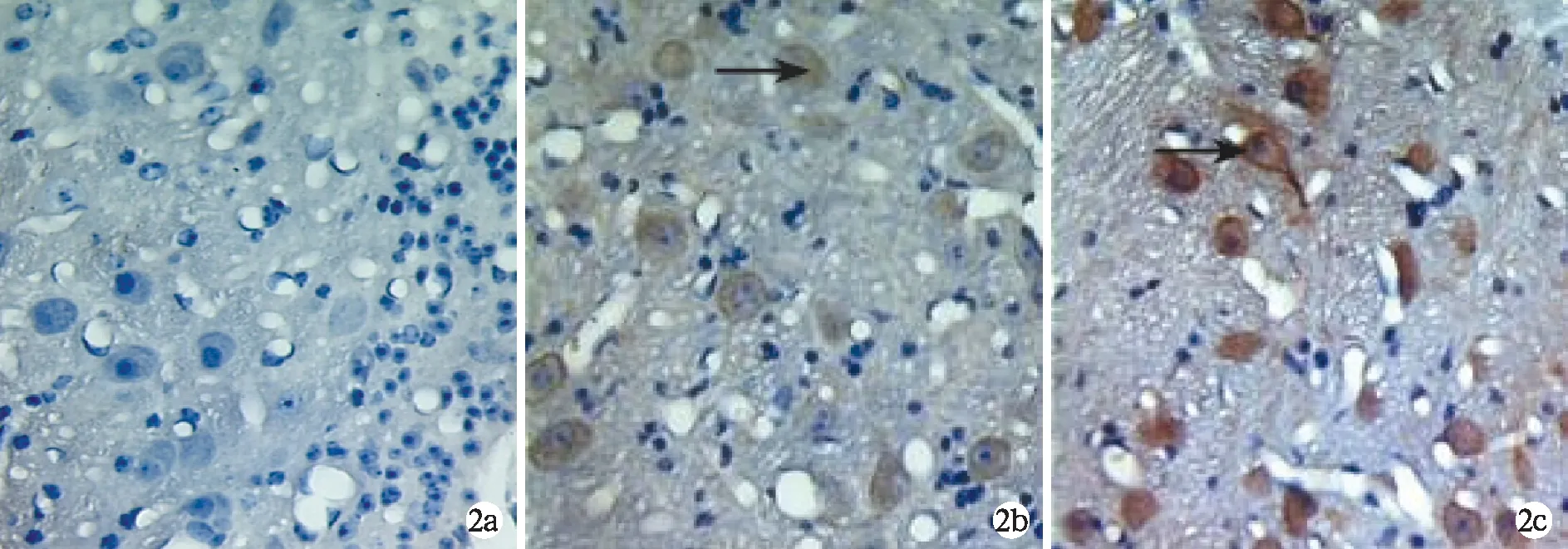
图2 实验组及对照组豚鼠耳蜗核Caspase 3的表达a 对照组Caspase 3无明显阳性表达;b 照射后4天Caspase 3阳性表达 (箭头);c 照射后7天Caspase 3阳性表达(箭头)(免疫组化×400)

组别灰度值对照组172.33±17.81实验组 照射后1 d136.37±24.42* 照射后4 d94.67±15.33* 照射后7 d91.40 ± 11.71* 照射后14 d110.80±4.23* 照射后30 d123.56±32.56*
注:*与对照组比较,P<0.05
3 讨论
放射治疗是鼻咽癌等头颈部恶性肿瘤的主要治疗手段,放射治疗后导致感音神经性听力下降是其常见的并发症。吴湘萍[ 5]对33例鼻咽癌患者行鼻咽癌常规放疗,在放疗结束6个月后行ABR检测,发现患者ABR波I、II、III潜伏期及I-III波间期均延长,表现为感音神经性听力下降且呈慢性进行性进展,而且不可逆,认为第Ⅷ对颅神经至桥脑水平可能受到损害。Lau等[ 6]发现鼻咽癌患者放疗后1个月,其ABR波Ⅰ、Ⅱ、Ⅲ、V潜伏期延长,认为波Ⅱ潜伏期延长可能与脑干耳蜗核的损伤有关。秦岭等[ 7]也报道48例鼻咽癌患者放疗前后ABR的变化,其放疗前ABR正常,但放疗后ABR波I、III、V潜伏期均延长,也认为放疗对外周听神经和脑干都产生了损害。
范静平等[ 8 ]用60Co γ射线对豚鼠耳颞部进行40 Gy的一次性照射后24小时,豚鼠ABR反应阈稍有提高。在放疗导致感音神经性听力下降的动物研究中,多数学者认为是由于射线导致了耳蜗毛细胞、螺旋神经节细胞及血管纹的损伤[9~11],60Coγ射线照射后超微结构显示内外毛细胞排列紊乱、缺失,螺旋神经节细胞萎缩或消失,发生细胞凋亡,血管纹萎缩。目前对于放疗后感音神经性听力损失的动物实验研究多局限在内耳方面,对于射线是否引起脑干耳蜗核的损伤目前尚未见报导。研究[ 12]认为豚鼠ABR各波均有一个主要发生源,即波Ⅰ为第Ⅷ神经,波Ⅱ为耳蜗核,波Ⅲ为上橄榄核,波Ⅳ为外侧丘系。本研究中发现60Coγ射线照射后4、7、14、30 d豚鼠的ABR 反应阈升高,波I、II、III潜伏期及I-II、II-III、I-III波间期延长,因而,认为波II潜伏期及II-III波间期延长可能与60Coγ射线照射引起耳蜗核的损伤有关,随着60Coγ射线照射后时间的延长,ABR 反应阈升高更明显,波I、II、III波潜伏期及I-II、II-III、I-III波间期延长更加明显,提示听力损害更加严重。
目前大多数研究者认为神经的损伤与细胞凋亡蛋白Caspase 3表达有关[13,14],在正常细胞中Caspase 3以无活性的前体形式合成与储存,当细胞进入凋亡过程中,激活Caspase 3,形成Caspase 3自我放大级联反应,进而裂解 DNA损伤细胞。Caspase 3是细胞凋亡中的关键蛋白酶,本研究发现实验组豚鼠耳蜗核在60Coγ射线照射后1、4、7 d神经元细胞数目及染色改变不明显,但照射后14天出现神经细胞肿胀,胞浆减少着色浅淡,胞核皱缩,尼氏体减少,胶质细胞增生,数量增多,照射后30天上述改变更加明显,Caspase 3表达明显增强,提示60Coγ射线照射可导致耳蜗核神经元的损伤,Caspase 3表达上调可能与耳蜗核细胞的损伤有关。另外,实验组豚鼠在60Coγ射线照射后14天耳蜗核神经元才出现形态学改变,但耳蜗核神经元Caspase 3在60Coγ射线照射后1天就开始呈现较强表达,而且照射后4天开始ABR反应阈也升高,提示60Coγ射线照射后耳蜗核神经元形态学改变可能迟于ABR及分子生物学的改变。60Coγ射线照射引起耳蜗核损伤可能与以下因素有关:①射线直接损伤耳蜗核神经元;②耳蜗损伤继发性引起耳蜗核神经元的变性,即间接引起耳蜗核的损伤;③血管损伤导致耳蜗核神经元缺血坏死。本研究的结果提示60Coγ射线照射不仅可引起耳蜗的病变[ 11],也可能会导致脑干耳蜗核的病变,放射治疗后导致感音神经性听力下降可能是多方面因素共同作用的结果。本研究仅提示了60Coγ射线照射对耳蜗核形态结构造成了损害,但还有许多问题须进一步的探讨和完善,如延长照射后观察时间、耳蜗损伤与耳蜗核损伤的关系、使用Caspase 3抑制剂等是否可以保护射线对脑干耳蜗核的损伤均有待进一步研究。
4 参考文献
1 Chan SH ,Ng WT, Kam KL,et al .Sensorineural hearing loss after treatment of nasopharyngeal carcinoma: a longitudinal analysis[J].Int J Radiat Oncol Biol hys, 2009,73:1 335.
2 Jereczek - Fossa BA,Zarowski A, Milani F,et al. Radiotherapy-induced ear toxicity[J]. Cancer Treat Rev,2003,29:417.
3 杨新明,卢永德,陈忠.电离辐射对内耳形态与功能影响的实验研究[J].中国耳鼻咽喉颅底外科杂志,1997,3:81.
4 Voitenko LP, Marlinsky VV. Stereotaxic atlas of the guinea pigbrainstem[J]. Neurophysiology, 1993,25:52.
5 吴湘萍.鼻咽癌放疗对听性脑干功能的远期影响[J]. 山东大学耳鼻喉眼学报,2007,21:46.
6 Lau SK,Wei WI,Sham JS,et al. Early chan ges of auditory brainstem evoked I CsDonse after radiotherapy for nasopharyngeal carcinoma: a prospective study[J]. Laryngol Otol,1992,106:887.
7 秦岭,陈甲信,张丽香,等. 鼻咽癌患者放射治疗后听觉脑干反应的改变[J]. 中华医学杂志, 2000, 80: 912.
8 范静平,陆书昌.60Coγ线辐射对耳蜗的影响[J].第二军医大学学报,1992,13:468.
9 崔广帅,金大玉,邢巍巍, 等. 电离辐射对听功能影响的实验研究[J] . 听力学及言语疾病杂志, 2010, 18: 65.
10 Enver A,Mustafa V,Ozan K,et al.Effects of piracetam supplementation on cochlear damage occuring in guinea pigs exposed to irradiation[J].Biol Pharm Bull,2006,29:1 460.
11 谢利红, 唐安洲, 尹时华,等.60Co照射对豚鼠听力及耳蜗螺旋神经节细胞Caspase 3表达的影响[J] . 听力学及言语疾病杂志, 2012, 20: 32.
12 吴展元,刘邦德,黄治物,等. 豚鼠听觉通路不同平面毁损的ABR频域分析[J].听力学及言语疾病杂志,1995,3:58.
13 Adjan VV,Hauser KF,Bakalkin G,et al. Caspase 3 activity is reduced after spinal cord injury in mice lacking dynorphin:differential effects on glia and neurons[J]. Neuroscience, 2007,148:724.
14 Shimohama S, Tanino H , Fujimoto S. Differential subcellular localiztion of caspase family proteins in the adult rat brain [J] . Neurosci Lett , 2001,315:125.

