TCT联合HPV用于筛查宫颈癌及癌前期病变的价值
周春地 金晓蓉
(海盐县人民医院,浙江 海盐 314300)
子宫颈癌是妇科常见的恶性肿瘤之一,发病率位居女性恶性肿瘤的第2位,仅次于乳腺癌的女性最常见的恶性肿瘤[1]。目前筛查仍是预防和控制宫颈癌的主要手段。现在较常用的筛查方法有:宫颈刮片、宫颈液基细胞学检查、HPV检测、阴道镜等。宫颈癌防治的意义主要是及时发现并治疗宫颈癌前期病变和宫颈癌。所以宫颈癌前期病变和宫颈癌的检出能力就成为判断筛查方法优劣的主要依据。作者对本院妇科门诊1000例患者的TCT和HPV检测结果进行分析,并比较单项检查的结果及与阴道镜下的诊断符合率、阴性预测能力来探讨TCT联合HPV检测在宫颈癌筛查中的应用价值。
1 资料与方法
1.1 一般资料 2010年1月~2010年11月间在本院门诊就诊的妇科患者22000余人次,其中自愿接受宫颈癌机会性筛查的共1000例。年龄19~73岁。所有患者均有性生活史,近1年内没有做过宫颈癌的筛查,排除妊娠,生殖道急性炎症,签署知情同意书后,于非经期采样。
1.2 方法 对愿意接受筛查的患者同时行宫颈液基细胞学检查(TCT)及宫颈人乳头瘤病毒检测(HPV)。对检查结果有异常者或宫颈外观呈Ⅱ度以上糜烂者建议进行阴道镜下宫颈活检术。
1.2.1 宫颈液基细胞学检查(TCT):先用无菌棉球擦去宫颈表面的黏液,再用宫颈细胞采集器(宫颈刷)插入子宫颈管内同一方向旋转5圈,采集宫颈外口及宫颈管的脱落细胞。然后将采集器直接放入盛有细胞保存液的收集瓶内,检验中心的病理诊断人员进行读片诊断,细胞学诊断按TBS分类标准。TCT异常是指:ASC-US:不能明确意义的非典型鳞状细胞。ASC-H:非典型鳞状细胞不排除高度鳞状细胞病变。LSIL:低度鳞状上皮内病变。HSIL:高度鳞状上皮内病变。
1.2.2 HPV检测:用专用取样刷于宫颈同方向旋转4~5周以获得足够上皮细胞样本,将取样刷直接放入盛有细胞保存液的专业收集瓶内,由检验中心实验室人员严格按照试剂盒说明进行统一检测。HPV基因分型检测试剂盒为亚能生物技术有限公司提供 ,检测 18 种高危亚型:HPV16、18、31、33、35、39 、45 、51 、52 、53 、56 、58 、59 、66 、68 、73 、MM4 、83;5 种低危亚型:HPV6、11、42、43、44。
1.2.3 对检查结果有异常者或宫颈外观Ⅱ度以上糜烂者建议进行阴道镜下宫颈活检术:阴道镜下常规作碘试验和醋酸发白试验,于病变可疑处或移形带3,6,9,12点处取活检,移形带上移者行宫颈管搔刮术。病理组织学诊断根据病变程度主要分为:慢性宫颈炎,宫颈上皮内瘤变(CIN)Ⅰ级、Ⅱ级、Ⅲ级,宫颈癌。
1.3 统计学处理 计数数据以率来表示,率的比较采用χ2检验进行分析。
2 结 果
2.1 TCT及HPV高危型阳性率:1000例筛查中TCT阴性者(NILM)共902例,TCT阳性者(即为ASCUS及以上)共98例,阳性率为9.8%,包括(1)ASC-US 59例;(2)ASC-H:9例;(3)LSIL:19例;(4)HSIL:11例。HPV高危型阳性共151例患者,阳性率为15.1%。其中:感染率在前三位的亚型分别是:16型50例,52型20例,33型16例。同时感染两种HPV病毒者有15例。TCT及HPV高危型均阳性的共54例。
2.2 病理诊断:对宫颈筛查结果有异常的,或虽无异常但宫颈外观呈Ⅱ度以上糜烂者均建议患者于月经干净后1周内行阴道镜下活检,以病理诊断作为最终的诊断标准。共收集到124例宫颈活检报告。病检结果阴性共64例,均为宫颈炎(包括宫颈黏膜炎、扁平湿疣、鳞状上皮增生活跃及轻度鳞状上皮不典型增生),病检结果阳性共60例,其中59例为宫颈癌前期病变:CINⅠ21例,CINⅡ23例,CINⅢ15例。1例为宫颈癌(非角化性鳞状上皮细胞癌)。
2.3 筛查结果与病理学的诊断符合率。TCT联合HPV的诊断符合率分别与单独检查TCT、HPV的诊断符合率作比较,经 χ2检验,差异有统计学意义(均 P<0.05)。
2.3.1 不同筛查方法与病理学的阳性符合率分别为:TCT+HPV的阳性(TCT为ASC-US及以上,HPV为高危险型阳性)诊断符合率为82.69%,单独TCT的阳性诊断符合率为66.67%,单独HPV(高危型)的阳性诊断符合率为:65.38%。经 χ2检验,差异有统计学意义(均P<0.05),见表1。

表1 不同筛查方法与病理学的阳性诊断符合率
2.3.2 不同筛查方法与病理学的阴性符合率分别为:TCT+HPV的阴性诊断符合率为100%,单独TCT的阴性诊断符合率为82.61%,单独HPV的阴性诊断符合率为:80.43%。经 χ2检验,差异有统计学意义(均 P<0.05),见表2。
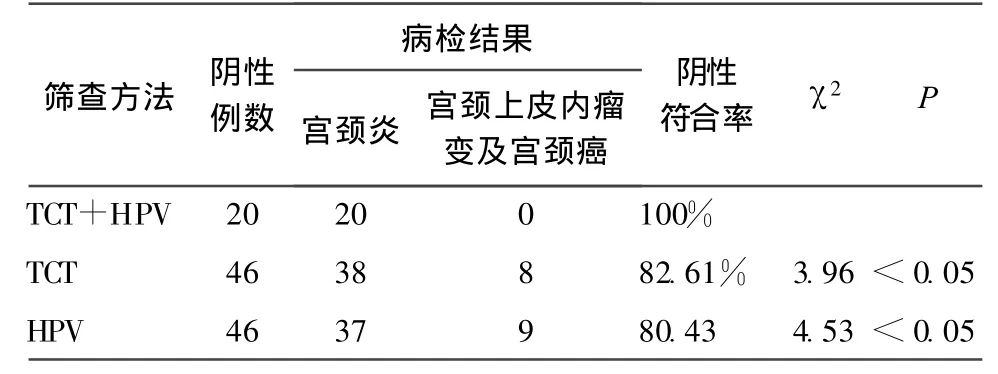
表2 不同筛查方法与病理学的阴性诊断符合率
3 讨 论
我国是宫颈癌发病率和死亡率均约占世界三分之一的大国[2]。宫颈癌的发生和发展是一个渐变的过程,一般需历时10年以上的时间[1]。这就给医学一个在癌前病变期间就可以检测出来的形态学依据。传统的宫颈刮片由于涂片质量差、损失细胞多等因素,导致假阴性率较高而漏诊。有学者则认为在常规巴氏涂片中高达53%的假阴性[3]。而TCT凭借其良好的制片质量和先进的TBS系统,已成为大多数医院用于宫颈癌筛查的首选方法。国内外很多报道显示TCT用于宫颈癌筛查提高了敏感性、特异性[4-6],但仍存在一定的假阴性率和假阳性率[4]。
高危型HPV感染是宫颈癌、癌前期病变发生发展的必要条件[7]。HPV可以在99.8%的宫颈癌患者中被发现。高危型HPV感染的持续存在使宫颈癌的相对危险增加了250倍[2]。宫颈高危型HPV的检测也是筛查宫颈癌的有效方法之一,其针对病因进行,能够引起高风险人群的重视。但单独应用不能明确宫颈病变程度,有一定的局限性。
而联合应用TCT和HPV检测就可以弥补两者单独应用时的不足。两者联合应用明显提高了宫颈癌筛查的敏感性和特异性[8],尤其对宫颈高度病变的敏感性和阴性预测值可达到100%[9]。本组观察结果提示TCT联合HPV检查与病理学的阳性诊断符合率为82.69%,高于单独TCT的66.67%、单独HPV的65.38%。显示两者联合可以提高筛查的敏感性,减少了漏诊率。而TCT联合HPV与病理学的阴性诊断符合率为100%,高于单独TCT的82.61%、单独HPV的80.43%。显示两者联合有非常高的特异性和阴性预测能力。
综合上述,TCT联合HPV检测与病检结果有较高的诊断符合率,有效防止单独应用一种方法的假阳性率和假阴性率,能及时有效地发现宫颈癌及癌前期病变,具有重要的临床应用价值。
[1] 汪泉.132例宫颈癌研究分析.中国现代医生,2010,48(20):109,132
[2] 郎景和.迎接子宫颈癌预防的全球挑战与机遇.中华妇产科杂志,2002,37(3):129
[3] Frable WJ,Austin RM,Collins RJ,et al.Medicolegal affairs,IAC task force summary.Acta Cytol,1998,42(2):76
[4] 杨怡桌,李亚里,徐滨,等.TCT在宫颈病变筛查中的临床价值和不足.中国妇产科临床杂志,2008,9(2):87
[5] 刘春艳.TCT在宫颈病变筛查中的应用.中国创新医学,2010,7(35):149
[6] 漆明,韦毓,庞朗,等.柳州市13150例妇科液基细胞学报告分析.柳州医学,2010,23(4):161
[7] 蔡娱飞,朱光泽.高危型人乳头瘤病毒DNA检测在宫颈癌筛查中的作用.中国妇幼保健,2006,21(24):3434
[8] 王学才,汤俊明.HPV联合TCT检测在宫颈疾病筛查中的应用.中外医学研究,2011,9(32):38
[9] 赵均,崔淑慧,任丽华,等.细胞学、HPV高危型检测在宫颈病变筛查中的应用.中国妇产科临床杂志,2006,7(2):89

