早期间断腹腔灌洗联合抗生素对重症急性胰腺炎大鼠的影响▲
吴裕林 卢榜裕
(广西医科大学第一附属医院,南宁市 530021)
早期间断腹腔灌洗联合抗生素对重症急性胰腺炎大鼠的影响▲
吴裕林 卢榜裕*
(广西医科大学第一附属医院,南宁市 530021)
目的通过动物实验初步评估早期间断腹腔灌洗(PL)联合抗生素对重症急性胰腺炎(severe acute pancreatitis,SAP)治疗的影响。方法成年 Wistar大鼠56只,雌雄各半,随机分组:假手术(SO)对照组、SAP无抗生素+未置管组(SNANT)、SAP无抗生素+置管组(SNAT)、SAP抗生素+置管组(SAT)、SAP抗生素+未置管组(SANT)、SAP-PL抗生素组(APL)和SAP-PL无抗生素组(NAPL);每组8只。采用胆胰管逆行性缓慢注射5%牛黄胆酸钠溶液(0.02 ml/100 g)建立大鼠SNANT和SANT模型;在SNANT模型的基础上于右下腹部放置腹腔引流管建立大鼠重症急性胰腺炎SNAT、SAT、APL和NAPL模型,引流管固定于鼠尾部。PL组在成功造模后12 h于麻醉状态下行腹腔灌洗,每12 h 1次,共4次。应用抗生素组则于造模之后12 h或灌洗结束时行腹腔内注射抗生素[左氧氟沙星注射液40 mg/(kg·d)+甲硝唑注射液90 mg/(kg·d)],每12 h 1次,共4次。用药和(或)灌洗完成12 h后收集标本。用酶联免疫吸附测定(ELISA)法检测血清中细胞因子肿瘤坏死因子(TNF-α)、白介素-6(IL-6)、白介素-8(IL-8)、内毒素即脂多糖(LPS)的含量变化,HE染色光镜下观察胰腺组织病理形态学改变并评分。结果①与SO组相比,SAP组和PL组血中LPS、TNF-α、IL-6、IL-8水平均显著升高(P<0.05);与 SNANT组相比,SNAT组和 NAPL 组血中 LPS、TNF-α、IL-6、IL-8水平无显著差异(P >0.05);与SANT 组相比,SAT 组和APL 组血中LPS、TNF-α、IL-6、IL-8 水平无显著差异(P >0.05);与SNANT组、SNAT组和NAPL组相比,SANT组、SAT组和 APL组血中 LPS、TNF-α、IL-6、IL-8水平均显著降低(P <0.05);与 NAPL 组相比,APL 组血中 LPS、TNF-α、IL-6、IL-8水平均显著降低(P <0.05)。②胰腺病理检查:SAP各组胰腺组织小叶间隙增大、粒细胞浸润、脂肪坏死、实质出血、小叶坏死或缺失;PL各组胰腺组织小叶间隙较SAP组明显增大、粒细胞浸润、脂肪坏死、实质出血、小叶坏死或缺失;SO组仅见散发胰腺小叶间区域水肿。SAP各组、PL各组胰腺病理学评分显著高于SO组(P<0.05);PL各组胰腺组织病理学总评分与SAP各组胰腺组织病理学总评分相比无统计差异(P>0.05)。结论重症急性胰腺炎早期间断腹腔灌洗联合抗生素治疗可显著降低SAP大鼠血中LPS、TNF-α、IL-6、IL-8水平(P<0.05),从而可能有助于降低SAP的全身损害,达到促进SAP好转和改善预后的目的。
重症急性胰腺炎;早期;腹腔灌洗;抗生素;细胞因子;动物实验
重症急性胰腺炎(severe acute pancreatitis,SAP)是常见的临床重症之一,其发病的病理生理机制复杂多变,常因全身炎症反应综合征(systemicinflammatoryresponse syndrome,SIRS)和(或)多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)甚至多器官功能衰竭(multiple organ failure,MOF)而死亡。目前,针对SAP肠道细菌易位及肠源性内毒素血症是否预防性使用抗生素仍存在诸多争议。本研究旨在通过动物实验,探讨早期间断腹腔灌洗联合抗生素对重症急性胰腺炎的治疗影响。
1 材料和方法
1.1 主要试剂及仪器 牛黄胆酸钠(美国Amresco公司),IL-6试剂盒(武汉博士德生物工程公司),内毒素(LPS)试剂盒、TNF-α试剂盒和IL-8试剂盒(苏州卡尔文生物科技有限公司),酶标光度仪(Thermo Labsystems公司)。
1.2 动物分组 成年 Wistar大鼠56只(由广西医科大学实验动物中心提供),雌雄各半,体重280~350 g。56只大鼠随机分为:假手术(sham operation,SO)对照组;SAP无抗生素 +未置管组(non-antibiotic + non-drainage tube,SNANT)、SAP无抗生素+置管组(non-antibiotic+drainage tube,SNAT)、SAP 抗生素 + 置管组(antibiotic+drainage tube,SAT)和SAP抗生素+未置管组(antibiotic+non-drainage tube,SANT);SAP-PL抗生素组(antibiotic+peritoneal lavage,APL)和SAP-PL无抗生素组(non-antibiotic+peritoneal lavage,NAPL)。每组8只大鼠。
1.3 模型建立 大鼠术前 12 h禁食不禁水。参考Aho等[1]使用的方法制备 SAP模型。10%水合氯醛溶液(0.3 ml/100 g体重)腹腔注射麻醉,上腹部正中切口,暴露胰胆管,用无损血管夹于近肝门水平处暂时夹闭胆总管,用8号针头于十二直肠系膜对侧缘平十二指肠乳头即胰胆管开口水平处刺入肠腔,用钝化头皮针从上述针道逆行刺入胰胆管约1 cm,然后用另一无损血管夹在距离针头远侧端约0.5 cm处夹持固定。缓慢注入5%牛黄胆酸钠溶液0.02 ml/100 g体重,持续约1 min,停留3 min左右,去除血管夹,“8”字缝合穿刺针道,关腹,即为非置管组。置管组则在关腹前于大鼠右下腹置入腹腔引流管(用头皮针去针头后留下的软管段制成),固定后关腹,将引流管固定于鼠尾部。PL组在成功造模后12 h于麻醉状态下行腹腔灌洗,每12 h 1次,共4次。应用抗生素组则于造模之后12 h或灌洗结束时行腹腔内给予抗生素[左氧氟沙星注射液40 mg/(kg·d)+甲硝 唑 注 射 液 90mg/(kg· d)],每12 h 1次,共4次。各组模型制备成功后12 h麻醉状态下心脏穿刺取血,开腹收集胰腺组织。
1.4 血清相关指标检测 IL-6、LPS、TNF-α和 IL-8采用ELISA检测方法,按试剂盒说明书进行操作和检测。
1.5 胰腺组织病理形态学观察 按常规方法进行病理切片,HE染色,观察胰腺组织病理形态学,参考Kusser等[2]的方法对胰腺损伤进行计分。具体方法是每张切片随机选取30个视野,对每个视野按标准进行单独评分,30个视野的平均分数为动物的最后病理评分。评分标准见表1。
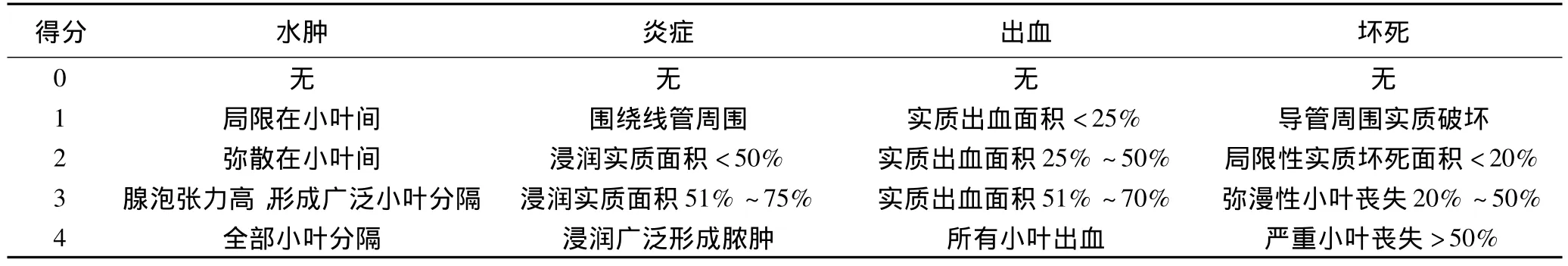
表1 急性胰腺炎胰腺组织病理评分标准
1.6 统计学方法 应用SPSS 18.0统计分析软件,计量数据以均数±标准差(±s)表示,采用单因素方差分析、最小显著差法,P<0.05为差异有统计学意义。
2 结果
2.1 各模型组血清生化指标变化情况 与SO组相比,SAP组和PL组血中LPS、TNF-α、IL-6、IL-8水平均显著升高(P<0.05);与 SNANT组相比,SNAT组和 NAPL组血中LPS、TNF-α、IL-6、IL-8 水平无显著差异(P >0.05);与 SANT组相比,SAT 组和APL 组血中LPS、TNF-α、IL-6、IL-8 水平无显著差异(P>0.05);与SNANT组相比,SANT、SAT和 APL组血中 LPS、TNF-α、IL-6、IL-8 水平均显著降低(P <0.05);与 NAPL 组相比,APL 组血中 LPS、TNF-α、IL-6、IL-8 水平均显著降低(P<0.05)。详见表2。
表2 大鼠各模型组与SO组血清生化指标变化情况 (±s)

表2 大鼠各模型组与SO组血清生化指标变化情况 (±s)
注:与模型各组相比,*P <0.05;与 SNANT组相比,#P >0.05,▲P <0.05;与 SANT组相比,△P >0.05;与 PL组相比,◆P <0.05。
组别 动物数 血TNF-α(pg/mL) 血IL-6(pg/mL) 血IL-8(pg/mL) 血LPS(EU/mL)SO 组 8 45.58 ±6.38* 30.48 ±4.95* 38.26 ±8.68* 7.56 ±1.37*SNANT 8 267.02 ±26.62 76.04 ±10.76 158.57 ±14.42 36.46 ±4.17 SNAT 8 266.23 ±24.74# 76.54 ±6.91# 157.3 ±15.1# 37.24 ±4.06#NAPL 8 248.23 ±11.2# 76.51 ±11.1# 140.88 ±13.75# 35.78 ±3.89#SANT 8 180.6 ±35.3▲ 59.29 ±3.88▲ 101.62 ±24.96▲ 25.68 ±6.68▲SAT 8 187.76 ±35.81▲△ 59.73 ±4.33▲△ 108.0 ±22.25▲△ 25.6 ±6.52▲△APL 8 177.51 ±38.13▲△◆ 58.71 ±3.2▲△◆ 85.56 ±10.02▲△◆ 25.01 ±6.15▲△◆
2.2 胰腺组织病理形态学检查及评分 SAP组胰腺小叶间隙水肿增宽,微血管被破坏、出血,大片腺泡结构不清,部分细胞核溶解消失,坏死胰腺周围见大量炎性细胞浸润;PL组胰腺小叶间隙较SAP组明显增大、微血管被破坏、出血,大片腺泡结构不清,部分细胞核溶解消失,坏死胰腺周围见大量炎性细胞浸润;SO组未见异常。各组大鼠胰腺组织病理表现(HE染色)见图1~图7。SAP组、PL组胰腺病理学评分显著高于SO组(P<0.05);应用抗生素组胰腺病理学总评分与无抗生素组相比无统计学差异(P>0.05)。详见表3。
表3 光镜下各组大鼠胰腺组织病理学评分 (±s)

表3 光镜下各组大鼠胰腺组织病理学评分 (±s)
注:与各模型组相比,*P <0.05;与 SNANT组,#P >0.05;与 SANT组相比,▲P >0.05。
组别 动物数 水肿 炎症 出血 坏死SO 组 8 0.25 ±0.12* 0.13 ±0.06* 0.00 ±0.00* 0.00 ±0.00*SNANT 8 3.12 ±0.33▲ 3.51 ±0.42▲ 2.81 ±0.29▲ 3.22 ±0.18▲SANT 8 3.22 ±0.41# 3.24 ±0.32# 2.78 ±0.22# 3.03 ±0.21#SNAT 8 3.34 ±0.35▲ 3.48 ±0.44▲ 2.88 ±0.34▲ 3.15 ±0.27▲SAT 8 3.17 ±0.28# 3.33 ±0.39# 2.85 ±0.26# 3.18 ±0.2#APL 8 3.55 ±0.56# 3.15 ±0.23# 2.73 ±0.28# 2.97 ±0.23#NAPL 8 3.43 ±0.52▲ 3.47 ±0.52▲ 2.81 ±0.52▲ 3.28 ±0.52▲
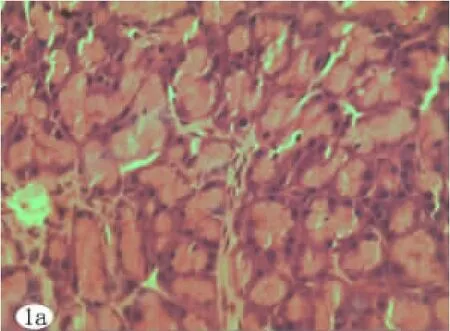
图1 SO组胰腺组织病理表现(×400)
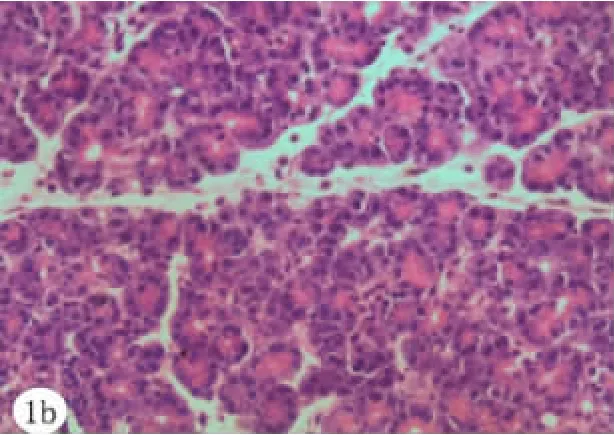
图2 SNANT组胰腺组织病理表现(×400):小叶间隙水肿,部分腺泡结构破坏或消失

图3 SNAT组胰腺组织病理表现(×400):小叶间隙水肿,部分腺泡结构破坏或消失
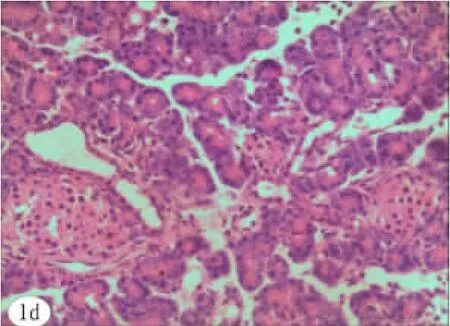
图4 SANT组胰腺组织病理表现(×400):小叶间隙水肿,部分腺泡结构破坏或消失

图5 SAT组胰腺组织病理表现(×400):小叶间隙水肿,部分腺泡结构破坏或消失

图6 NAPL组胰腺组织病理表现(×400):小叶间隙水肿,部分腺泡结构破坏或消失
图7 APL组胰腺组织病理表现(×400):小叶间隙水肿,部分腺泡结构破坏或消失
3 讨论
重症急性胰腺炎时,肠道内细菌可因细菌过度生长、黏膜物理屏障破坏及免疫应答受损[3~7]而通过血循环、淋巴系统直接进入腹腔或通过逆行感染等[8,9]途径发生易位感染。众多研究均证实,SAP时在胰、肝、脾、肠系膜淋巴结、腹水和血标本中均可检测到显著增多的肠源易位细菌[4,10,11],并且由于胰腺水肿、出血和坏死,使细菌更易于入侵繁殖,从而导致胰内的细菌检出率较其他组织器官的细菌检出率都高[10]。研究指出[12],在SAP动物造模后3 h即可形成肠源性内毒素血症(intestinal endotoxemia,IETM),并且持续于发病全过程。LPS释放入血后通过LPS激活中性粒细胞、单核/巨噬细胞和内皮细胞[12]的 NF-κB,导致大量炎症递质产生,如 IL-1、IL-6、IL-8、TNF-α和细胞间黏附因子(ICAM-1)、血管黏附因子(VCAM-1)、氧自由基(OFR)、诱导型一氧化氮合酶(iNOS)、血小板活化因子(PAF)、粒-巨噬细胞集落刺激因子(GM-CSF)、COX2以及P、E选择素等,因而内毒素血症可引起TNF-α的分泌增多。而血中TNF-α、LPS水平升高又可诱导单核巨噬细胞产生大量IL-6、IL-8,使其血清水平增高。韩德五等[13]指出,大肠杆菌产生的内毒素能够较细菌本身更早地穿透肠上皮进入血循环,是导致急性坏死性胰腺炎初期发生全身炎症反应综合征和脓毒症的重要原因。Exley等[14,15]研究亦发现,在 SAP早期,血清LPS和TNF-α水平即显著增高,并且与疾病的严重程度密切相关。在本研究中检测 LPS、TNF-α、IL-6、IL-8的结果显示,重症急性胰腺炎血中LPS、TNF-α、IL-6、IL-8均显著增高,提示细胞因子在重症急性胰腺炎的病理生理过程中具有重要的作用。
Rychter等[16]的对比研究发现,预防性联合使用多种抗生素可防止AP后期阶段发生肠道屏障功能障碍,从而可能通过降低败血症发生的几率而降低死亡率。与此相一致的是,有部分学者[17~19]通过Meta分析提出,预防性使用抗生素可避免胰腺的双重感染。然而,Dellinger等[20]的临床随机、双盲、安慰剂对照研究表明,在胰腺或胰周感染率、死亡率及手术治疗要求方面,早期应用抗生素组与对照组相比并未存在显著统计差异。在另一项临床研究中同样发现,预防性使用抗生素在降低SAP进展为感染性胰腺坏死的风险方面并未存在有优势,与部分学者[21,22]同样通过Meta分析提出在是否预防性使用抗生素之间并未存在显著差异性的结果相一致。本研究中联合应用左氧氟沙星注射液和甲硝唑注射液进行SAP大鼠腹腔内注射给药,目的是想通过抗生素抑制SAP大鼠肠道内细菌的繁殖和减少转移,可以降低细菌对机体的刺激及内毒素的释放,从而降低血中LPS、TNF-α、IL-6和IL-8的水平。结果显示,在连续四次给药之后,大鼠血中LPS、TNF-α、IL-6和IL-8水平较非抗生素组显著下降(P<0.05),说明早期联合应用抗生素治疗SAP确实能够使血中细胞因子的水平明显减低,从而可能有助于促进SAP的治疗而改善其预后。
SAP时可产生大量的胰腺炎相关性腹水(PAAF)[23],内含有多种毒性和有害物质,如内毒素、淀粉酶、脂肪酶、磷脂酶A、丙二醛、游离脂肪酸以及肿瘤坏死因子、白细胞介素等炎性细胞因子和介质。Fujita等[24]用胰腺炎相关性腹水(pancreatitis-associated ascitic fluids,PAAF)行腹腔灌注进行研究时发现,肺组织中转录因子和NF-κB被激活,TNF-α和IL-1β的mRNA水平显著增加,肺内过氧化物酶活化水平显著增高,肺血管结构破坏,肺泡壁变厚,肺泡间隙增宽。Yang等[25]则证明PAAF可通过激活p38-MAPK和凋亡蛋白酶-3依赖性促凋亡通路来诱导肝损害和干细胞凋亡。方向等[26]用PAAF对正常大鼠腹腔内灌注后亦发现,PAAF可引起大鼠胃黏膜损伤。
因此,有理由相信SAP时腹水有助于疾病的恶化进展,通过腹腔灌洗稀释和引流胰腺炎相关性腹水可能有助于降低胰腺炎的全身损害,从而达到促进SAP好转、改善预后的目的。然而在本研究中,我们比较了在单纯重症急性胰腺炎组与单纯腹腔置管组之间大鼠血中LPS、TNF-α、IL-6和IL-8水平,发现两者之间并不存在显著差异性(P>0.05),从而排除了腹腔引流管可能导致的人为感染。同时,我们还比较了在单纯腹腔灌洗组与单纯腹腔置管组之间大鼠血中LPS、TNF-α、IL-6和IL-8水平,发现两者之间亦不存在显著差异性(P>0.05),提示单纯腹腔灌洗并不能有效降低大鼠血中LPS、TNF-α、IL-6和IL-8水平,推测一方面可能是由于灌洗引流本身仅对存在腹水的状况发生作用,而胰腺内部的自身消化、炎症反应等损害则持续进行;另一方面可能与本实验中灌洗的12 h时间间隔有关。因此,我们提出持续腹腔灌洗可能有助于改善SAP预后,但这需要进一步的实验证实。
另外,在本研究中对SAP大鼠行腹腔灌洗后予腹腔内灌注抗生素后发现,大鼠血中LPS、TNF-α、IL-6和IL-8水平较单纯腹腔灌洗组大鼠血中LPS、TNF-α、IL-6和IL-8水平显著降低(P<0.05),而与非腹腔灌洗但同样使用了抗生素的各组大鼠相比则未见显著差异(P>0.05),提示在SAP早期单纯抗生素联合使用即有可能有助于改善SAP预后,进一步提示在SAP早期间断腹腔灌洗联合抗生素治疗并未优于单纯联合抗生素治疗。因此我们提出在SAP早期可预防性联合抗生素治疗,但腹腔灌洗可能并非是有效的必需措施。然而张宏博等[27]的临床研究则指出,在非手术治疗基础上行腹腔灌注的疗效明显优于单纯非手术治疗,可以减少严重并发症的发生率,降低病死率。这种差别的原因可能与腹腔灌洗的时间间隔、灌洗的持续时间和观察时间的长短不一致等相关。
综上所述,在SAP早期单纯腹腔灌洗并不能有效降低大鼠血中LPS、TNF-α、IL-6和IL-8水平,早期间断腹腔灌洗联合抗生素治疗则可以有效降低大鼠血中LPS、TNF-α、IL-6和IL-8水平,从而可能有助于降低胰腺炎的全身损害,达到促进SAP好转和改善预后的目的。
[1] Aho HJ,Koskensal SML,Nevalainen TJ,et al.Experimental pancreatitis in rat:sodium taurocholate-induced acute hemorrhagic pancreatitis[J].Scand J Gastroenterol,1980,15(2):411 - 416.
[2] Kusser AM,Rongione AJ,Ashley SW,et al.Interleukin-10 prevents death in lethal necotizing pancreatitis in mice[J].Surgery,1996,120(11):284-289.
[3] 吴承堂,黎沽良.一氧化氮、内皮素在急性坏死性胰腺炎肠道损伤中的作用[J].中国普通外科杂志,1999,8(3):210 -212.
[4] Cicalese L,Sahai A,Sileri P,et al.Acute pancreatitis and bacterial translocation[J].Digestive Diseases and Sciences,2001,46(5):1127-1132.
[5] 汪 洁,马保金,吴 钢,等.急性坏死性胰腺炎大鼠肠道黏膜屏障功能的损害及肠道细菌移位[J].中华实验外科杂志,2007,24(5):570-572.
[6] Ammori BJ,Leeder PC,Roderick FGJ,et al.Early increase in intestinal permeability in patients with severe acute pancreatitis:correlation with endotoxemia,organ failure,and mortality[J].Joumal of Gastrointestinal Surgery,1999,3(3):252 -262.
[7] Qiao SF,Lü TJ,Sun JB,et al.Alterations of intestinal immune function and regulatory effects of L-arginine in experimental severe acute pancreatitis rats[J].World J Gastroenterol,2005,11(39):6216 -6218.
[8] van Minnen LP,Blom M,Timmerman HM,et al.The use of animal models to study bacterial translocation during acute pancreatitis[J].J Gastrointest Surg,2007,11(5):682 -689.
[9] 邹忠东,张再重,王 烈,等.肠淋巴途径在大鼠重症急性胰腺炎至全身炎症反应中的作用[J].中国危重病急救医学,2010,22(4):206-209.
[10] PENG JS,LIU ZH,LI CJ,et al.Development of a real-time PCR method for the detection of bacterial colonization in rat models of severe acute pancreatitis[J].Chin Med J,2010,123(3):326 -331.
[11] Madaria E de,Martínez J,Lozano B,et al.Detection and identification of bacterial DNA in serum from patients with acute pancreatitis[J].Gut,2005,54(9):1293 -1297.
[12]邓 群,黎沾良,陆连荣,等.急性坏死性胰腺炎肠黏膜屏障改变与肠源性细菌移位及内毒素血症的关系[J].中华实验外科杂志,2009,17(5):471.
[13]韩德五.肠源性内毒素血症在胰腺炎发病中的作用[J].世界华人消化杂志,2006,14(29):2825 -2829.
[14] Exley AR,Leese T,Holliday MP,et al.Endotoxaemia and serum tumour necrosis factor as prognostic markers in severe acute pancreatitis[J].Gut,1992,33(8):1126 - 1128.
[15]黄超群,朱伟东,钟耀区,等.急性胰腺炎患者血清部分细胞因子水平的变化[J].中国基层医药,2009,16(7):1157 -1158.
[16] Rychter JW,van Minnen LP,Verheem A,et al.Pretreatment but not treatment with probiotics abolishes mouse intestinal barrier dysfunction in acute pancreatitis[J].Surgery,2009,145(2):157 -167.
[17] Golub R,Siddiqi F,Pohl D.Role of antibiotics in acute pancreatitis:A meta-analysis[J].J Gastrointest Surg,1998,2(6):496 -503.
[18] Sharma VK,Howden CW.Prophylactic antibiotic administration reduces sepsis and mortality in acute necrotizing pancreatitis:a meta-analysis[J].Pancreas,2001,22(1):28 - 31.
[19] Heinrich S,Schafer M,Rousson V,et al.Evidence-based treatment of acute pancreatitis:a look at established paradigms[J].Ann Surg,2006,243(2):154 -168.
[20] Dellinger EP,Tellado JM,Soto NE,et al.Early antibiotic treatment for severe acute necrotizing pancreatitis:a randomized,double-blind,placebo-controlled study[J].Ann Surg,2007,245(5):674 -683.
[21] Mazaki T,Ishii Y,Takayama T.Meta-analysis of prophylactic antibiotic use in acute necrotizing pancreatitis[J].Br J Surg,2006,93:674-684.
[22] Xiong GS,Wu SM,Wang ZH.Role of prophylactic antibiotic administration in severe acute pancreatitis:a meta-analysis[J].Med Princ Pract,2006,15(2):106 -110.
[23] Takeyama Y,Nishikawa J,Ueda T,et al.Involvement of peritoneal macrophage in the induction of cytotoxicity due to apoptosis in ascitic fluid associated with severe acute pancreatitis[J].J Surg Res,1999,82(2):163-171.
[24] Fujita M,Masamune A,Satoh A,et al.Ascites of rat experimental model of severe acute pancreatitis induces lung injury[J].Pancreas,2001,22(4):409 -418.
[25] Yang J,Fier A,Carter R,et al.Liver injury during acute pancreatitis:the role of pancreatitis-associated ascitic fluid(PAAF),p38-MAPK,and caspase-3 in inducing hepatocyte apoptosis[J].J Gastrointest Surg,2003,7(2):200 -208.
[26]方 向,程若川,陈玉祥,等.PAAF对大鼠血清TNF-α、内毒素及胃黏膜损伤的影响[J].肝胆外科杂志,2009,21(5):363 -365.
[27]张宏博,刘 理,礼孙力,等.腹腔灌洗引流在重症急性胰腺炎非手术治疗中的作用-附1 04例随机对照研究[J].胰腺病学,2007,7(6):353 -356.
Study on the therapeutic effect of interrupted peritoneal lavage combined with antibiotics on severe acute pancreatitis in rats
WU Yu-lin,LU Bang-yu(The First Affiliated Hospital of Guangxi Medical University,Nanning 530021,China)
ObjectiveTo evaluate the therapeutic effect of interrupted peritoneal lavage(PL)combined with antibiotics on the severe acute pancreatitis in rats. Methods Fifty-six adult Wistar rats(280 g-350 g)were randomly divided into sham operation(SO)group,SAP groups of non-antibiotics+non-drainage tube(SNANT)group,of non-antibiotics+drainage tube(SNAT)group,of antibiotics+drainagetube(SAT)group,of antibiotics+non-drainage tube(SANT),of SAP+PL groups included antibiotic+peritoneal lavage(APL)group,and of non-antibiotics+peritoneal lavage(NAPL)group,with 8 rats in each group.SNANT and SANT models were produced by slow retrograde infusion of 5% sodium taurocholate solution(0.02ml/100g)into the common biliopancreatic duct in Wistar rats.In the SNAT、SAT、APL and NAPL groups,abdominal cavity drainage tube with side holes was introduced into the abdominal cavity at the right lower quadrant of the abdomen based on the SNANT models,and was tied to the rat tail.Peritoneal lavage was performed with normal saline at ambient temperature and narcosis after 12 hours of successful induction of animal models,once per 12 hours and four times in total.The intraperitoneal injection of antibiotics(Left oxygen Buddha injection 40 mg/kg+Metronidazole Injection 90 mg/kg)was performed once in every 12 hours after successful induction of animal models in SANT and SAT groups or next to the termination of peritoneal lavage in APL group.Blood sample and pancreatic tissue were obtained after 12 hours of injection of antibiotics and peritoneal lavage.The blood levels of tumor necrosis factor-α (TNF-α),Interleukin-6(IL-6),Interleukin-8(IL-8),lipopolysaccharide(LPS)were measured by enzyme-linked immunosorbent assay(ELISA).The changes of pathological morphology of pancreatic tissue were evaluated and scored under light microscope after staining with hematoxylineosin-stain.Results(1)Compared with the SO group,the blood levels of TNF-α、IL-6、IL-8、LPS in SAP groups and SAP+PL groups were increased remarkably(P <0.05);Compared with the SNANT group,there were no significantly changes(P >0.05)in the SNAT group and the NAPL group;Compared with the SANT group,there were no significantly changes(P >0.05)in the SAT group and the APL group in the blood levels of LPS、TNF-α、IL-6、IL-8;Compared to the groups without antibiotics including SNANT group,SNAT group and NAPL group,the blood levels of LPS、TNF-α、IL-6、IL-8 in the groups with antibiotics including SANT group,SAT group and APL group were decreased remarkably(P <0.05);Compared with the NAPL group,the blood levels of LPS、TNF-α、IL-6、IL-8 in the APL groups were decreased remarkably(P <0.05).(2)The histological examination of pancreatic tissue showed that:the enlargement of interlobular space,inflammatory infiltration,fat necrosis,hemorrhage,and the destruction or deletion of pancreatic acini were observed in the SAP groups;while in the SAP+PL groups,the enlargement of interlobular space was larger than in the SAP groups,but there was no significantly changes(P >0.05)for the inflammatory infiltration,fat necrosis,hemorrhage,and the destruction or deletion of pancreatic acini between them;there was only dispersive regional edema of interlobular space in the SO group.The total histopathologic scores were significantly increased in SAP groups and PL groups compared to SO group(P <0.05),and there was no statistically significant differences between SAP groups and PL groups(P >0.05).ConclusionThis study suggests that,in the early stage of SAP,interrupted peritoneal lavage combined with antibiotics reduces significantly the blood levels of LPS、TNF-α、IL-6 and IL-8(P < 0.05),and it maybe contributed to the reduction of the systemic damage to promote SAP get better and improve the prognosis of SAP.
Severe acute pancreatitis;Early stage;Peritoneal lavage;Antibiotics;Cytokines;Animal experiment
R 576.1
A
1673-6575(2012)05-0457-06
广西区教育厅科学技术研究专项课题(基金编号:02601209005)
吴裕林(1984~),男,硕士,医师,研究方向:重症急性胰腺炎的基础与临床。*
2012-04-27
2012-06-28)

