PI3K/Akt信号通路上调急性肺损伤大鼠肺泡上皮钠通道表达
邓 旺,王导新,邓 嘉,朱 涛
(重庆医科大学附属第二医院呼吸内科,重庆400010)
PI3K/Akt信号通路上调急性肺损伤大鼠肺泡上皮钠通道表达
邓 旺,王导新*,邓 嘉,朱 涛
(重庆医科大学附属第二医院呼吸内科,重庆400010)
目的 探讨PI3K/Akt信号通路对急性肺损伤(ALI)大鼠肺泡上皮钠通道(ENaC)α、β和γ亚基表达的影响。方法 成年SD大鼠随机分为对照组、ALI组(脂多糖)、胰岛素组及渥曼青霉素组,每组5只。观察肺组织病理改变,收集支气管肺泡灌洗液(BALF),测量总肺水含量,RT-PCR和Western blot测定ENaC mRNA和蛋白、p-Akt表达。结果 胰岛素组BALF蛋白含量、髓过氧化物酶(MPO)活性、总肺水含量较ALI组显著减少(P<0.05),渥曼青霉素组BALF蛋白含量、MPO活性及总肺水含量较胰岛素组显著增加(P<0.05)。ALI组α-、β-和γ-ENaC蛋白表达显著低于对照组(0.33±0.06 vs 1.27±0.07,0.18±0.04 vs 0.72±0.04,0.37±0.04 vs 0.69±0.05)(P< 0.05)。胰岛素组蛋白表达α-ENaC(2.19±0.04)、β-ENaC(1.18±0.07)和γ-ENaC(1.18±0.08)显著高于ALI组(P< 0.05)。渥曼青霉素组蛋白表达α-ENaC(0.86±0.09)、β-ENaC(0.58±0.05)和γ-ENaC(0.59±0.02)显著低于胰岛素组(P<0.05)。胰岛素组ENaC mRNA和p-Akt较ALI组显著升高(P<0.05)。渥曼青霉素组ENaC mRNA和p-Akt较胰岛素组显著降低(P<0.05)。结论 激活PI3K/Akt通路上调3种ENaC亚基表达,从而清除肺水肿液。
急性肺损伤;肺泡上皮钠离子通道;PI3K/Akt信号通路
急性肺损伤(actue lung injury,ALI)时肺泡上皮损伤导致肺泡腔内富含蛋白的水肿液聚集,有效地清除过多的水肿液对维持正常气体交换及预后具有重要意义[1]。同时,肺泡上皮钠通道(epithelial sodium channel,ENaC)是清除肺泡水肿液的重要环节[2]。磷酯酰肌醇3-激酶 (phosphatidylinositol 3-kinase,PI3K)参与细胞分化与代谢,其下游的蛋白激酶B(protein kinase B,Akt)通过胰岛素激活PI3K而活化,是胰岛素作用的重要通路[3]。PI3K/Akt信号通路是一种保护机体应对各种应激的重要生存通路,对肺损伤具有保护作用[4]。胰岛素激活PI3K/Akt信号通路能否参与调控ENaC,并影响ALI肺泡水肿液的清除尚不清楚。本研究建立ALI大鼠模型,观察PI3K/Akt信号通路对ENaC各亚基表达的影响,探讨PI3K/Akt信号通路在ALI中的作用。
1 材料与方法
1.1 实验动物及主要试剂
清洁级雄性SD大鼠20只,体质量(230±20)g[重庆医科大学动物实验中心提供,许可证号:SCXK(渝)2007-0001],重组人胰岛素(EliLilly公司),脂多糖(LPS,E.coli,O111:B4)和渥曼青霉素(Sigma公司),髓过氧化物酶(myeloperoxidase,MPO)检测试剂盒(南京建成工程生物研究所),总RNA提取试剂盒和RT-PCR试剂盒(大连宝生物工程有限公司),α-、β-、γ-ENaC 及 β-肌动蛋白(β-actin)单克隆抗体(Abcam公司),Akt抗体及磷酸化Akt(p-Akt)(Ser473)抗体(Cell Signaling公司)。
1.2 动物模型、分组及血糖监测
给大鼠腹腔注射戊巴比妥(50 mg/kg)麻醉,用微量泵从左侧颈静泵入药物。大鼠随机分为对照组,仅泵入等量的0.9%氯化钠注射液;ALI组,腹腔注射脂多糖(LPS,5.0 mg/kg)建立ALI模型;胰岛素组(LPS+胰岛素),持续泵入胰岛素0.1 U/(kg·h);渥曼青霉素组(LPS+胰岛素+渥曼青霉素),在持续泵入胰岛素0.1 U/(kg·h)的同时,分别于LPS注射前90 min,注射后90及360 min 3次静脉给渥曼青霉素(0.06 mg/kg)。每组大鼠5只。各组药物作用8 h后处死大鼠,收集标本及监测不同时间点大鼠血糖水平。
1.3 病理检查
取右下肺叶组织,常规HE染色,观察肺组织病理学改变。
1.4 总肺水含量(total lung water content,TLW)测定
取右肺上叶,称湿重。然后置于80℃烤箱中烘烤48 h,再称重。根据公式计算:TLW=(湿重-干重)/干重[5]。
1.5 支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)收集
结扎右肺门,常规收集BALF,储存-80℃以备检测蛋白浓度和MPO活性。BALF中的蛋白浓度测定采用BCA法(bicinchoninic acid)。
1.6 RT-PCR
用总RNA提取试剂盒提取肺组织总RNA。PCR引物序列:α-ENaC(509 bp)上游引物:5'-TACC CTTCCAAGTATACACAGC-3',下游引物:5'-CAGAA GGAGACTCCGAATTAGT-3';β-ENaC(406 bp)上游引物:5'-GCTAAAGAGCTAGCAGTAATGG-3',下游引物:5'-CTGGTGTTTGTTATGCCTAGAG-3';γ-ENaC(363 bp)上游引物:5'-GGATCCTGAGAGAGAATC ATGC-3',下游引物:5'-GTGTCCAGCTATGCCCTTT AAC-3';β-actin(871 bp)上游引物:5'-GTACAACCT TCTTGCAGCTCCT-3',下游引物:5'-ACAGGATTCCA TACCCAGGAAG-3'。PCR反应条件:预变性94℃1 min,变性94 ℃ 30 s,退火53 ℃(α-ENaC)、53 ℃(β-ENaC)、55 ℃ (γ-ENaC)和55 ℃ (β-actin)30 s,72℃ 1 min,30个循环。PCR产物8 μL与上样缓冲液混匀,1.2%琼脂糖凝胶电泳。凝胶成像,Quantity One软件分析条带密度,以目的条带与β-actin比值作为结果。
1.7 Western blot检测ENaC蛋白的表达
提取肺组织蛋白,用BCA法测定蛋白浓度,-80℃保存。蛋白样品经10%SDS-聚丙烯酰胺凝胶电泳分离后,转移至硝酸纤维素膜上。用脱脂奶粉封闭1 h,分别加入抗体 α-ENaC(1∶300)、β-ENaC(1∶1 000)、γ-ENaC(1∶1 000)、p-AK(1∶1 000)、Akt(1∶1 000)、β-actin(1∶2 000)4 ℃孵育过夜。洗膜 3遍,加入辣根过氧化物酶标记的二抗室温孵育1.5 h,ECL显色。凝胶成像,Quantity One软件分析条带吸光度值,以目的条带与β-actin比值作为结果。
1.8 统计学分析
所有数据均以均数±标准差(±s)表示,统计分析采用单因素方差分析(ANOVA)或者Student's-t检验,运用SPSS13.0统计软件分析处理。
2 结果
2.1 不同时间点的血糖水平
胰岛素0.1 U/(kg·h)对大鼠血糖无显著影响,血糖维持在4.7~5.2 mmol/L之间。在0、1、4和8 h,胰岛素0.1 U/(kg·h)和渥曼青霉素(0.06 mg/kg)干预,对ALI大鼠血糖也无显著影响。
2.2 肺组织病理变化
对照组(图1A)肺组织未见肺泡及间质明显水肿和炎性细胞浸润,未见透明膜形成。ALI组可见肺泡及间质水肿,出血明显,炎性细胞浸润,肺泡腔内可见透明膜形成(图1B)。胰岛素治疗后,显著减轻肺泡及间质水肿,出血减轻,少量炎性细胞浸润(图1C)。渥曼青霉素干预后,可见肺泡及间质水肿,出血明显,炎性细胞浸润增加,肺泡腔内透明膜形成(图1D)。
2.3 TLW及BALF中蛋白含量和MPO活性变化
与对照组比较,ALI组 TLW明显增加(P<0.05),蛋白含量和MPO活性显著增加(P<0.05)。与ALI组比较,胰岛素组 TLW明显减少(P<0.05),蛋白含量和MPO活性显著降低(P<0.05)。与胰岛素组比较,渥曼青霉素干预后TLW显著增加(P<0.05),蛋白含量和MPO活性显著增加(P<0.05)(表1)。
表1 TLW和BALF中蛋白含量及MPO活性Table 1 TLW and total protein and MPO activity in BALF(±s,n=5)

表1 TLW和BALF中蛋白含量及MPO活性Table 1 TLW and total protein and MPO activity in BALF(±s,n=5)
*P<0.05 compared with control group;#P<0.05 compared with ALI group;ΔP <0.05 compared with Insulin group.
group TLW(g/g) total protein(g/L)MPO activity(U/L)control 1.65±0.42 1.32±0.24 1.16±0.52 ALI 7.39±1.01* 8.54±0.66* 8.86±1.69*insulin 3.02±0.78# 4.83±0.55# 4.21±0.75#wortmannin 5.71±0.99Δ 6.89±0.29Δ 6.61±0.92Δ
2.4 肺组织ENaC mRNA的表达
ALI组 α-、β-、γ-ENaCmRNA 表达比对照组显著降低(P<0.05)。与ALI组比较,胰岛素组α-、β-、γ-ENaCmRNA表达显著升高(P<0.05)。渥曼青霉素干预后 α-、β-、γ-ENaCmRNA 表达较胰岛素组显著降低(P<0.05)(图2,表2)。
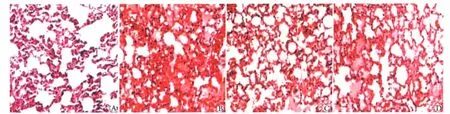
图1 大鼠肺组织形态学改变Fig 1 Histology changes of rat lung(×100)

图2 ENaC mRNA的表达Fig 2 Expression of ENaC mRNA
表2 ENaC mRNA的表达Table 2 Expression of ENaC mRNA(±s,n=5)

表2 ENaC mRNA的表达Table 2 Expression of ENaC mRNA(±s,n=5)
*P<0.05 compared with control group;#P<0.05 compared with ALI group;ΔP <0.05 compared with insulin group.
-ENaC control 0.694±0.054 0.354±0.043 0.226±0.031 group α-ENaC β-ENaC γ ALI 0.152±0.037* 0.148±0.036* 0.122±0.035*insulin 1.164±0.099# 0.602±0.081# 0.440±0.064#wortmannin 0.438±0.075Δ 0.264±0.050Δ 0.168±0.024Δ
2.5 肺组织ENaC蛋白的表达
ALI组 α-、β-、γ-ENaC 蛋白表达较对照组显著降低(P<0.05)。与 ALI组比较,胰岛素组 α-、β-、γ-ENaC蛋白表达显著升高(P<0.05)。渥曼青霉素干预后α-、β-、γ-ENaC蛋白表达较胰岛素组显著降低(P<0.05)(图3,表3)。
2.6 肺组织p-Akt的活化
ALI组中p-Akt表达较对照组明显减少(P<0.05)。与ALI组比较,胰岛素组p-Akt表达明显提高(P<0.05)。渥曼青霉素干预后p-Akt表达较胰岛素组明显减少(P<0.05)(图4,表3)。
3 讨论

肺泡腔内过多的富含蛋白的水肿液聚集导致氧合功能障碍是ALI发生的重要病理生理特征,因此,有效地清除过多的水肿液,维持肺泡腔干燥,能降低ALI的死亡率[6]。最近研究表明在维持正常血糖情况下,外源性胰岛素治疗能减轻 ALI的肺损伤[7]。本研究持续泵入的胰岛素剂量维持了大鼠血糖在正常范围内,没有引起ALI大鼠血糖的显著变化。
表3 肺组织ENaC及p-Akt蛋白的表达Table 3 Expression of ENaC protein and p-Akt in lung tissue(±s,n=5)
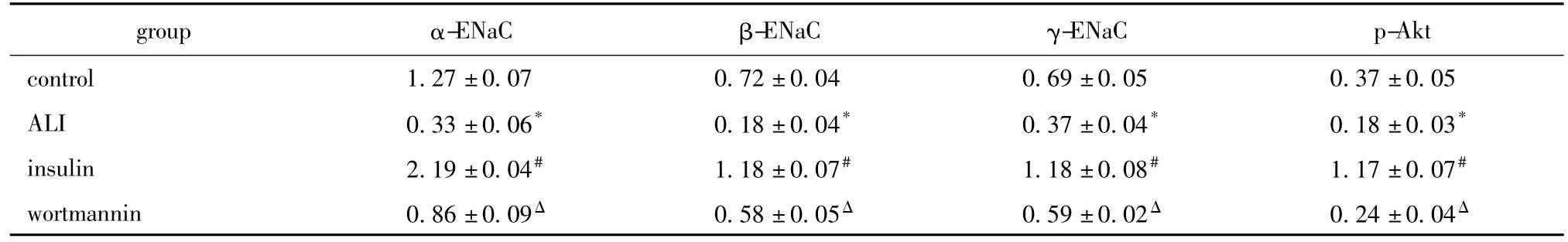
表3 肺组织ENaC及p-Akt蛋白的表达Table 3 Expression of ENaC protein and p-Akt in lung tissue(±s,n=5)
*P<0.05 compared with control group;#P<0.05 compared with ALI group;ΔP <0.05 compared with insulin group.
-ENaC p-Akt control 1.27±0.07 0.72±0.04 0.69±0.05 0.37±group α-ENaC β-ENaC γ 0.05 ALI 0.33±0.06* 0.18±0.04* 0.37±0.04* 0.18±0.03*insulin 2.19±0.04# 1.18±0.07# 1.18±0.08# 1.17±0.07#wortmannin 0.86±0.09Δ 0.58±0.05Δ 0.59±0.02Δ 0.24±0.04Δ
腹腔注入LPS后能激活腹腔巨噬细胞及其他免疫细胞,产生炎性反应介质,吸收入血后使中性粒细胞等炎性细胞聚集在肺毛细血管处,释放活性氧,引起肺泡毛细血管屏障渗漏,导致间质及肺泡水肿[8]。MPO 作为反应中性粒细胞活性的指标[9]。结果显示胰岛素治疗能有效减轻ALI的TLW、BALF的蛋白渗出及 MPO活性和肺损伤程度,肺组织p-Akt表达也显著增加。用渥曼青霉素(抑制PI3K/Akt通路[10])干预后,明显抑制了胰岛素引起的保护效应,肺组织中p-Akt表达也减少。提示,激活PI3K/Akt通路减少了肺水肿液及蛋白渗出,减轻了肺损伤,保护了肺组织。
ENaC由 α、β 和 γ 3个亚基组成。α-、β-和γ-ENaC是肺水肿液清除必不可少的[11]。研究显示胰岛素调控ENaC的表达需要PI3K的参与,但其具体信号通路尚未阐明[12]。本实验显示胰岛素治疗能显著上调 ALI引起的 α-、β-和 γ-ENaC mRNA 及蛋白表达的下降,p-Akt表达增加。渥曼青霉素干预后,α-、β-和γ-ENaC mRNA 及蛋白的表达显著下降,p-Akt表达减少。说明激活PI3K/Akt信号通路能上调 α-、β-和 γ-ENaC 的表达,阻断 PI3K/Akt信号通路则下调α-、β-和γ-ENaC的表达。本结果也显示α-、β-和γ-ENaC表达上调使肺水肿液含量及BALF蛋白渗出减少,进一步证明了激活PI3K/Akt信号通路上调ENaC的表达,从而对过多的蛋白水肿液清除的作用。
综上所述,激活 PI3K/Akt信号通路能上调ENaC的表达,清除ALI时肺内多余的水肿液,从而减轻肺组织损伤。
[1]Berthiaume Y,Matthay MA.Alveolar edema fluid clearance and acute lung injury[J].Respir Physiol Neurobiol,2007,159:350 -359.
[2]Eaton DC,Helms MN,Koval M,et al.The contribution of epithelial sodium channels to alveolar function in health and disease[J].Annu Rev Physiol,2009,71:403 -423.
[3]Taniguchi CM,Emanuelli B,Kahn CR.Critical nodes in signalling pathways:insights into insulin action[J].Nat Rev Mol Cell Biol,2006,7:85 -96.
[4]姜春玲,赵东,张卫星.PI3K/AKT信号通路在全肝缺血再灌注大鼠肺损伤中的作用[J].基础医学与临床,2009,29:627-630.
[5]Li NJ,Li W,He P,et al.Effect of beta3-adrenergic agonists on alveolar fluid clearance in hypoxic rat lungs[J].Chin Med J(Engl),2010,123:1028 -1033.
[6]Dushianthan A,Grocott MP,Postle AD,et al.Acute respiratory distress syndrome and acute lung injury[J].Postgrad Med J,2011,87:612 -22.
[7]彭利静,拓步雄,李慧,等.胰岛素减轻脂多糖致小鼠急性肺损伤[J].基础医学与临床,2010,30:542-543.
[8]Fialkow L,Wang Y,Downey GP.Reactive oxygen and nitrogen species as signaling molecules regulating neutrophil function[J].Free Radic Biol Med,2007,42:153 -164.
[9]Jin SW,Zhang L,Lian QQ,et al.Posttreatment with aspirin-triggered lipoxin A4 analog attenuates lipopolysaccharide-induced acute lung injury in rats:the role of heme oxygenase-1[J].Anesth Analg,2007,104:369-377.
[10]Xu CQ,Liu BJ,Wu JF,et al.Icariin attenuates LPS-induced acute inflammatory responses:involvement of PI3K/Akt and NF-kappaB signaling pathway[J].Eur J Pharmacol,2010,642:146 -153.
[11]Elias N,Rafii B,Rahman M,et al.The role of alpha-,beta-,and gamma-ENaC subunits in distal lung epithelial fluid absorption induced by pulmonary edema fluid[J].Am J Physiol Lung Cell Mol Physiol,2007,293:537 -545.
[12]Blazer YBL,Esterman MA,Vlahos CJ.Insulin-stimulated trafficking of ENaC in renal cells requires PI 3-kinase activity[J].Am J Physiol Cell Physiol,2003,284:1645 -1653.
PI3K/Akt signaling pathway up-regulates the expression of alveolar epithelial sodium channel in acute lung injury rats
DENG Wang,WANG Dao-xin*,DENG Jia,ZHU Tao
(Dept.of Respiratory Medicine,the Second Affiliated Hospital,Chongqing Medical University,Chongqing 400010,China)
ObjectiveTo investigate the role of PI3K/Akt signaling pathway on expression of alveolar epithelial sodium channel(ENaC)α,β and γ subunits in LPS-induced acute lung injury(ALI).MethodsAdult SD rats were randomly divided into control group,ALI group,insulin group and wortmannin group with 5 rats in each.The pathological changes in lung,total lung water content(TLW),bronchoalveolar lavage fluid(BALF)were analyzed and the mRNA and protein level of ENaC and level of p-Akt were determined by RT-PCRand Western blot.ResultsProtein level and MPO activity in BALF and TLW in insulin group were significantly lower than that in ALI group(P<0.05);Protein level and MPO activity in BALF and TLW in wortmannin group were significantly higher than that in insulin group(P < 0.05).Protein levels of α-,β-and γ-ENaC in ALI group were significantly lower than that of control group(0.33±0.06 vs 1.27±0.07,0.18±0.04 vs 0.72±0.04,0.37±0.04 vs 0.69±0.05)(P<0.05).Protein levels of α -ENaC(2.19±0.04),β-ENaC(1.18 ±0.07)and γ-ENaC(1.18 ±0.08)in insulin group were significantly higher than that of ALI group(P<0.05).Protein levels of α-ENaC(0.86 ± 0.09),β-ENaC(0.58 ±0.05)and γ-ENaC(0.59 ±0.02)in wortmannin group were significantly lower than that of insulin group(P<0.05).The mRNA level of ENaC and p-Akt in insulin group were significantly higher than that of ALI group(P<0.05);The mRNA level of ENaC and p-Akt in wortmannin group were significantly lower than that of insulin group(P<0.05).ConclusionsActivation of PI3K/Akt signaling pathway up-regulates the expression of α-,β-and γ-ENaC to eliminate the pulmonary edema fluid.
actue lung injury;epithelial sodium channel;PI3K/Akt signaling pathway
R 563.8
A
1001-6325(2012)09-1004-05
2011-11-10
2011-12-28
国家自然科学基金(30971303)
*通信作者(corresponding author):wangdaoxin1@163.com

