NGB基因转染拮抗庆大霉素耳毒性作用的实验研究*
任毅 周琦# 唐安洲 谭颂华 方勤 谢利红 尹时华
1 广西医科大学附属第一医院耳鼻咽喉头颈外科(南宁 530021)
脑红蛋白(neuroglobin ,NGB)由德国Burmester等[1]于2000年首次报道,是存在于人和小鼠脑内的一种功能类似于肌红蛋白的携氧球蛋白,其具有高的氧亲和力且能和氧可逆性结合。目前研究表明[2~4],NGB是一种分子量约为17 kD的单体,其结合氧的能力弱于肌红蛋白,但是强于血红蛋白。NGB的氧结合特性与脊椎动物肌红蛋白类似,提示二者有类似的功能,即NGB也有贮氧、促进氧向线粒体扩散或直接介导氧向线粒体传递的功能。2005年,尹时华等[5]采用RT-PCR方法,从小鼠脑组织总RNA中扩增出NGB基因的全序列cDNA,构建了携带绿色荧光蛋白(enhanced green fluorescent protein,EGFP)标签的重组质粒pEGFP-NGB,并通过GeneJamer介导NGB基因转染至培养的神经胶质细胞,观察到培养的神经胶质细胞中NGBmRNA和蛋白水平均有较高表达,成功证明了NGB基因离体转染的可行性,为NGB基因治疗提供了理论依据。本实验试图从电生理学和形态学方面证明NGB基因转染对庆大霉素致豚鼠耳毒性的保护作用,从而为今后临床治疗感音神经性聋提供实验依据。
1 材料与方法
1.1 实验动物分组及模型的制备 实验动物为耳廓反射正常、体重300~350克、排除了ABR反应阈大于40 dB SPL的健康花色黑目豚鼠120只(广西医科大学动物实验中心提供),雌雄不限。动物适应性饲养1周后随机分为5组,每组24只,Ⅰ组为空白对照组,不作任何处理,Ⅱ组为人工外淋巴液对照组(经左耳注入人工外淋巴液),Ⅲ组为人工外淋巴液实验组(经左耳注入人工外淋巴液后肌肉注射庆大霉素),Ⅳ组为空质粒转染组(经左耳注入空质粒pEGFP-C1后肌肉注射庆大霉素),V组为NGB基因转染组(经左耳注入pEGFP-NGB后肌肉注射庆大霉素)。庆大霉素(天津药业焦作有限公司)均采用后腿肌肉注射120 mg·kg-1·d-1, 给药14天后停药喂养14天进行检测。动物实验期间每天称重以调整药量。
1.2 感受态细菌的制备和质粒扩增 TSS法制备感受态细菌,转化,挑取pEGFP质粒(尹时华博士课题已构建)单克隆至含50 μg/ L卡那霉素的10 mlLB液体培养基中,37℃震摇220 r/min ,培养16~20 h ,按照质粒小量抽提试剂盒(杭州博日科技有限公司)说明提取质粒,紫外分光光度计测定OD值定量,电泳初步分析其纯度和浓度,并进行基因测序,无基因突变或缺失等。
1.3 阳离子脂质体与质粒复合物的制备 将阳离子脂质体LipofectamineTM2000 (Invitrogen公司)20 μl加入60 μl人工外淋巴液(NaCl 137 mmol/L,KCl 5 mmol/L,CaCl22 mmol/L,NaH2PO4 1 mmol/L,glucose1 1 mmol/L,NaHCO312 mmol/L,MgCl21 mmol/L )中, 轻轻混匀,静置5 min 后加入10 μl 质粒pEGFP - NGB(1 μg/μl) ,充分混匀,室温静置20 min 后备用。同法制备阳离子脂质体-空质粒复合物。
1.4 听性脑干反应测试 各组动物分别于给药前后进行ABR测试。测试仪器为美国智能公司电生理测试仪(美国IHS公司Intelligent Hearing System Smart Ep 2.22)。豚鼠经1%戊巴比妥钠(上海西唐科技公司)35~40 mg/kg腹腔注射麻醉后,置于屏蔽仓内进行测试。记录仪器使用电生理测试仪,插入式耳机于豚鼠外耳道气导给声,短声刺激,最大刺激输出为135 dB SPL。刺激速率21.1 次/秒,带通滤波100~3 000 Hz,扫描时间10 ms,叠加次数为512次。测试声从135 dB SPL开始,以10或5 dB逐项递减或递增,以能引出明确的、可重复的波Ⅲ的最小刺激强度为反应阈。
1.5 耳蜗内微量注射术 1%戊巴比妥钠40 mg/kg 腹腔注射麻醉动物,常规消毒铺巾。左耳后下切口,于听泡背侧用探针找到听泡骨质薄弱点(一般距离外耳门内下5 mm处),用咬骨钳于听泡骨质薄弱处凿开直径约1 cm小孔,手术解剖显微镜下暴露耳蜗底回,用细针在耳蜗底回近圆窗处钻一直径1 mm小孔,用微量注射器将10 μl阳离子脂质体-质粒复合物(V组)缓慢注入耳蜗鼓阶内,缝合耳后切口,Ⅱ、Ⅲ、Ⅳ组以同法分别注入人工外淋巴液或空质粒pEGFP-C1,Ⅰ组则不作任何处理。
1.6 硝酸银染色耳蜗基底膜铺片 行ABR测试后,各组取9只动物,断头取出听泡,暴露耳蜗,摘除听小骨,挑破蜗尖、蜗窗, 用细玻璃管将0.5%硝酸银溶液从蜗尖至蜗底灌洗数次,然后将2.5%戊二醛固定液从蜗尖至蜗底灌洗一至两次,置于4 ℃冰箱中后固定4~6小时。解剖显微镜下行耳蜗基底膜铺片,病理图像分析仪下观察。
1.7 免疫组织化学染色 各组取9只动物,4%多聚甲醛活体灌注动物,断头取出听泡,暴露耳蜗,摘除听小骨,挑破蜗尖、蜗窗,用细玻璃管将4%多聚甲醛从蜗尖至蜗底灌洗数次,置于4 ℃冰箱中后固定4~6小时。耳蜗标本行10% EDTA脱钙,组织石蜡包埋备用,石蜡切片,片厚4 μm,切片脱蜡。切片在3% H2O2中37 ℃孵育20 min,PBS漂洗,将切片放入枸橼酸盐缓冲液高压修复10 min后PBS漂洗,封闭,室温孵育20 min。按1∶200比例滴加稀释的Ⅰ抗NGB多克隆抗体(美国Santa Cruz公司), 4 ℃过夜。PBS漂洗,滴加Ⅱ抗工作液兔抗羊IgG抗体(福州 Maixin-Bio公司),37 ℃孵育30 min;PBS冲洗,滴加SABC,37 ℃孵育20 min。PBS漂洗,显色剂DAB(武汉Boster公司)显色。冲洗,苏木素复染,常规脱水、透明、中性树脂封片。用Olympus CX41显微照像(×400)并进行图像分析,以细胞阳性染色(胞浆和胞核呈棕黄色)的灰度值比较抗原表达量,灰度值越低表示细胞阳性表达越强。
2 结果
2.1 质粒电泳图 提取质粒DNA pEGFP-C1和pEGFP-NGB,稀释50倍后紫外分光光度计定量,OD值均大于0.4,表明其浓度均大于1 μg/μl(DNA浓度=OD值A1×50×稀释倍数×0.001)。通过1%琼脂糖凝胶电泳初步检测质粒DNA的纯度和浓度(图1),基因测序结果显示与原有基因序列一致。

图1 质粒电泳图重组质粒pEGFP-NGB较空质粒pEGFP-C1的分子量大;且二者分子量均大于4 000 bp
2.2 各组动物给药前后ABR反应阈比较 各组动物给药前后ABR反应阈见表1。给药后人工外淋巴液实验组和空质粒转染组ABR阈值比较差异无统计学意义;给药后NGB基因转染组ABR阈值较空白对照组和人工外淋巴液对照组均显著增大(P<0.05),较人工外淋巴液实验组和空质粒转染组均显著降低(P<0.05);给药后NGB基因转染组动物手术耳较非手术耳ABR阈值降低(P<0.05)。

表1 各组动物给药前后ABR阈值比较
注:*与Ⅰ、Ⅱ、Ⅲ、Ⅳ组给药后比较,P<0.05;△与同组左耳给药后比较,P<0.05
2.3 各组动物耳蜗基底膜铺片结果比较 空白对照组和人工外淋巴液对照组动物耳蜗基底膜见一排内毛细胞三排外毛细胞整齐排列,数量无缺失(图2a、b)。给药后人工外淋巴液实验组和空质粒转染组动物耳蜗基底膜均见极少量的毛细胞残存,甚至消失殆尽,残存细胞轮廓和细胞板显示毛细胞的损伤由底回至顶回逐渐加重(图2c、d)。给药后NGB基因转染组动物耳蜗基底膜均见部分毛细胞缺失,且主要是外毛细胞(图2e)。
2.4 各组动物耳蜗免疫组织化学染色检测NGB蛋白表达量的比较 空白对照组(图3a) 和给药后人工外淋巴液对照组(图3b)动物耳蜗基底膜毛细胞无明显NGB蛋白表达。给药后人工外淋巴液实验组(图3c) 和空质粒转染组(图3d) 动物耳蜗均见极少量残存的基底膜毛细胞,无明显NGB蛋白的表达。给药后NGB基因转染组动物耳蜗残存的基底膜毛细胞有一定量的NGB蛋白表达(图3e)。各组动物给药后耳蜗基底膜毛细胞NGB蛋白表达的灰度值比较见表2。



图2 各组动物耳蜗基底膜铺片(硝酸银染色×400)
a 空白对照组动物左耳蜗基底膜毛细胞排列整齐,无缺失;b 给药后人工外淋巴液对照组动物左耳蜗基底膜毛细胞排列整齐,无缺失;c 给药后人工外淋巴液实验组动物左耳蜗基底膜均见毛细胞大量缺失;d 给药后空质粒转染组动物左耳蜗基底膜均见毛细胞极少量残存,几乎消失殆尽;e 给药后NGB基因转染组动物左耳蜗基底膜均见毛细胞少量缺失
图3 各组动物耳蜗毛细胞NGB蛋白的表达(SP染色×400)
a 空白对照组动物左耳蜗基底膜毛细胞无阳性表达;b 给药后人工外淋巴液对照组动物左耳蜗基底膜毛细胞无阳性表达;c 给药后人工外淋巴液实验组动物左耳蜗基底膜毛细胞破坏明显,无阳性表达;d 给药后空质粒转染组动物左耳蜗基底膜毛细胞破坏明显,无阳性表达;e 给药后NGB基因转染组动物左耳蜗残存的基底膜毛细胞有一定量阳性表达(黑色长箭头示外毛细胞,短箭头示内毛细胞)
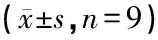
表2 各组动物给药后耳蜗基底膜毛细胞NGB蛋白表达量的灰度值比较
注:*与其余各组比较,灰度值降低,NGB蛋白的表达量显著增多(P<0.05),△与非手术耳比较,灰度值降低,NGB蛋白的表达量显著增多(P<0.05)
3 讨论
基因治疗是将正常的外源基因导入生物体靶细胞内,通过外源基因的表达弥补体内缺失或缺陷基因的生物功能,或抑制某些有害基因的表达,达到治疗疾病目的的一种方法。Izumikawa等[6]首次证实Atoh1基因转染至成年耳聋哺乳动物的耳蜗后,Corti器可获得广泛的结构和功能的恢复。近年也有实验发现Atoh1基因转染至氨基糖苷类耳中毒豚鼠的内耳,可促使前庭及耳蜗的毛细胞再生和功能恢复[7,8],以上实验证明基因治疗应用于内耳结构及功能恢复是可行的。选择合适的载体系统是基因治疗的关键之一,目前基因治疗常用载体可分为两大类:病毒载体和非病毒载体。阳离子脂质体属于非病毒载体,它通过离子的相互作用可以有效地将任何分子量大小的DNA紧密结合,转染各种细胞,而且不整合到宿主细胞基因组中,因此阳离子脂质体安全可靠,它既不会诱发细胞突变,也没有免疫原性,而且容易大量制备[9]。阳离子脂质体介导的基因转染的效率一直是人们关注的焦点,Zhu等[10]的研究表明,阳性脂质体介导的转基因表达可以持续9周以上。目前,阳离子脂质体载体的安全性及有效性已在体内外实验中得到证实,Hsiao等[11]的动物实验表明,脂质体介导的基因转染可以抑制肿瘤的生长,明显延长动物的生存期。
本研究结果显示,单纯人工外淋巴液注入豚鼠耳蜗后其听功能及形态学不受影响;NGB基因转染实验组动物听功能和形态学受损程度较人工外淋巴液实验组和空质粒对照组小。NGB基因转染组动物手术耳耳蜗基底膜毛细胞NGB蛋白表达量较其它各组均有显著增高,说明本实验将NGB基因成功转染至动物耳蜗基底膜毛细胞,可使NGB基因转染组豚鼠在庆大霉素耳中毒后其ABR反应阈增幅降低和毛细胞形态破坏的程度减轻。
氨基糖苷类抗生素对耳蜗毛细胞及螺旋神经节细胞有破坏作用,引发不可逆的感音神经性听力损失,已在大量的基础实验中得以充分证实。有学者提出其机制[12]是由氨基糖苷类抗生素损伤内耳细胞线粒体功能,导致细胞内ATP下降、离子浓度失衡,从而影响细胞换能所致。研究发现[13],NGB作为携氧球蛋白,能够增强细胞将氧扩散进入线粒体的能力,提高氧利用率,满足细胞活跃的需氧代谢需求。本实验将阳离子脂质体介导NGB基因转染技术应用于氨基糖苷类药物损伤的豚鼠耳蜗,从本文结果看,对耳蜗的形态及功能起到了一定保护作用,其原因可能为:当氨基糖苷类抗生素损伤内耳细胞线粒体功能时,扩散至线粒体的氧减少,阻碍细胞代谢活动,而将NGB基因转染至内耳后,可提高受损的线粒体内氧含量,进而改善细胞代谢活动中的缺氧情况,减轻氨基糖苷类抗生素造成的内耳损伤。对于NGB基因转染拮抗庆大霉素耳毒性的具体机制,有待进一步研究。
1 Burmester T, Weich B, Reinhardt S, et al. A vertebrate globin expressed in the brain[J]. Nature,2000 ,407:520.
2 Garry DJ, Mammen PP. Neuroprotection and the role of neuroglobin[J]. Lancet , 2003 ,362:342.
3 Wystub S, Laufs T, Schmidt M, et al. Localization of neuroglobin protein in the mouse brain[J].Neurosci Lett , 2003 ,346:114.
4 Pesce A, Bolognesi M, Bocedi A, et al. Neuroglobin and cytoglobin. Fresh blood for the vertebrate globin family[J]. EMBO Rep, 2002 , 3:1 146.
5 尹时华,龚树生,鄢开胜,等.重组小鼠质粒pEGFP-NGB的构建和在培养神经胶质细胞中表达的实验研究[J].中国病理生理杂志,2005,21:1 388.
6 Izumikawa M, Minoda R, Kawamoto K, et al. Auditory hair cell replacement and hearing improvement by Atoh1 gene therapy in deaf mammals[J]. Nat Med,2005, 11:271.
7 Staecker H, Praetorius M, Baker K, et al. Vestibular hair cell regeneration and restoration of balance function induced by math1 gene transfer[J]. Otol Neurotol,2007,28:223.
8 Ladrech S, Wang J, Simonneau L, et al. Macrophage contribution to the response of the rat organ of Corti to amikacin[J]. Neurosci Res,2007,85:1 970.
9 Wareing M, Mhatre AN, Pettis R, et al. Cationic liposome mediated transgene expression in the guinea pig cochlea[J]. Hear Res,1999,128:61.
10 Zhu N, Liggitt D, Liu Y, et al. Systemic gene expression after intravenous DNA delivery into adult mice[J]. Science,1993,261:209.
11 Hsiao M, Tse V, Carmel J, et al . Stabilization of cationic liposome plasmid DNA complexes by polyamines and poly (ethylene glycol) phospholipid conjugates for efficient in vivo gene delivery[J].FEBS Lett,1997,400 :233.
12 李昱,王爱梅.氨基糖甙类抗生素耳毒性的研究进展[J].医学综述,2008,14:459.
13 Vallone B, Nienhaus K, Matthes A, et al. The structure of carbonmonoxy neuroglobin reveals a heme-sliding mechanism for control of ligand affinity[J]. Proc Natl Acad Sci USA, 2004,101:17 351.

