小鼠过敏模型在食品过敏原分析中的研究与应用
蒋栋磊, 孙秀兰*, 张银志, 单晓红,管 露, 尤继明, 李红梅
(1.江南大学 食品学院,江苏 无锡 214122;2.食品科学与技术国家重点实验室,江南大学,江苏 无锡 214122;3.国家有机食品质量监督检验中心,江苏 宝应 225800)
小鼠过敏模型在食品过敏原分析中的研究与应用
蒋栋磊1, 孙秀兰*1, 张银志2, 单晓红1,管 露1, 尤继明3, 李红梅3
(1.江南大学 食品学院,江苏 无锡 214122;2.食品科学与技术国家重点实验室,江南大学,江苏 无锡 214122;3.国家有机食品质量监督检验中心,江苏 宝应 225800)
建立牛乳蛋白、河虾蛋白的ICR小鼠过敏模型,检测食品过敏原体外激发小鼠致肥大细胞的组胺释放率,探讨食品过敏原鉴定并验证所建过敏原体外评价新方法。方法 以牛奶蛋白、河虾蛋白,氢氧化铝佐剂免疫ICR小鼠,建立IgE高反应性食物过敏动物模型。间接ELISA测定激发后第7、14、21 d血清中过敏原sIgE水平;并在激发第14 d分离小鼠腹腔肥大细胞,过敏原体外激发,紫外分光光度法检测类胰蛋白酶定向释放水平。①模型小鼠血清sIg E水平明显高于对照组,且在过敏激发后第14 d sIgE效价最高,河虾组和牛奶蛋白组的sIg E效价分别达到1/25 600和1/12 800。②牛奶组类胰蛋白酶释放率达38.5%;河虾组的类胰蛋白酶释放率达47.1%,所有模型组与对照组间差异均达显著水平(P<0.05)。建立了一种小鼠过敏模型,通过检测过敏原体外激发类胰蛋白酶释放率可以作为一种鉴定与评价食品过敏原的有效方法。
sIgE;类胰蛋白酶;肥大细胞;食品过敏原
食品过敏原的安全问题已引起广泛的关注,其潜在的过敏源性是急需研究的新课题。过敏症是在全世界广泛流行的一类常见变态反应性疾病,由于其症状复杂,种类繁多,危害广泛且难以根治,成为长期以来医学界的一大难题[1],食品过敏原或混合物的分布范围非常广泛,包括农作物、畜禽产品、水产品、水果、蔬菜等。世界粮农组织(FAO)1995年报告[2],90%以上的食物过敏是由牛奶、鸡蛋、鱼、贝壳海产品、花生、大豆、坚果类和小麦引起。
牛乳是母乳特别重要的替代品,也是新生儿最早接触到的过敏原之一,因而牛乳过敏在婴幼儿中最常见。通常引起牛奶过敏的过敏原主要有酪蛋白、β-乳球蛋和α-乳白蛋白,其中以β-乳球蛋白的过敏活性最高[3]。在发达国家 ,有2%~7.5%的婴幼儿发生牛奶过敏症这主要是由于其抗消化活性最高从而导致在肠内不易失去过敏性的缘故。
虾中过敏原组分有多种,2004年赖荷等研究发现,虾中存在12种过敏原组分[4],最主是相对分子质量(M)为36 000左右的原肌球蛋白,由于不同过敏症患者对不同过敏原组分的敏感度不同,同时获得多种纯化、单一过敏原组分较难,影响了虾过敏症诊断和过敏原检测的灵敏度,导致虾过敏原标准化的困难。
IgE介导的免疫应答是食品过敏的主要效应,为I型超敏反应,由Th2型T淋巴细胞的活化介导体液免疫应答。在小鼠体内,Th2反应主要引起IgE和IgG1型抗体产生,而Th1反应产生IgG2a型抗体[5]。脾脏是机体最大的免疫器官,当血液中出现外源体时,脾脏中的巨噬细胞、淋巴细胞会发生免疫反应,吞食外源体,结果造成脾脏肿大,因此可以把脾脏的外形变化作为鉴定致敏效果的指标之一。
本研究用河虾蛋白和牛奶蛋白免疫ICR小鼠,建立食物过敏症动物模型,间接ELISA检测过敏原特异性IgE效价,紫外法测定腹腔肥大细胞体外类胰蛋白酶定向释放,证实成功建立了河虾和牛奶过敏的动物模型,为建立体外过敏原评价体系奠定了基础,为食品过敏原的标准化及解决食品中过敏原表示等问题提供技术支持。
1 材料与方法
1.1 主要试剂及仪器
山羊抗小鼠IgE抗体:Sigma公司产品;precoll分离液:上海源叶生物公司产品;ICR小鼠:无锡惠山实验动物养殖中心;96孔8×12可拆酶标板:上海春博生物实验仪器有限公司产品,Multiskan MK3酶标仪:Thermo Labsystems公司产品;WFJ2000型722紫外分光光度计:上海市三分析仪器厂生产。
1.2 实验动物与分组
ICR小鼠21只,雌性,6~8周龄,体重约16~18g,随机分为3组:虾蛋白致敏组、牛奶蛋白致敏组及PBS对照组,实验组各9只,对照组3只。用不含河虾蛋白和牛奶蛋白的特种饲料喂养。
1.3 过敏原制备
实验用过敏原参照《变态反应学实验技术》[6]制备,过敏原蛋白经过脱脂、浸提、冷冻离心后进行硫酸铵分级沉淀和等电点沉淀,经透析后获得比较纯净的过敏原蛋白。用考马斯亮蓝法进行蛋白质定量,PBS稀释到10 mg/m L,0.25μm微孔滤膜过滤除菌、分装,-20℃贮存,备用。
1.4 小鼠免疫
小鼠饲养7 d后开始免疫,取1 mg/m L过敏原蛋白提取液与2.5 mg/m L Al(OH)3佐剂等体积混匀后,按分组腹腔注射0.2 m L/只,对照组注射等体积0.01 mol/L,p H 7.4 PBS,每隔一周激发1次,一共激发3次,期间观察激发后小鼠过敏症状。各实验组9只小鼠又分为3小组,分别在激发后第7、14、21 d各组分别眼球采血,分离血清,-20℃贮存备用。小鼠处死后立即收集腹腔肥大细胞用于体外组胺释放测定。
1.5 腹腔肥大细胞的分离和纯化
腹腔肥大细胞的采集参照《肥大细胞体外脱颗粒的检测方法》[7]中的方法加以改进。小鼠眼球采血处死后,向小鼠腹腔注射5 m L HBSS液,按摩小鼠腹部5 min,抽取腹腔液。将其缓慢注入到体积比30%∶80%的percoll梯度分离液中。室温下1 000r/min离心10 min,吸出中间层的细胞,即为肥大细胞。用HBSS液调至10 m L/管,充分混匀后,1 500 r/min离心10 min,重复两次。冲洗后的细胞重新悬浮于3 m L HBSS液中,置于4℃,备用。
1.6 肥大细胞的计数与鉴定
光镜下计数,调细胞浓度至105个细胞/m L。分别用台盼蓝和甲苯胺蓝染色,镜下观察活细胞和肥大细胞纯度比例。按常规制作标本,观察过敏原激发前后肥大细胞形态变化。
1.7 小鼠脾脏观察及占体重比值计算
取血前称量小鼠的体质量记作m1,解剖取脾脏称取其质量,记作m2,比较致敏组和对照组的m1/m2值,即脾脏占体重的百分比,来评价致敏作用的效果。
1.8 间接ELISA检测小鼠血清过敏原sIgE
用p H9.4碳酸盐缓冲液稀释过敏原包板,4℃过夜,PBS-T(含体积分数0.05%Tween-20)洗板5次,每次3 min;5 g/d L脱脂奶粉200μL孔封闭,37℃,湿盒中温育2 h后洗板;加待测血清和阴性对照血清,37℃反应2 h,同上洗涤;加山羊抗鼠IgE抗体(1∶5 000稀释),37℃反应2 h,同上洗涤;加底物OPD,37℃显色15 min;2 mol/L H2SO450μL孔终止反应,15 min内在酶标仪上测量OD值(A450)。
1.9 体外类胰蛋白酶定向释放测定
类胰蛋白酶活力测定采用专一性底物[8]α-N-苯甲酰-DL-精氨酸-P-硝基苯胺(Na-benzoyl-DL-arginine-P-nitroanilide,BAPNA)。BAPNA以20 g/L溶于二甲基亚砜,取40μL加入含1 m L细胞上清的Tris-HCl(0.1 mol/L,p H7.4)反应缓冲液1.5 m L中,37℃反应30 min后,加入0.5 m L 300 m L/L乙酸终止反应。相应的细胞被1.5 m L反应缓冲液重悬后,经过细胞破碎仪彻底破碎,其他处理方式同上清。在405 nm测光吸收值。以反应缓冲液做参比调零。根据制定的类胰蛋白酶标准曲线计算细胞上清中的类胰蛋白酶含量与细胞中的类胰蛋白酶含量。释放率=上清的类胰蛋白酶/(上清类胰蛋白酶+胞内类胰蛋白酶)×100%。校正类胰蛋白酶释放率=类胰蛋白酶释放率-空白对照组类胰蛋白酶自发释放率。
2 结果与分析
2.1 致敏小鼠过敏症状分析
第一次免疫后,致敏组ICR小鼠出现明显过敏症状,前爪频繁搔挠口鼻处,体毛直立,身体颤抖,呼吸频率加快,精神萎靡,活动减少[9];对照组无过敏症状,说明小鼠过敏症模型建立成功。
2.2 肥大细胞计数鉴定及光镜观察
经染色后光镜下计数观察:分离纯化的腹腔肥大细胞台盼蓝染色,细胞数为105个/m L,活细胞占总细胞的94%,甲苯胺蓝染色,纯度91%。正常肥大细胞核较大,胞内有许多致密小颗粒。光镜观察可见正常细胞呈圆球形,轮廓清楚、完整(见图1);牛奶、河虾致敏组脱颗粒细胞形态变得不规则,表面出现一些空洞,轮廓模糊不清(如图2、3)。

图1 PBS对照组PMCFig.1 Peritoneal mast cell of PBS control group
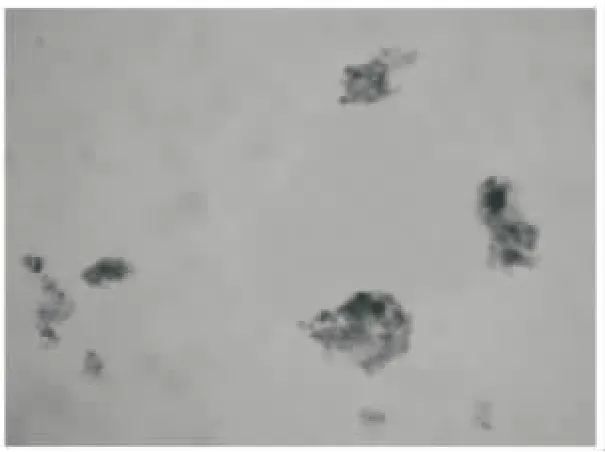
图2 牛奶致敏组PMCFig.2 Peritoneal mast cell of milk sensitized group

图3 河虾致敏组PMCFig.3 Peritoneal mast cell of shrimp sensitized group
2.3 脾脏观察与称重
激发后取小鼠脾脏,每周一次,连续3周,分别计算致敏组和PBS对照组脾脏占体质量的比值(质量百分比),发现致敏组小鼠脾脏占体重比值明显大于对照组,说明发生了脾脏肿大,结果如图4:
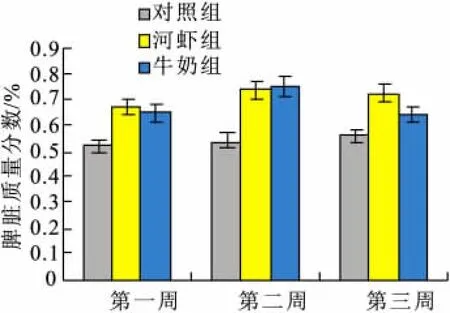
图4 不同致敏组小鼠脾脏质量比较Fig.4 Comparison of mice splean weight in different sensitized groups
2.4 模型小鼠血清sIgE水平
分别于初次免疫激发前(0 d)和激发后第7、14、21天检测河虾组、牛奶组及对照组小鼠血清过敏原slgE效价。结果判定以阳性OD值为阴性2.1倍为准。不同时间及不同组别小鼠血清sIgE效价如表1所示。可见各组血清sIgE效价均在激发后第7天已上升,第14天达到最高,第21天又有所下降。从表1中还可看出免疫河虾蛋白组比免疫牛奶组致敏效果更佳。
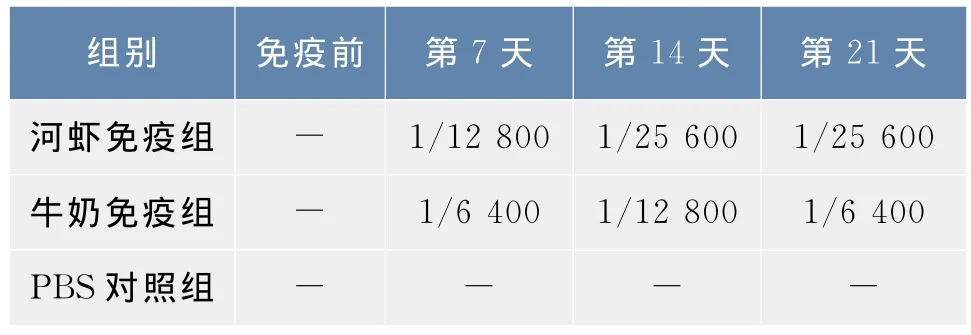
表1 过敏原激发的sIgE效价Tab.1 Titer of sIgE sensitized by allergen
2.5 类胰蛋白酶释放率测定结果
因各组小鼠均在激发后第14天sIgE效价最高,故选择在激发后第14天测定腹腔肥大细胞组胺定向释放,结果如图5。图5为免疫牛奶组定向释放率达38.5%,免疫河虾组达到47.1%,对照组为5.7%。数据均为每组测量3只小鼠取平均值,t检验,所有实验组与对照组比较呈显著差异(P<0.05)。
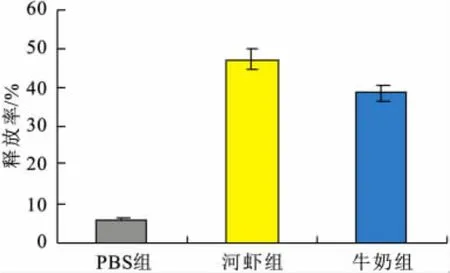
图5 不同致敏组类胰蛋白酶释放率Fig.5 Release rate of Trypsin in different groups
3 结语
食物过敏主要是I型过敏反应(速发性过敏反应),具体作用机制是肥大细胞膜特异性受体结合Ig E抗体,经过抗原的交联作用,激活了肥大细胞,促使其脱颗粒,释放出多种类型的过敏介质如组胺,而产生食物过敏症状,其中,全身性反应(如血压下降导致的休克)是最严重的反应[10]。所以本研究选择sIgE和组胺作为评价过敏状态的指标。
虽然Balb/c系小鼠受过敏原刺激后能产生高滴度的IgE,是常用于食物过敏性研究中的品系。但由于其价格昂贵,养殖要求比较高,死亡率较高,故本实验选用ICR小鼠进行建模对象,据报道ICR果[14]表明类胰蛋白酶占肥大细胞蛋白酶的25%,在细胞上清液中含量较高,易于检出,此外类胰蛋白酶的检测方法简单,不需要形成荧光物质参与反应,相比组胺的常规检测有明显优势,它能够更精确、更稳定的反映肥大细胞脱颗粒的程度,因此更适合作为检测肥大细胞脱颗粒时的标志物。因激发后第14天过敏原sIgE水平最高,故测定了第14天腹腔肥大细胞的类胰蛋白酶定向释放率,实验组都明显高于对照组,统计分析呈显著性差异,且与sIgE检测结果相对应。
此外,由于脾脏是机体最大的免疫器官,可以制造免疫球蛋白、补体等免疫物质,发挥免疫作用。当血液中出现病菌、抗原、异物、原虫时,脾脏中的巨噬细胞、淋巴细胞会发生免疫反应,吞食外源体,结果造成脾脏肿大,因此可以把脾脏的外形及重量变化作为鉴定致敏效果的指标之一。实验结果表明,致敏组小鼠脾重占体重比值明显大于对照组,且河虾致敏组的脾脏比值最大,说明致敏组小鼠体内确实发生了较明显的免疫反应,且河虾蛋白致敏效果更为明显。
综上本研究用河虾、牛奶蛋白皮下免疫ICR小鼠建立了过敏症模型 ,腹腔肥大细胞体外定向组胺释放率和特异性Ig E水平检测可用于食品过敏原鉴定与评价 ,对研究食物过敏症的诊断和治疗具有十分重要的意义。小鼠也是进行免疫药物筛选,复制病理模型较常用的实验动物,并且根据本研究结果看出,选用ICR作为实验对象也能较好的得到需要的结果,小鼠经过河虾、牛奶蛋白的免疫体内确实产生了较为强烈的免疫反应,并通过血清效价和肥大细胞组胺释放率表现出来。建立过敏模型主要有经胃肠道(口服)和非胃肠道(腹腔或皮下注射)这两大类途径,虽前者更好模拟了食物引起人们过敏的途径,但易导致免疫耐受;后者不但能避免口服耐受,且能引起更高滴度sIg E的产生[11]。本实验选用了河虾和牛奶两种致敏原,通过腹腔注射致敏途径建立动物模型。间接ELISA结果表明,无论注射河虾组还是牛奶组均产生了较高滴度的sIgE抗体,分别在3个不同时间点检测sIg E水平,激发后第14天IgE效价达到最高。比较河虾组和牛奶组,结果显示河虾蛋白致敏效果要优于牛奶蛋白。
肥大细胞在变态反应性疾病发病机制具有核心作用,是连接变态反应的诱导阶段与效应阶段的纽带,有将过敏原的信号放大的能力。组胺是经典的过敏介质,以往主要用来标记肥大细胞脱颗粒的程度[12],但是Schwartz等[13]曾报道组胺这种物质在生理条件下半衰期很短,仅为几分钟,且释放不够稳定,所形成的荧光物质易分解,重复性差,从而导致检测结果的不稳定。而类胰蛋白酶是肥大细胞内预先合成的蛋白酶经肥大细胞脱颗粒释放出胞外与其他介质一起参与过敏反应。有研究结
(References):
[1]聂凌鸿.食品过敏原研究进展[J].生命的化学,2002(22):474-477.
Nie ling-hong the process of research in food allergen[J].Chemistry of Life,2002(22):474-477.(in Chinese)
[2]Food and Agriculture Organization,FAO Report of the FAO Technical Consultation on Food Allergies[R].Rome:1995.
[3]BUORO S,FERRARESE P,CH IAVEGATO A,et al,Myofibroblast-derived smooth muscle cells during remodeling of rabbit urinary bladder wall induced by partial outflow obstruction[J].Lab Invest,1993,69(5):589-590.
[4]Zwimer NW,Fuertes MB,Ginm MV,et a1.Cytokine-driven regulation of NK cell functions in tumor immunity:Role of the MICA-NKG2D system[J].Cytokine Growth Factor Rev,2007,18(1):159-70.
[5]Halstensen ST.Why are we not all allergic:basic mechanisms for tolerance development[J].Environ Toxicol Phanmcol,1997,4:25-26.
[6]乔秉善.变态反应学实验技术[M].北京:中国协和医科大学出版社,2002.6-36.
[7]郭薇,陈玉川,刘水平,等.肥大细胞体外脱颗粒的检测方法[J].中国病理生理杂志,2002,18(8):1023-1025.
GUO wei,CHEN yu-chuan,LIU shui-ping et al.A new method on testing the degranulation of mast cells in vitro[J].Chinese Journal of Pathophysiology,2002,18(8):1023-1025.(in Chinses)
[8]LavensSE,ProudD,Warner JA.A sensitive colorimetric as assay for the release of tryptase from human lung mast cells[J].J Immunol Methods,1993,166(1):93-102.
[9]PEI C,ANDREW J,STUART K.Protein quality and physico-functionality of Australian sweet lupin(Lupinus angustifolius cv.Gungurru)protein concentrates prepared by isoelectric precipitation or ultrafiltration[J].Food Chemistry,2003,83:575-583.
[11]Dearman RJ.Kimber I.Determination protein allergenicity:studies in mice[J].Toxicology letters,2001,120:18-20.
[12]孙仁山.肥大细胞脱颗粒的标志[J].国外医学·临床生物化学与检验学分册,2001,22(2):100-101.
SUN ren-shan.The symbol of Mast cells degranulation[J].Foreign medical sciences,2001,22(2):100-101.(in Chinses)
[13]Schwartz LB,AtkinsPC,Bradford TR,etal.Release of tryptase together with histamine during the immediate cutaneous response to allergen[J].J Allergy Clin Immunol,1987,80(6):850-855.
[14]郭永超,组胺、类胰蛋白酶、β-己糖胺酶在肥大细胞体外释放过程中的相互关系[J]细胞与分子免疫学杂志。2009.25(12):1073-1075.
GUO yong-chao.Investigation on the relationship among histamine,tryptase andβ-hexosam inidase in the process of mast cell degranulation[J].Chinese journal of cellular and molecular immunology,2009.25(12):1073-1075.(in Chinses)
Construction and Application of Allergic Models with ICR Mice in Vitro for Analysis of Food Allergens
JIANG Dong-Lei1,SUN Xiu-Lan*1,ZHANG Yin-Zhi2,SH AN Xiao-hong1,GUAN lu1,YOU Ji-ming3,LI Hong-mei3
(1.School of Food Science and Technology,Jiangnan University;2.State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi 214122,China;3 The National Center of Supervision and Inspection for Organic Food Quality;Bao YING 225800,China)
Objectives To establish allergic model with ICR mice for milk and shrimp protein,develop a novel technique based on determining histamine release from mouse sensitized cells stimulated in vitro for assessing and identifying food allergens.Methods The ICR mice were immunized by injection of river shrimp proteins or milk proteins with aluminum hydroxide as adjuvant.The sensitized mouse were challenged for one time at 7th day after sensitization.The sIgE of food allergens was measured by indirect ELISA at 7/14and 21days after challenge;and the peritoneal Mast cells were collected at 14th day and were stimulated by allergen in vitro.The liberation of tryptase was measured by ultraviolet spectrophotometry assay and was converted to releasing rate for statistical analysis with Student's system.Results①The levels of sIgE in the experimental groups were higher than on control at three different points.They reached the peak at14day after challenge,with a value of 1/25600 in river shrimp and 1/12800 in milk group.②The tryptase liberation ratio group was 38.5%in milk group and 36.14%in control group;The liberation ratio was 74.5%in river shrimp group and 47.1%in the control.All the model groups revealed significant difference compared with the control(P<0.05).Conclusion The present data indicated that tryptase release test with sensitized cells from mouse model challenged by food allergen in vitro maybe a prospective technique for assessing and identifying food allergens.
sIg E tryptase mast cell food allergy
TS 201.6
A
1673-1689(2012)05-0499-06
2011-06-21
国家自然科学基金项目(20806033);国家“十二五”科技支撑计划项目(2011BAK10B03);国家973计划项目(2012CB720804);2010年度公益性行业(农业)科研专项项目(201003008-08);江苏省质监局立项项目(KJ122704)。
*
孙秀兰(1976-),女,山东聊城人,工学博士,教授,博士研究生导师,主要从事食品安全检测方面研究。E-mail:sxlzzz@yahoo.com.cn

