含卤素杯[4]芳烃衍生物的合成及其对金属离子的萃取性能
杨华成,咸春颖
(东华大学 化学化工与生物工程学院,上海201600)
含卤素杯[4]芳烃衍生物的合成及其对金属离子的萃取性能
杨华成,咸春颖*
(东华大学 化学化工与生物工程学院,上海201600)
以对叔丁基苯酚为原料,经逐步反应在对叔丁基杯[4]芳烃的下缘引入含卤素的基团,得到了一系列含卤素的杯[4]芳烃衍生物(记为1,2,3,4);利用核磁共振谱和气相色谱-质谱证实了目标产物的结构;并评价了产物对水中的Cr3+、Cu2+、Ag+的萃取性能.结果表明:杯[4]芳烃衍生物2、3和4分别对Cr3+、Cu2+和Ag+具有较好的萃取效果.
卤素;杯[4]芳烃;衍生物;合成;金属离子;萃取性能
杯芳烃是由对叔丁基苯酚和甲醛缩合而成的一类环状低聚物[1],具有类似于环糊精和冠醚的洞穴结构作为第三代超分子主体化合物[2-3]具有以下优点:(1)它是一类合成的低聚物,其空穴结构和尺寸具有较大的调节自由度;(2)杯上缘和下缘都容易进行化学修饰,可获得众多的衍生物;(3)杯芳烃的热稳定性和化学稳定性好;(4)在上缘和下缘引入适当的功能基团后,能借助于氢键、静电作用、π-π堆积作用及诱导契合等非共价键协同作用来识别客体分子,从而实现配位、催化和能量转换等特殊功能[4-5];(5)杯芳烃合成较为简单,易获得较为廉价的产品.
近年来,由重金属引发的环境污染已受到广泛关注.化学家们一直都在探索高效、高选择性的金属离子萃取剂.由于含有特定官能团的杯芳烃衍生物能与金属离子形成稳定的络合物,因此可以用于多种金属离子的萃取.张春雷等[6-7]报道的含氟(F)和氯(Cl)端基的杯芳烃衍生物对水中的有毒重金属具有良好的诱导契合能力,可用于废水的处理.但整体来讲,有关含卤素杯芳烃衍生物的研究报道较少,含碘(I)的杯[4芳烃衍生物4的合成则未见报道.本文作者按图1所示路线合成了含氯(Cl)、溴(Br)、碘(I)的杯[4]芳烃衍生物2、3和4,考察了它们对水中Cr3+、Cu2+和Ag+的萃取性能.
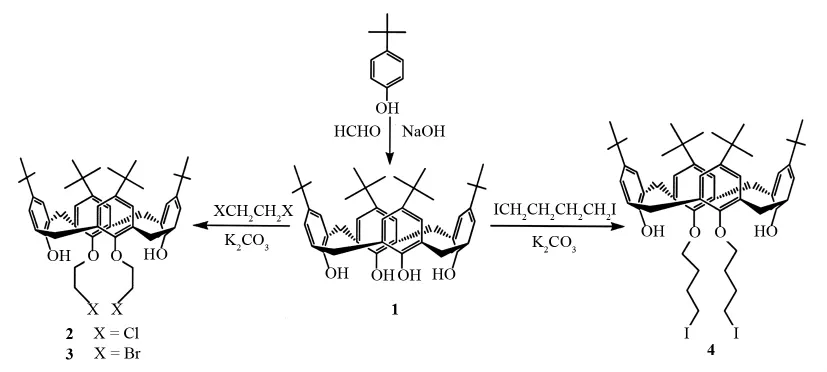
图1 杯[4]芳烃衍生物的合成路线Fig.1 Synthetic route to halocalix[4]arenes
1 实验部分
1.1 仪器和试剂
对叔丁基苯酚、1,2-二溴乙烷、1,2-二氯乙烷、1,4-二碘丁烷、氢氧化钠、甲醛、二苯醚、乙酸乙酯、乙酸、甲醇、氯仿、无水碳酸钾、无水氯化钙、无水硫酸钠、甲苯和乙腈均为市售分析纯试剂,甲苯和乙腈经精馏脱水后使用.
Avance 400型核磁共振波谱仪(瑞士Bruker公司);Esquire-LC 00054型电喷雾电离质谱仪(瑞士Bruker公司);SHZ-B水浴恒温振荡器;Z-2000型原子吸收光谱仪(日本Hitachi公司).
1.2 合成方法
5,11,17,23-四叔丁基-25,26,27,28-四羟基杯[4]芳烃1按文献[8]的方法合成.
杯[4]芳烃衍生物2、3和4参照文献[9-10]的方法合成.在250mL单口圆底烧瓶中,分别加入5.mmol的杯[4]芳烃1,11.0mmol无水K2CO3和100mL无水乙腈,在N2保护下,搅拌30min,然后用针管慢慢加入50mmol的二卤代烷烃(1,2-二氯乙烷,1,2-二溴乙烷、1,4-二碘丁烷).用无水CaCl2封闭系统,油浴加热搅拌回流48h,直至杯[4]芳烃消失(TLC跟踪检测).抽滤,除去K2CO3等固体颗粒,减压蒸除大部分溶剂,得黄色油状液,向其中加入质量分数约为5%的稀盐酸和CHCl3.有机相用水洗至中性,无水Na2SO干燥8h后,旋蒸除溶剂,残留物加适量甲醇静置1~2h,析出白色固体,抽滤后再用氯仿/甲醇重结晶得白色晶体.分别制得杯[4]芳烃衍生物2、3和4,产率分别为:51.63%、57.42%、44.77%.GC/MS,含量分别为97.03%、83.87%、92.38%.
杯[4]芳烃衍生物1的IR、1H NMR与文献相一致.
杯[4]芳烃衍生物2:分子式C48H62Cl2O4;分子量773.923.1H NMR(CDCl3,δ):7.59(s,1H,Ar-OH)7.07~7.06,6.91~6.89(2d,4H,Ar-H),4.36~4.32(d,J=12.5Hz,4H,Ar-CH2-Ar),3.93~3.90(tJ=6.5Hz,2H,-O-CH2-CH2-Cl),3.42~3.39 (t,J=7.5Hz,2H,-O-CH2-CH2-Cl)1.32~1.01 (s 36H,-C(CH3)3).
杯[4]芳烃衍生物3:分子式 C48H62Br2O4;分子量862.811.1H NMR (CDCl3,δ):7.72(s,2H,Ar OH),7.05(s,4H,Ar-H),6.88(s,4H,Ar-H),4.26(d,J=13.0Hz,4H,Ar-CH2-Ar),4.10(t,4H,J=5.3Hz,-OCH2),4.02(t,4H,J=6.6Hz,-BrCH2),3.34(d,J=13.0Hz,4H,Ar-CH2-Ar),1.25(s 18H,-C(CH3)3),1.02(s,18H,-C(CH3)3).
杯[4]芳烃衍生物4:分子式 C52H70I2O4;分子量1 012.934.1H NMR(CDCl3,δ):7.45(s,1H,Ar OH),7.06(s,2H,Ar-H),6.81(s,2H,Ar-H),4.26~4.23(t,J=7.0Hz,2H,-OCH2),4.02~3.99(t,J=12.5Hz,2H,-CHI),3.34~3.33(d,J=6.5Hz,2H,OCHCHCH ),3.41~3.45(d,J=13.Hz,2H,-CH2-CH2-CH2-I),1.43~1.24(s,18H,-C(CH3)3),1.09~0.97(s,18H,-C(CH3)3).
1.3 萃取实验方法
采用一定浓度的杯[4]芳烃衍生物的氯仿溶液作为萃取剂,一定浓度的金属离子水溶液作为另一相,两相等体积混合,经快速振荡达萃取平衡后,用原子吸收光谱法测定水中剩余金属离子的浓度,从而计算出萃取率E.萃取体系采用工业上常用的萃取剂—硝酸体系,用硝酸和氨水调节水相的pH[11-12].式中c0和c1分别表示水相中萃取前后的金属离子浓度,在实验精度以内,为三次平行结果的平均值扣除空白后算得.

2 结果与讨论
2.1 实验条件的选择
选取杯[4]芳烃衍生物4为代表萃取剂,分别研究了振荡时间、温度、水相pH和萃取剂浓度对萃取率的影响,实验结果如图2~图5所示.

图2 振荡时间对金属离子萃取率的影响Fig.2 Effect of the time of oscillation on the extraction of metal ions

图3 温度对金属离子萃取率的影响Fig.3 Effect of the temperature on the extraction of metal ions

图4 水相pH对金属离子萃取率的影响Fig.4 Effect of the pH values of aqueous layer on the extraction of metal ions

图5 萃取剂浓度对金属离子萃取率的影响Fig.5 Effect of the extraction agent with different concentration on the extraction of metal ions
图2为振荡时间对萃取率的影响,萃取剂及水相金属离子浓度均选择为4×10-5mol·L-1,水相pH为6.85,等体积混合.室温下分别振荡0.5、1、1.5、2、2.5、3、3.5h,振荡停止后静置0.5h.取水相用原子吸收光谱法测剩余金属离子的浓度,计算萃取率.实验结果显示:萃取时间达到3h后,3种离子的萃取率基本不变,因此在之后萃取实验中,3种金属离子的萃取时间均选择为3.5h.
图3是萃取温度对3种金属离子萃取率的影响,萃取剂及水相金属离子浓度均选择为4×10-5mol·L-1,水相pH 为6.85,相比为1.分别在25、30、35、40、45、50℃的条件下振荡3.5h,振荡停止后静置0.5h取水相测剩余金属离子浓度,计算萃取率.发现3种金属离子具有相同的变化趋势,萃取率在25~30℃变化很小,35~50℃不断下降.这可能是因为随着温度的增加,水和CHCl3的互溶度增加,导致杯[4]芳烃衍生物与水中金属离子的配合能力下降.因此萃取温度选择为30℃.
图4是水相pH 对萃取率的影响,用硝酸-氨水将水相的pH 分别调节为:0.2、1.1、3.3、5.4和7.5,加入等体积的浓度为4×10-5mol·L-1的有机相,30℃下快速振荡3.5h后静置0.5h.取水相测剩余金属离子的浓度后发现:随着水相pH增大,Ag+的萃取率首先增加,在pH=5.8处达最大,然后减小;Cu2+的萃取率随pH值的增大单调增大,而Cr3+的萃取率则随pH升高持续减小.因此为达到最理想的萃取效果,之后的萃取实验中水相的pH 值 Ag+选择为5.8,Cu2+选择为7.5(纯水),Cr3+的选择为0.5.
图5是萃取率随萃取剂浓度的变化曲线,配制浓度分别为1×10-5、2×10-5、4×10-5、8×10-5、1×10-mol·L-1和2×10-4mol·L-1的杯[4]芳烃衍生物氯仿溶液,Ag+、Cu2+和Cr3溶液pH 值分别为5.8、7.5和0.5.30℃下快速振荡3.5h后静置0.5h.发现当c萃取剂/c金属离子<1时,萃取率随萃取剂浓度的增加而升高;当c萃取剂/c金属离子在1~5之间时,萃取率基本不增加,可以推断杯[4]芳烃衍生物与金属离子形成了近似1∶1的配合物.
2.2 杯[4]芳烃衍生物对 Ag+、Cu2+和Cr3+的萃取实验
配制浓度为4×10-5mol·L-1的杯[4]芳烃衍生物2、3和4的氯仿溶液,在萃取时间3.5h,萃取温度30℃,相比为1和c萃取剂/c金属离子=1的条件下,选择各金属离子的最佳pH溶液,对Ag+、Cu2+和Cr3+3种金属离子进行萃取实验,结果如表1所示.

表1 杯[4]芳烃衍生物2、3、4对 Ag+、Cu2+和Cr3+的萃取率Table 1 Extraction efficiency of the calix[4]arene derivative 2,3,4for Ag+ ,Cu2+and Cr3+
从表1可以看出:杯[4]芳烃衍生物对金属离子的萃取有一定的选择性,含Cl杯[4]芳烃衍生物2对Cr3+的萃取率最高,为86.06%,对3种金属离子的萃取率顺序为Cr3+>Cu2+>Ag+.含Br杯[4]芳烃衍生物3对Cu2+的萃取率最高,为80.71%,对3种金属离子的萃取率顺序为Cu2+>Cr3+>Ag+.含I杯[4]芳烃衍生物4对Ag+的萃取率最高,为90.16%,对3种金属离子的萃取率顺序为Ag+>Cr3+>Cu2+.
以上实验结果可以用软硬酸碱理论进行解释[13-16]:根据软硬酸碱理论,Ag+为软酸,对软碱I有较强的亲和力,因此能与含I的杯[4]芳烃衍生物4形成较稳定的配合物;Cr3+为硬酸,对硬碱Cl的亲和力较强,因此与含Cl基团的杯[4]芳烃衍生物2结合能力较强;而Cu2+属于交界酸,更易与含交界碱Br的杯[4]芳烃衍生物3形成较稳定的配合物.因此,金属离子萃取率的大小很大程度上取决于载体取代基团上配位原子与金属离子之间的配位能力.可能的配合物模型如右图所示.

注:X代表卤素原子,Y代表金属离子,m为金属离子电荷数,n为碳原子个数
3 结论
以杯[4]芳烃衍生物1为起始原料,制得杯[4]芳烃衍生物2和3以及目前未见报道过的杯[4]芳烃衍生物4.分别测试了杯[4]芳烃衍生物对水溶液中Cr3+、Cu2+和Ag+的萃取能力,最佳萃取率均可达80%以上.杯[4]芳烃衍生物对金属离子的萃取有一定的选择性,可用软硬酸碱理论进行解释.实验中杯[4]芳烃衍生物的产率有待于进一步提高,各种特性也有待于进一步的研究.
[1]GUTSCHE C D,DHAWAN B.The synthesis characterization and properties of the calixarenes fromp-tert-butylpheno[J].J Am Chem Soc,1981,103(2):3782-2792.
[2]GUTSCHE C D,MUTHUKRISHNAN R.Analysis of the product mixtures produced by the base-catalyzed condensation of formalde hyde with para-substituted phenols[J].J Org Chem,1978,43(2):4905-4907.
[3]孙小强,孟 启,阎海波.超分子化学导论[M].北京:中国石油出版社,2000.
[4]施宪法,汪宇平,刘艳生.杯芳烃的超分子化学研究(Ⅱ)—对叔丁基杯[n]芳烃对K+和Na+离子的液膜传输规律[J].高等学校化学学报,1999,20(2):193-195.
[5]MEMOM S,YILMAZ M.Liquid-liquid extraction of alkali and transiton metal cations by two biscalix[4]arene[J].Sep Sci Technol 2000,35(3):457-463.
[6]张春雷.含卤素端基的单取代对叔丁基杯[6]芳烃的合成与表征[J].有机化学,2006,26(3):310-315.
[7]李恩超.含氟杯[4]芳烃衍生物的合成和性能初探[D].同济大学,2007.
[8]周 杨.应用杯芳烃衍生物回收废水中重金属及稀贵金属离子的研究[D].南京理工大学,2004.
[9]CHOI M J,KIM M Y.Synthesis and Hg2+selective ionphoric properties ofp-tert-butylcalix[4]arene-aza-crown ethers[J].Che Lett,2000,20(3):1432-1437.
[10]刘小毛.可作为聚合单体的含硫杂杯[4]芳烃的合成[J].应用化学,2009,26(7):848-850.
[11]UYSAL G,MEMON S.Synthesis and binding properties of polymeric calyx[4]arene nitriles[J].React Funct Polym,2001,50(4)77-84.
[12]费德君.对叔丁基杯[4]芳烃乙酸萃取模拟制革废水中的Cr3+[J].应用化学,2008,25(2):157-160.
[13]赵 冰.杂环修饰的杯[4]芳烃衍生物的合成及离子萃取性能的研究[D].天津大学,2007.
[14]UDA T,JACOB T,HIRASAWA M.Technique for enhanced rare earth separation[J].Science,2000,29(8):2326-2329.
[15]李 莉.对叔丁基杯[4]芳烃对Cr(Ⅲ)和Cr(Ⅵ)的分离富集[J].西南科技大学学报,2006,21(2):79-83.
[16]刘小毛.杯[4]芳烃衍生物的合成及其萃取银、铅金属离子的性能研究[D].东华大学,2009.
Synthesis of halocalix[4]arene derivatives and their extraction performance for metal ions
YANG Hua-cheng,XIAN Chun-ying*
(College of Chemistry,Chemical Engineering and Bio-technology,Donghua University,Shanghai201600,China)
Several calix[4]arene derivatives(denoted as 1,2,3,and 4)were synthesized fromp-tert-butylphenol through a series of reactions by which halogen atoms were introduced onto the bottom edge of the target products.The structure of the target products were confirmed by nuclear magnetic resonance spectroscopy and gas chromatograph-mass spectrometry.Moreover,their extraction capacity for Cr3+,Cu2+and Ag+in water was evaluated.It has been found that as-synthesized calix[4]arenes 2,3 and 4 show excellent extraction performance towards Cr3+,Cu2+and Ag+,respectively.
halogen;calix[4]arene;derivative;synthesis;metal ion;extraction performance
O 641.3
A
1008-1011(2012)03-0064-04
2011-11-25.
杨华成(1985-),男,硕士,研究方向:杯芳烃衍生物的合成与应用.*
,E-mail:xiancy@dhu.edu.cn.

