HPV16 E6和E7对乳腺癌细胞侵袭能力的影响及其机制*
李 娜,冶亚平,朱会芳,韩芳毅,千新来
(新乡医学院病理学教研室,河南新乡 453003)
乳头瘤病毒(human papillomaviruses,HPVs)是一组小分子双链DNA病毒,研究证实高危型人乳头瘤病毒(high risk-HPVs,hr-HPVs)特别是HPV16型与宫颈癌的发生、发展存在着密切关系,其与肺癌和乳腺癌等恶性肿瘤的发生与演进的关系也受到广泛关注[1-2]。本研究以人低转移乳腺癌细胞MCF-7为研究对象,通过脂质体将HPV16 E6、E7和同时表达E6/E7的重组质粒转入MCF-7细胞,探讨HPV16 E6、E7和E6/E7同时稳定表达对HPV16阴性的乳腺癌细胞侵袭能力的影响及其机制。
1 材料与方法
1.1材料 (1)质粒与细胞株:pcDNA3.1-E6、pcDNA3.1-E7和pcDNA3.1-E6/E7真核表达质粒由本实验室构建并保存。人低转移乳腺癌细胞系MCF-7购于中科院上海细胞库。(2)主要试剂:SuperScriptTMFirst-Strand Synthesis System for RT-PCR 试剂盒、lipofectamineTM2000均为Invitrogen公司产品。羊抗HPV16 E6多克隆抗体(IgG)、鼠抗HPV16 E7单克隆抗体(IgG)为美国Santa Cruz公司产品。引物由上海生物工程公司合成。
1.2方法
1.2.1细胞培养与基因转染 细胞在含有10%胎牛血清(FBS)、100 U/mL青霉素和100 μg/mL链霉素的完全培养基中37 ℃、5%CO2条件下培养,待细胞长至70%融合时,按lipofectamineTM2000说明书进行转染,转染9 h后,更换新鲜完全培养基,培养48 h,设置MCF-7-vect转染组、MCF-7亲本细胞组、转基因组(MCF-7-E6细胞组,MCF-7-E7细胞组,MCF-7-E6/E7细胞组)。用G418(800 μg/mL)筛选阳性克隆。每种转染细胞分别挑取4个单克隆培养扩增,获得稳定转染细胞。
1.2.2Western blot检测蛋白表达 按照试剂盒说明书提取细胞质、细胞核蛋白,蛋白上清经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)(5%浓缩胶,12%分离胶)后转移至硝酸纤维素膜,TBST封闭,一抗室温摇育,TBST洗涤;二抗于室温摇育,TBST洗涤,膜与化学发光底物孵育3~5 min,经X线片曝光、显影、定影。显色结果用软件Bandscan5.0进行灰度分析,并计算蛋白的相对表达水平。
表1 不同细胞克隆中HPV16 E6、E7蛋白的表达
1.2.3Transwell侵袭实验和迁移实验 加含10%FBS的完全培养基于24孔板(600 μL/孔),小心取出小室放入24孔板中,膜上铺人工基底膜Matrigal胶,静置5 min。取单细胞悬液400 μL接种入小室,常规培养18 h。取出小室,结晶紫染色。通过倒置显微镜下计数6个视野穿膜细胞数,每组设3个平行样本,共重复3次计算平均值。迁移实验小室内不铺设基质胶,余同侵袭实验。
1.2.4RT-PCR法检测基质金属蛋白酶-2(matrixmetallo proteinases-2,MMP-2) mRNA的表达 MMP-2上游引物序列:5′-TTC AAG GAC CGG TTC ATT TGG CGG ACT GTG-3′,下游引物序列:5′-TTC CAA ACT TCA CGC TCT TCA GAC TTT GGT T-3′,目的片段长度为493 bp。PCR反应条件:94 ℃×2 min、94 ℃×1 min、58 ℃×1 min和72 ℃延伸1 min,共30个循环;72 ℃延伸10 min。取5 μL用1.5%琼脂糖凝胶电泳,在凝胶成像仪上成像及测定分析,实验重复3次计算平均值。

2 结 果
2.1不同细胞克隆中HPV16 E6和E7蛋白的表达 MCF-7-vect和MCF-7亲本细胞中HPV16 E6和E7蛋白表达均为阴性。MCF-7-E6的 1号克隆、MCF-7-E7的4号克隆和MCF-7-E6/E7的4号克隆分别稳定高表达HPV16 E6、E7和同时稳定高表达E6/E7,见表1。
2.2HPV16 E6和E7稳定高表达对MCF-7细胞侵袭能力的影响 与MCF-7亲本、MCF-7-vect和MCF-7-E7细胞比较,MCF-7-E6和MCF-7-E6/E7细胞穿膜细胞数显著增加(P<0.05),见表2,图1。

表2 Transwell迁移和侵袭实验结果
2.3HPV16 E6和E7稳定高表达对MCF-7细胞MMP-2 mRNA表达的影响 RT-PCR结果显示:在MCF-7-vect和MCF-7亲本细胞中MMP-2 mRNA表达阴性,而在3种重组细胞中均有表达。半定量分析结果显示,MMP-2 mRNA的相对表达量在MCF-7-E6、MCF-7-E7和MCF-7-E6/E7细胞组中分别为0.760±3.784、0.742±7.022和0.838±2.770,组间比较差异无统计学意义(P>0.05),见图2。
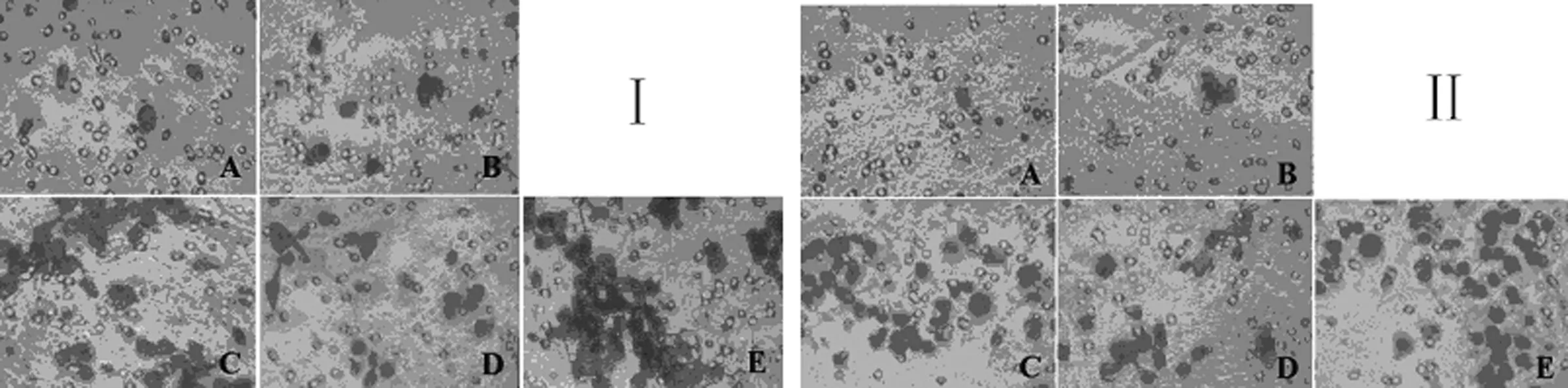
A:MCF-7亲本细胞;B:MCF-7-vect细胞;C:MCF-7-E6细胞;D:MCF-7-E7细胞;E:MCF-7-E6/E7细胞

M:1 000 bp 标记物;1:MCF-7-E6细胞;2:MCF-7-E7 细胞;3:MCF-7-E6/E7 细胞;4:MCF-7-vect细胞;5:MCF-7 亲本细胞
3 讨 论
乳腺癌是女性最常见的恶性肿瘤之一,据资料统计,发病率占全部恶性肿瘤的7%~10%。尽管目前对肿瘤的手术、化疗和放疗三位一体的综合治疗已取得了很大的进步,但仍约有50%的乳腺癌患者在治疗后5年内出现复发转移而导致治疗失败[1]。因此,阐明乳腺癌侵袭转移的机制以及寻找相应的干预措施,已成为提高患者5年生存率所面临的最大挑战。
有研究显示大约50%的乳腺癌患者伴有hr-HPVs的感染[2]。hr-HPVs感染在肺癌、食管癌、乳腺癌等恶性肿瘤发生和演进中的作用也日益受到重视[3-6]。hr-HPVs特别是HPV16型与宫颈癌的发生、发展存在着密切的病因学关系[7-9],其与头颈部恶性肿瘤、肺癌和乳腺癌等恶性肿瘤的发生与演进的关系也受到广泛关注。将HPV16 E6和E7基因转染入无转移能力的鼠源性永生化细胞后,可赋予该细胞侵袭转移的能力。这些结果均提示hr-HPVs与肿瘤的侵袭转移可能存在着密切的关系。但是关于HPV16 E6和E7在促肿瘤细胞侵袭和转移过程中的作用及其机制等问题仍不清楚。
人乳腺癌细胞系MCF-7是目前公认的具有低转移特性的细胞系,并且已证实该细胞系HPV16阴性。因此,本研究以该细胞系为研究对象,建立了稳定高表达HPV16 E6、E7和同时表达E6/E7的乳腺癌细胞株,并通过Transwell实验进一步探讨了HPV16 E6、E7和E6/E7对乳腺癌细胞侵袭能力的影响。通过RT-PCR方法探讨HPV16 E6和E7对转移相关基因MMP-2表达的影响。结果显示:与MCF-7亲本细胞和MCF-7-vect细胞比较,MCF-7-E6、MCF-7-E7和MCF-7-E6/E7细胞穿过基膜的细胞数目明显增多,并且MMP-2 mRNA表达明显增加。表明HPV16 E6和E7可能通过诱导MMP-2的表达而促进了MCF-7细胞的侵袭能力。有研究亦证实了HPV16 E6/E7可增强细胞的侵袭和转移能力[1,10]。
另外,MCF-7-E6细胞、MCF-7-E7细胞和MCF-7-E6/E7细胞中,以MCF-7-E6细胞和MCF-7-E6/E7侵袭能力增强最为显著,表明HPV16 E6可能在促进肿瘤细胞侵袭和转移过程中发挥着更为重要的作用。其机制除促进MMP-2的表达之外还可能为:HPV16等hr-HPVs的E6蛋白可通过其C-端PDZ基序与调控细胞连接形成和细胞黏附等相关的PDZ蛋白相互作用,并诱导它们降解,从而引起肿瘤细胞间黏附性降低、失去接触性抑制并有利于癌细胞侵袭和转移[11-15]。
综上所述,本研究初步证实了HPV16 E6和E7稳定高表达可以诱导MMP-2的表达,并促进MCF-7细胞的侵袭能力。从而为设计新的、以HPV16 E6和E7为靶点的治疗乳腺癌等HPVs相关肿瘤侵袭和转移的方案提供重要的科学依据。
[1]Karin H,Jessica M,Frank F,et al.HPV16 E7 oncogene expression in normal human epithelial cells causes molecular changes indicative of an epithelial to mesenchymal transition[J].Virology,2009,391(1):57-63.
[2]Spangle JM,Karl M.The human papillomavirus type 16 E6 oncoprotein activates mTORC1 signaling and increases protein synthesis[J].J Virol,2010,84(18):9398-9407.
[3]Yuri A,Koch WM,Xiao WH,et al.Oral HPV infection before and after treatment for HPV16-positive and negative head and neck squamous cell carcinoma[J].Clin Cancer Res,2008,14(21):7143-7150.
[4]William L,Schlecht NF,Margaret BG.The role of the human papillomavirus in the pathogenesis of schneiderian inverted papillomas:an analytic overview of the evidence[J].Head Neck Pathol,2008,2(2):49-59.
[5]郑秀惠,李力,郭建新.HPV16 E6E7与C3d3融合基因真核表达质粒的构建及表达[J].重庆医学,2010,39(1):40-42.
[6]Zhou Y,Pan Y,Zhang S,Increased phosphorylation of p70 S6 kinase is associated with HPV16 infection in cervical cancer and esophageal cancer[J].Br J Cancer,2007,97(2):218-222.
[7]Dreier K,Scheiden R,Lener B,et al.Subcellular localization of the human papillomavirus 16 E7 oncoprotein in CaSki cells and its detection in cervical adenocarcinoma and adenocarcinoma in situ[J].Virology,2011,409(1):54-68.
[8]徐晓英,汤春辉,薛晓玲.高危型HPV、p16、COX-2在宫颈癌中的表达及临床意义[J].重庆医学,2011,40(12):1199-1204.
[9]Maёlle S,Sylvain MB,Frédéric M,et al.Analysis of human papillomavirus type 16(HPV16) DNA load and physical state for identification of HPV16-infected women with high-grade lesions or cervical carcinoma[J].J Clin Microbio,2008,46(11):3678-3685.
[10]Akil N,Yasmeen A,Kassab A,et al.High-risk human papillomavirus infections in breast cancer in Syrian women and their association with Id-1 expression:a tissue microarray study[J].Br J Cancer,2008,99(3):404-407.
[11]Storrs CH,Silverstein SJ.PATJ,a tight junction-associated PDZ protein is a novel degradation target of high-risk HPV E6 and the alternatively spliced isoform 18 E6[J].J Virol,2007,81(8):4080-4090.
[12]An,JB,Mo DQ,Liu HR,et al.Inactivation of the CYLD Deubiquitinase by HPV E6 Mediates Hypoxia-Induced NF-κB Activation[J].Cancer Cell,2008,14(5):394-407.
[13]Howie HL,Katzenellenbogen RA,Galloway DA.Papillomavirus E6 proteins[J].Virology,2009,384(2):324-334.
[14]Tungteakkhun SS,Duerksen-Hughes P.Cellular binding partners of the human papillomavirus E6 protein[J].Arch Virol,2008,153(3):397-408.
[15]Jason B,Laimins LA.Persistence of human papillomavirus infections:keys to malignant progression[J].Trends Microbiol,2011,19(1):33-39.

