脂多糖诱导小胶质细胞依赖的早产鼠脑白质损伤机制研究
王来栓 张金萍 吴冰冰 蒋思远 张 蓉 夏 庆
大量临床和实验研究表明宫内感染或炎症反应不仅是导致早产的原因,同时也是导致新生儿死亡和严重伤残的重要原因[1,2]。由于少突胶质细胞(OL)是早产儿脑室周围白质软化(PVL)发生的靶细胞和导致脑瘫发生的直接原因,对其发育、分布、增殖、分化和受损特点已有了较清楚的认识。 OL具有成熟度依赖“选择性”易损的特点:PVL发病“窗口期(孕23~32周)”的OL高度易损,而发育早期OL和成熟OL却不易受损[3],并且发现OL自身抗氧化能力不足是造成对促炎细胞因子、氧自由基和兴奋性氨基酸等易损性的内在机制。促炎细胞因子和氧自由基主要由活化的小胶质细胞(MG)释放,而对MG的正常分化发育和活化后与少突胶质细胞前体细胞(OPCs)在PVL中的作用研究还非常有限。本研究假设MG的发育分布与OL细胞平行是早产儿脑白质损伤的关键所在。为此,通过分析不同孕龄C57B/L胎鼠MG、OL和神经元发育相关性,并通过脂多糖(LPS)宫内感染模型证实上述假设。
1 方法
1.1 实验动物 C57B/L孕小鼠购自中国科学院上海实验动物中心,SPF环境下饲养,雌雄鼠按2∶1配对,各分为8笼交配繁殖。
1.2 MG发育分析 取C57B/L胎龄10、15 d孕鼠,出生后0、5、10 d 新生鼠各6只,予水合氯醛350 mg·kg-1腹腔注射麻醉后沿升主动脉依次灌入生理盐水和4%多聚甲醛(pH 7.4),取出脑组织后固定于4%多聚甲醛中过夜,依次置于20%、30%蔗糖溶液中至组织块下沉。脑组织块在-20℃的恒冷切片机上行30 μm的连续冠状切片。Tomato lectin作为静止期MG的特殊抗体进行染色,O4+作为OPCs抗体以浮片法进行免疫组化染色。参照脑立体定位图谱选取4个胼胝体平面进行阳性细胞计数,油镜计数脑室旁白质4个不同平面阳性细胞数(每一切片为5 000 μm2),得出平均阳性细胞的密度。
1.3 LPS宫内感染模型制备 无菌LPS O111:B4干粉溶解于PBS液中,使其终浓度为1 g·L-1。取胎龄15 d的孕鼠,2%戊巴比妥钠(40 mg·kg-1) 腹腔注射麻醉后消毒腹部皮肤,下腹行1 cm左右正中切口,找到左、右子宫角。以1 号皮试注射器注入不同剂量LPS于2个胎囊间。接种后310 号丝线连续缝合腹膜关闭腹腔,间断缝合皮肤。术后置于清洁笼内,常规喂养。
依据LPS注射剂量(5、10和20 μg·mL-1)分为感染A~C组,对照组为接种等量PBS液,每组各8只。各组待自然分娩后72 h按1.2项下的标本处理方法制作冠状病理切片,分别行CD68(活化MG的特殊抗体)、O4+免疫组化染色和分析。
1.4 促炎细胞因子检测 各组切割脑室周围白质组织标本后,称取重量,液氮迅速冷冻保存备用。标本融化后保持2~8℃。加入一定量的PBS(pH 7.4),用匀浆器将标本匀浆充分。离心20 min(2 000~3 000 r·min-1)。采用抗体夹心法快速检测IL-2、TNF-α和SOD含量,分析各细胞因子变化趋势与脑损伤关系。
1.5 Western blot检测TLR-4蛋白表达 各组脑室周围白质组织用总蛋白抽提试剂抽提总蛋白并进行蛋白质定量。根据蛋白定量上样,变性聚丙烯酰胺不连续凝胶电泳(SDS-PAGE)分离,并以湿法将蛋白质转移到PVDF膜,膜在5%脱脂奶粉溶液中室温孵育1 h以封闭膜上的非特异结合。用大鼠抗小鼠TLR4抗体(1∶1 000) 4℃ 孵育过夜。洗去一抗,再与辣根过氧化物酶(HRP)标记的山羊抗大鼠IgG(1∶5 000)反应,增强化学发光法显色,X线底片曝光显影。结果用图像处理仪进行灰度扫描分析,并以稳定表达的基因β-actin作为内参照计算目标条带与β-actin的比值(%)。
2 结果
2.1 MG的增长移行和分布特征 Tomato lectin阳性MG和O4+细胞在孕10 d表达开始增加,但之后呈现胎龄依赖的表达显著增加(孕15 d、出生后0 d表达最高),MG主要分布在脑室周围白质区域,灰质皮质几乎不表达。生后脑室周围白质区域的MG和O4+细胞表达逐渐降低,灰质皮质的表达呈逐渐增高趋势(表1,图1)。

图1 MG的增长移行和分布
Fig 1 Distribution of activated microglia using Tomato lectin
Notes A: Numerous activated microglia in the white matter of a 15 gestational days mouse fetus; B: Negligible Tomato lectin-immunopositive cells in the cortex of the same mouse fetus; C: No Tomato lectin-immunopositive cells in the white matter of a 10 days postnatal mouse
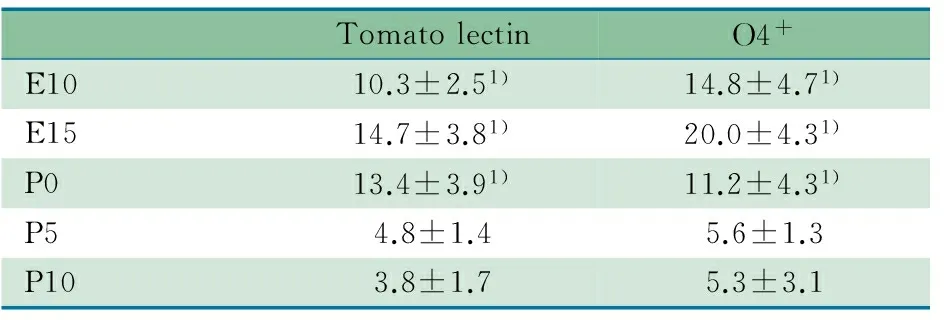
TomatolectinO4+E1010.3±2.51)14.8±4.71)E1514.7±3.81)20.0±4.31)P013.4±3.91)11.2±4.31)P54.8±1.45.6±1.3P103.8±1.75.3±3.1
Notes E10:10 gestational days; E15:15 gestational days; P0: 0 day after birth; P5: 5 days after birth; P10: 10 days after birth.1) compared with P5 and P10,P<0.05
2.2 LPS宫内感染对脑室周围白质组织MG和OPCs影响 随接种LPS剂量的增加,CD68+细胞数量较对照组呈显著的增加趋势,但感染C组和B组差异无统计学意义;感染A~C组O4+细胞较对照组呈显著下降趋势,感染C组下降最为显著(表2)。
2.3 LPS宫内感染对脑室周围白质组织IL-2、TNF-α和SOD的影响 随接种LPS剂量增加,IL-2和TNF-α水平较对照组呈显著增加趋势,但感染B和C组间差异无统计学意义。SOD水平呈显著降低趋势,感染B和C组均显著低于对照组(表2)。
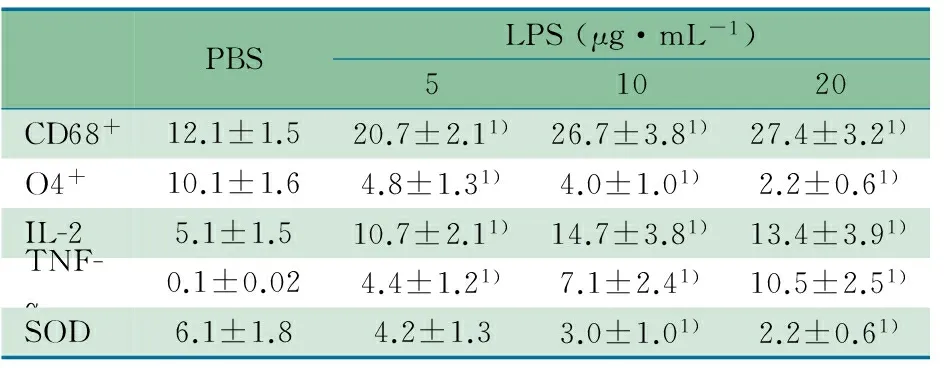
PBSLPS(μg·mL-1)51020CD68+12.1±1.520.7±2.11)26.7±3.81)27.4±3.21)O4+10.1±1.64.8±1.31)4.0±1.01)2.2±0.61)IL-25.1±1.510.7±2.11)14.7±3.81)13.4±3.91)TNF-α0.1±0.024.4±1.21)7.1±2.41)10.5±2.51)SOD6.1±1.84.2±1.33.0±1.01)2.2±0.61)
Notes 1) compared with PBS group,P<0.01. CD68+and O4+were described as number·mm-2; IL-2,TNF-α and SOD were described as ng·mL-1
2.4 LPS宫内感染对TLR-4蛋白表达的影响 对照组未检测到TLR-4蛋白,感染A组可检测到明显的TLR-4蛋白,随接种LPS剂量增大,感染B和C组TLR-4蛋白表达较对照组呈显著增高趋势(P<0.05)。

图2 不同剂量LPS诱导宫内感染3日龄新生鼠脑室周围白质组织MG TLR-4蛋白表达比较
Fig 2 TLR-4 protein expression of periventricular microglia following different doses of LPS induced intrauterine infection
Notes 1) compared with PBS group,P<0.01
3 讨论
研究表明,早产儿的预后很大程度上取决于脑的发育程度和损伤程度。早产儿脑损伤是发育过程中的脑损害,主要发生在脑白质。流行病学资料显示PVL是痉挛性脑瘫的主要原因,而围生期感染是早产和PVL发生的重要因素。Meta分析结果证实母亲患绒毛膜羊膜炎是发生PVL和脑瘫的独立危险因素[4,5]。既往研究更多的是关注PVL受损的靶细胞OPCs,而对于PVL形成的始动上游机制和为何是以白质受损为主等问题尚缺乏足够的了解和重视。
本研究对C57B/L鼠正常MG的发育特点进行了研究。通过常规和免疫组化染色相结合的方法,发现脑内固有免疫细胞MG发育也存在脑发育成熟度依赖的特点。孕10 d低表达MG,随着胎龄的增加,MG在脑白质的表达逐渐增多,呈现出从深部白质到灰质皮质梯度分布的特征,而足月出生后脑白质的MG逐渐减少并迁移到灰质皮质,脑白质MG高峰期的表达出现在孕10、15 d,与OPCs发生的易损期高度一致。这种发育上的一致性在于分泌更多的神经营养因子,从而最大程度的保护易损期OPCs和促进其分化成熟作用,但活化MG介导的抗感染和免疫损伤作用并存加上OPC内在的易损性,对于平行发育的OPCs而言,MG在PVL发病中起到始动作用。本研究结果与最近报道的人MG发育特点一致,进一步表明MG活化在 PVL发病中的关键作用[6],也提示研究MG的激活机制,从而调控MG的活化程度可能成为治疗PVL的新靶点[7]。
作为中枢神经系统固有的免疫细胞,宫内感染时,MG活化并介导固有免疫,发挥吞噬细胞功能。本研究结果显示接种LPS后,呈现LPS剂量依赖的CD68+MG细胞数量的显著增加和O4+OPCs细胞数量显著减少,提示MG由OPCs正常发育时的保护作用变成了受损时的“加速器”,表明MG是OPCs受损的物质基础,进一步验证了MG的作用。
固有免疫系统主要是通过一系列基因保守且稳定的细胞表面受体,即模式识别受体,识别病原体不同的分子结构,即病原体相关分子模式。这类受体命名为TLR ,其中LPS与TLR-4特异性结合是MG介导固有免疫的必要条件。早产儿PVL动物实验表明,MG是中枢神经系统内唯一高表达TLR-4和特异结合荧光标记LPS的细胞群,体外实验证实LPS不能直接导致靶细胞OPCs损伤,必需有MG的活化和TLR-4的表达,活化的MG分泌促炎细胞因子和趋化因子等并转化为吞噬细胞,发挥非特异的免疫反应,以有效清除病原微生物[8]。TLR-4基因缺失小鼠对LPS的反应性和炎症反应的程度显著降低[9],提示TLR4在固有免疫中的重要作用。本研究结果显示,接种LPS后,TLR-4蛋白表达增加,并呈现剂量依赖性,与文献报道较为一致。
氧自由基在PVL 的发病中起着重要的作用,其还可以与炎症因子和兴奋性氨基酸等的相互作用,从而增强彼此的致病性。本研究也发现随着炎症反应的加重,IL-2、TNF-α等炎症因子水平显著增高,SOD这一重要的氧自由基清除剂水平显著下降。
总之,MG的发育和增殖阶段与OL一致,是OL受损的物质基础,OL受损是宫内感染后MG的活化和增殖的必然结果。活化的MG的表达高峰与PVL发病的高峰期吻合,导致靶细胞OL的受损。抗感染免疫对宿主的保护和损伤作用平行的基础是MG和OPCs的平行发育。
[1]Goldenberg RL,Culhane JF,Iams JD,et al. Epidemiology and causes of preterm birth. Lancet,2008,371(9606):75-84
[2]Saigal S,Doyle LW. An overview of mortality and sequelae of preterm birth from infancy to adulthood. Lancet,2008,371(9608):261-269
[3]Volpe JJ,Kinney HC,Jensen FE,et al. The developing oligodendrocyte: key cellular target in brain injury in the premature infant. Int J Dev Neurosci,2011,29(4):423-440
[4]Dammann O,Levton A. Maternal intrauterine infection,cytokines and brain damage in the preterm newborn. Pediatr Res,1997,42(1):1-8
[5]Wu YW,Colford JM Jr. Chorioamnionitis as a risk factor for cerebral palsy: a meta-analysis. JAMA,2000,284(11):1417-1424
[6]Billiards SS,Haynes RL,Folkerth RD,et al. Development of microglia in the cerebral white matter of the human fetus and infant. J Comp Neurol,2006,497(2):199-208
[7]Hedayat M,Netea MG,Rezaei N. Targeting of Toll-like receptors: a decade of progress in combating infectious diseases. Lancet Infect Dis,2011,11(9):702-712
[8]Poltorak A,He X,Smirnova I,et al. Defective LPS signaling in C3H/HeJ and C57BL/10ScCr mice: mutations in Tlr4 gene. Science,1998,282(5396):2085-2088
[9]Lehnardt S,Lachance C,Patrizi S,et al. The toll-like receptor TLR4 is necessary for lipopolysaccharide-induced oligodendro-cyte injury in the CNS. J Neurosci,2002,22(7):2478-2486

