DNA总体低甲基化、错配修复基因启动子甲基化异常与神经管畸形的相关性
陈晓丽 郭 金 邹继珍 卢晓琳 包怡华 吴丽华 牛 勃
神经管畸形(neural tube defects,NTDs)在世界范围内的发病率约为1‰[2,3]。中国NTDs发病率高达27.4‰,每年有8~10万例NTDs患儿出生,占先天畸形的20%~25%[4]。本课题组前期研究发现NTDs在山西省的发病率高达199.38‰[5]。
NTDs为多因素复杂疾病,是遗传和环境因素共同作用的结果[6~9]。既往研究发现母体营养代谢的异常,特别是母体叶酸缺乏为NTDs的主要危险因素[10,11],而孕期补充叶酸可以减少50%~70%的NTDs发生[12~14]。叶酸在体内的主要功能是参与DNA合成及提供甲基供体。在孕期给予低叶酸饮食喂养的大鼠,其子代出现DNA总体低甲基化[15],而给叶酸缺乏的大鼠补充叶酸可以逆转DNA总体甲基化水平的降低[16]。基因组DNA总体甲基化水平影响基因组稳定性,而特定基因启动子区的甲基化水平影响该基因转录[17]。基因组不稳定引发染色体重组性疾病以及肿瘤发生[18~20],因特定基因组或特定基因的异常甲基化引起的出生缺陷有Rett综合征、Prader-Willi/Angelman综合征以及Beckwith-Wiedemann综合征[21]。
DNA修复通路在控制基因突变和维持基因组稳定等方面具有重要作用,与一些神经系统遗传病发生有关[22,23]。错配修复基因(mismatch repair gene,MMR)是细胞内负责对碱基错配进行修复的基因,现有研究提示DNA修复通路基因可能在神经管早期发育中发挥作用,如BRCA1基因敲除的小鼠出现脊柱裂和无脑儿表型[24],NTDs患儿脑组织中MMR蛋白表达水平显著下降[25]。
本课题组前期研究结果已经验证母体血清低叶酸水平是NTDs的危险因素[26]。基于此,本研究以医院为基础进行病例-对照研究,通过比较NTDs组与对照组DNA总体甲基化和7个MMR启动子区的甲基化水平,了解NTDs胎儿是否存在DNA甲基化修饰改变,为母体叶酸相对不足导致NTDs胎儿出现DNA甲基化修饰异常的假设寻找依据。
1 方法
1.1 研究对象 所有标本均来源于山西省吕梁地区县级医院及妇幼保健院引产的胎儿,由首都儿科研究所病理科医生完成解剖诊断。NTDs组:B超诊断为NTDs而进行引产的胚胎,经解剖证实有1种或多种形式的NTDs畸形;对照组:同期非病理性引产的胚胎,经解剖证实不存在任何先天畸形和胎儿发育迟缓。两组引产胚胎分别取脑组织和皮肤组织各25 mg,迅速液氮冻存。Array-CGH芯片检测排除大片段微染色体异常(>1 Mb)。以孕周和孕妇年龄对两组进行匹配。
1.2 伦理和知情同意 该研究经首都儿科研究所伦理委员会批准,入组胚胎标本均经家属的知情同意用于研究。
1.3 甲基化水平检测 采用Qiagen组织/血样DNA提取试剂盒(DNeasy Blood & Tissue kit)提取脑组织和皮肤组织的DNA,A260计算DNA浓度。用DNA甲基化检测试剂盒(Epigentek,Farmingdale,NY)完成DNA总体甲基化检测。
采用MS-MLPA试剂盒(ME011-A1,MRC-Holland,Amsterdam,荷兰)对脑组织MMR启动子区的甲基化水平进行分析,共包括7个MMR(MLH1,MSH2,MSH6,MSH3,MLH3,PMS2和MGMT)。每个基因检测3~4个HhaⅠ酶切位点,共24个目的位点(3个PMS2探针,6个MLH1探针,4个MSH2探针,3个MSH3探针,3个MSH6探针,3个MGMT探针,2个MLH3探针),同时有8个内参位点(内参位点内没有HhaⅠ酶切位点)。每个标本分成两管,一管进行HhaⅠ酶切消化(HhaⅠ+),一管不进行HhaⅠ酶切消化(HhaⅠ-),利用ABI3730(诺赛基因有限公司,北京)对PCR进行峰值测定,然后用Genemarker 1.95软件(SoftGenetics,State College,PA)对基因甲基化数据进行图像采集和甲基化分析。如待测DNA的GCGC位点未甲基化,则探针DNA复合物被HhaⅠ酶切开,致使PCR片段扩增失败,反之则可扩增出PCR片段。以(消化后目的位点峰值/消化前目的位点峰值)/(消化后内参位点峰值/消化前内参位点峰值) 计算每个样本的甲基化水平。
2 结果
2.1 一般情况 2006年4月至 2007年12月共收集到符合匹配条件的65例NTDs胚胎和48例正常对照胚胎。两组孕妇的年龄和孕周分布见表1,其构成比无显著差异。
2.2 脑组织和皮肤组织的DNA总体甲基化水平 首先两组脑组织和皮肤组织的DNA总体甲基化水平数据进行正态性检验,数据呈正态分布。由图1可见,DNA总体甲基化在脑组织和皮肤组织显示为不同的分布。皮肤组织的DNA总体甲基化水平显著高于脑组织。进一步比较NTDs组和对照组DNA甲基化水平,发现两组脑组织DNA总体甲基化水平存在显著差异,NTDs组显著低于对照组(5.3%vs6.5%,P<0.001),而两组皮肤组织DNA总体甲基化水平差异无统计学意义(13.3%vs13.1%,P>0.05)。
表1 NTDs组和对照组的一般情况
Tab 1 Basic information of NTD-affected cases and controls
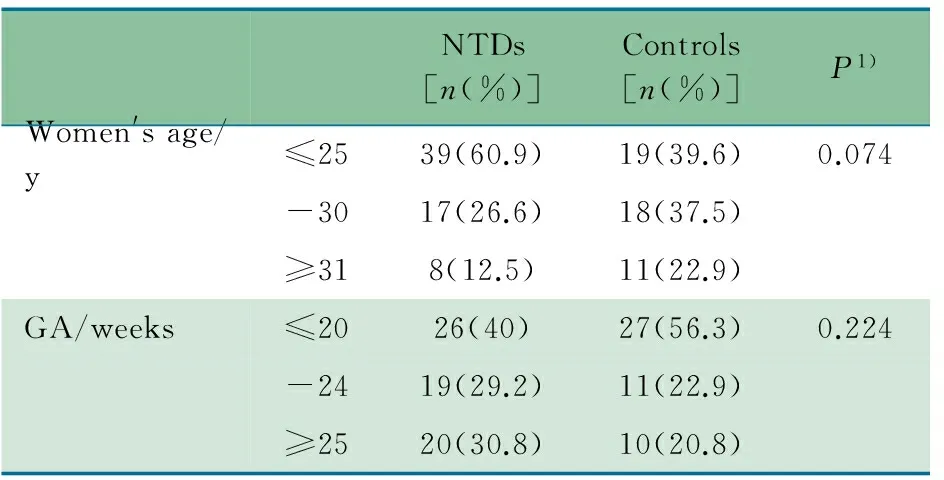
NTDs[n(%)]Controls[n(%)]P1)Women'sage/y≤2539(60.9)19(39.6)0.074-3017(26.6)18(37.5)≥318(12.5)11(22.9)GA/weeks≤2026(40)27(56.3)0.224-2419(29.2)11(22.9)≥2520(30.8)10(20.8)
Notes 1)Pvalue fromχ2test; y: year; GA: gestational age
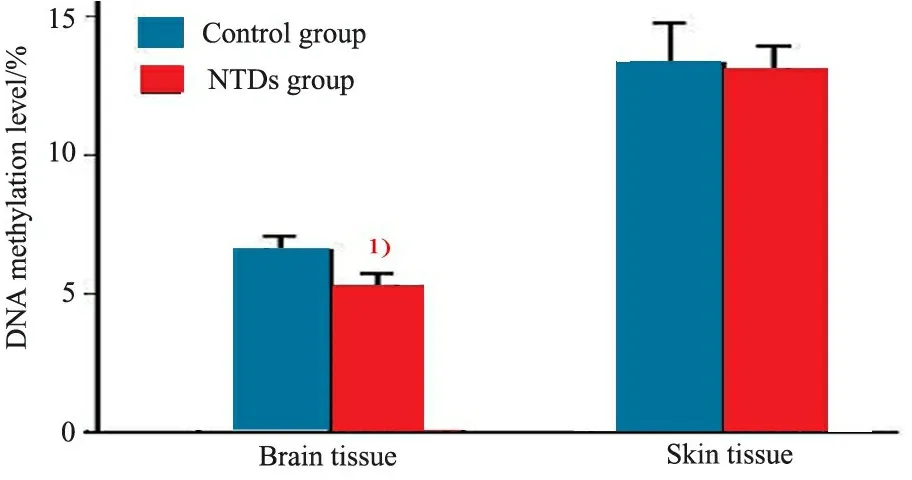
图1 脑组织及皮肤组织DNA总体甲基化水平在NTDs组和对照组的比较
Fig 1 Comparison of global DNA methylation levels of brain and skin tissue in NTD-affected cases and controls
Notes 1) Global DNA methylation levels of brain in NTD-affected cases were lower than those in controls,P<0.001
Logistical 回归分析结果显示,脑组织DNA总体低甲基化水平(<对照组P25)使NTDs发生的危险提高4.98倍(表2)。
表2 DNA总体甲基化水平与NTDs发生危险度的Logistic回归结果
Tab 2 Logistic regression of global DNA methylation and formation of NTDs
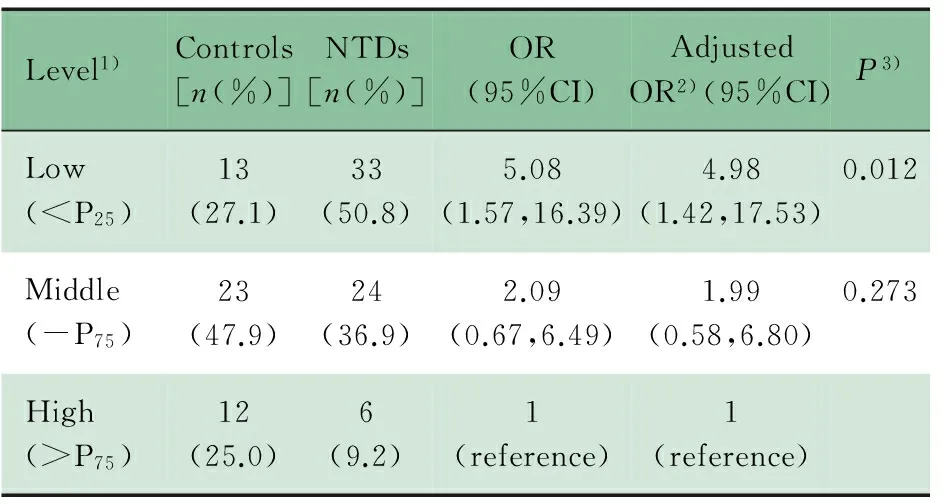
Level1)Controls[n(%)]NTDs[n(%)]OR(95%CI)AdjustedOR2)(95%CI)P3)Low(
Notes GA: gestational age. 1) Global DNA methylation levels in cases were categorized into three subgroups according to the percentiles of controls; 2)Model was adjusted for women′s age and gestational week. 3)Pvalue fromχ2test
2.3 MMR启动子区的甲基化水平 NTDs组和对照组各38例胚胎脑组织进行了MMR启动子区甲基化水平检测,MS-MPLA结果如图2所示。
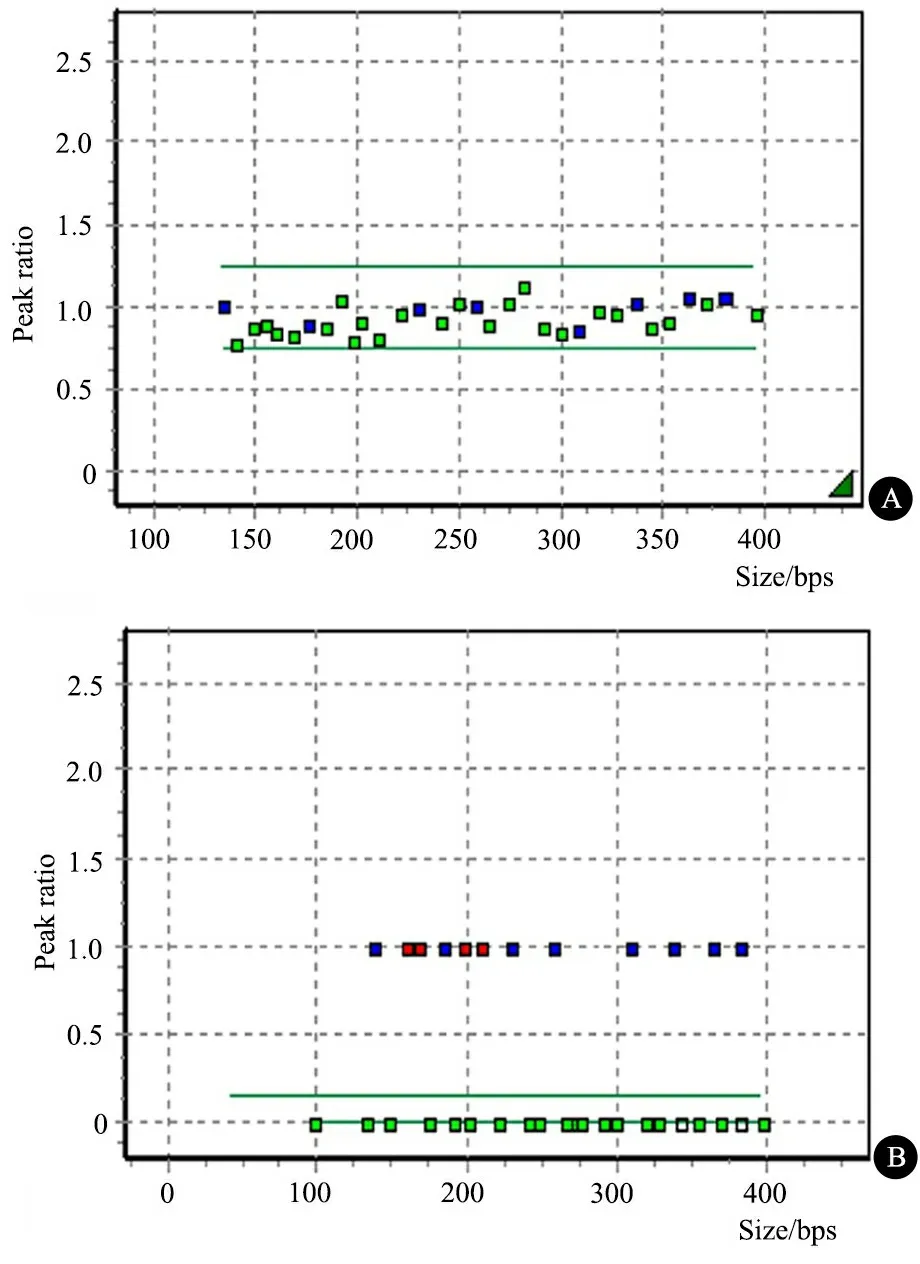
图2 待测样本消化前后MS-MLPA结果
Fig 2 The MS-MLPA results for test sample before(A) and after(B) HhaⅠdigestion
Notes A showed the genomic copy number of 8 reference loci(blue dots) and 24 target loci(green dots). Green line represented the threshold of genomic copy number(0.75-1.25). In this case,the genomic copy number of 24 target loci was normal compared with reference loci. B showed the methylation ratio of 8 reference loci(blue dots) and 24 target loci(red and green dots). Green line represented the threshold of methyletion ratio(30%). The reference loci(blue dots) had high methylation ratio because they had no HhaⅠsite. 4 target loci(MSH2-246,MLH1-148,MLH3-202,MSH3-283) had high methyaltion above the threshold because they were resistant to HhaⅠdigestion,other target loci(green dots) had low methyaltion ratio under the threshold because they were digested by HhaⅠ
如表3所示,在7个MMR基因的24个位点上,有3个目的位点为高甲基化状态(MSH2-246,MLH1-148,MLH3-202,甲基化百分比>80%),20个目的位点为低甲基化状态(甲基化百分比<20%),MSH3-283为中等甲基化状态(20%~80%)。通过比较NTDs组和对照组24个目的位点甲基化百分比均值,发现MSH6和PMS2启动子区上3个位点存在显著差异(MSH6-301:2.5%vs3.7%,P<0.01;PMS2-328:5.7%vs6.7%,P<0.05;PMS2-142:2.0%vs2.7%,P<0.05)。另有MGMT启动子区1个位点(MGMT-193)的甲基化水平差异接近显著水平(P=0.05)。
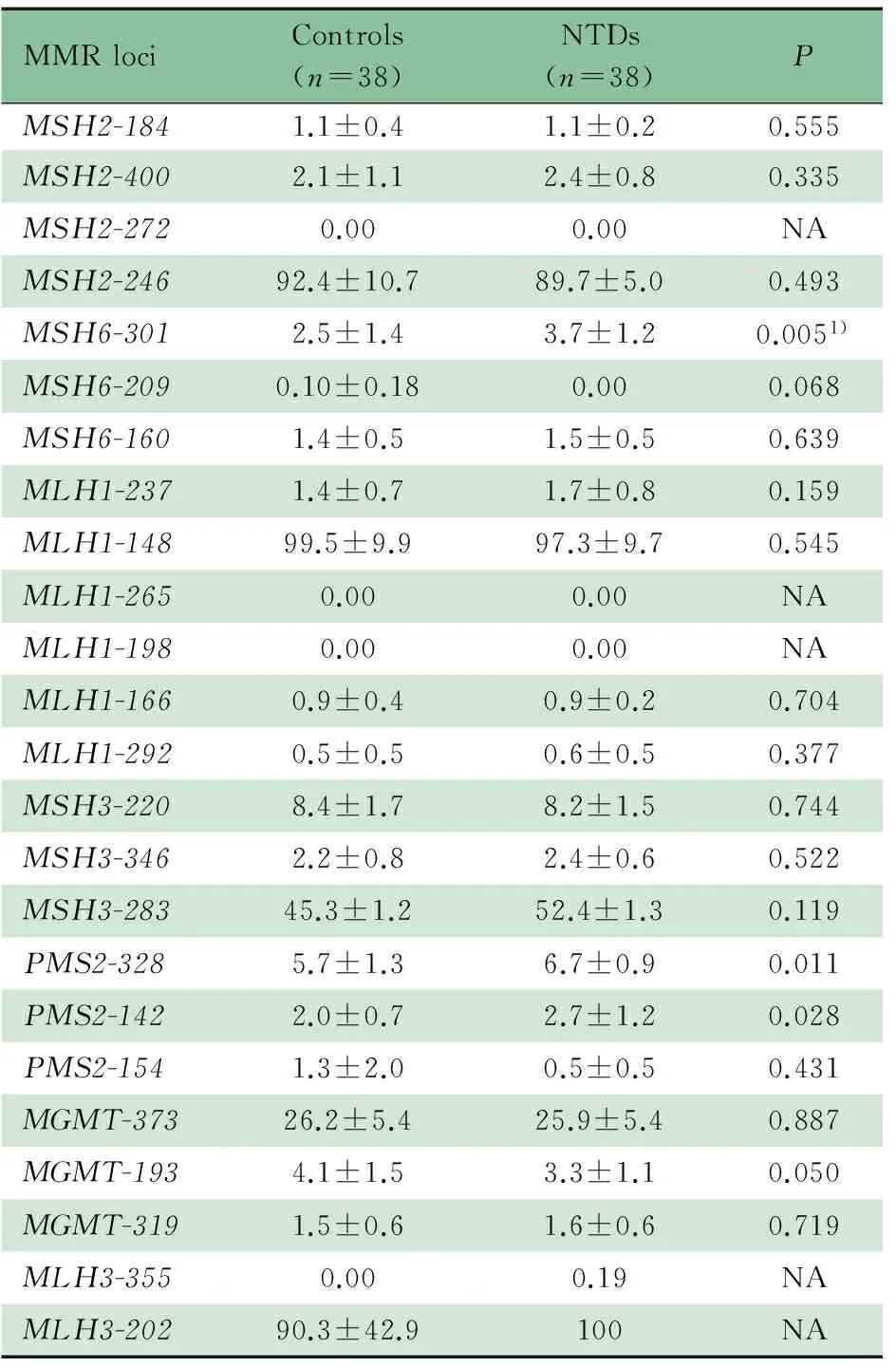
MMRlociControls(n=38)NTDs(n=38)PMSH2-1841.1±0.41.1±0.20.555MSH2-4002.1±1.12.4±0.80.335MSH2-2720.000.00NAMSH2-24692.4±10.789.7±5.00.493MSH6-3012.5±1.43.7±1.20.0051)MSH6-2090.10±0.180.000.068MSH6-1601.4±0.51.5±0.50.639MLH1-2371.4±0.71.7±0.80.159MLH1-14899.5±9.997.3±9.70.545MLH1-2650.000.00NAMLH1-1980.000.00NAMLH1-1660.9±0.40.9±0.20.704MLH1-2920.5±0.50.6±0.50.377MSH3-2208.4±1.78.2±1.50.744MSH3-3462.2±0.82.4±0.60.522MSH3-28345.3±1.252.4±1.30.119PMS2-3285.7±1.36.7±0.90.011PMS2-1422.0±0.72.7±1.20.028PMS2-1541.3±2.00.5±0.50.431MGMT-37326.2±5.425.9±5.40.887MGMT-1934.1±1.53.3±1.10.050MGMT-3191.5±0.61.6±0.60.719MLH3-3550.000.19NAMLH3-20290.3±42.9100NA
Notes NA: not available for student′sttest; 1)Pvalue remained significant after Bonferroni correction at 0.005
3 讨论
DNA甲基化修饰对于胚胎的发育至关重要[27]。在受精后的6~8 h,胚胎经历了广泛的去甲基化过程,此时DNA的甲基化程度会成比例降低。在植入期,胚胎又发生了快速的重新甲基化过程[28]。既往研究发现,阻断Dnmt3b的表达可以干扰神经管的闭合[29]。在对鸡胚的研究中发现,当鸡胚暴露在甲基化抑制剂中,其神经系统的发育会出现延迟,并且这种延迟与所暴露的剂量成正比[30]。这些研究结果均提示NTDs形成过程中可能出现DNA甲基化修饰异常。
本研究采用病例-对照的方法,发现NTDs组胚胎脑组织DNA总体甲基化水平降低,增加了患NTDs的风险,推测脑组织DNA的低甲基化状态可能是母体叶酸缺乏导致胎儿发生NTDs的潜在致病机制之一。
DNA总体甲基化分布存在组织特异性,唐韶青等[31]运用MSAP技术对猪、牛、羊、小鼠、鸡和鸭不同组织的DNA总体甲基化水平做了分析,发现同一种动物不同组织的DNA总体甲基化水平存在差异。本研究发现NTDs组和对照组的DNA总体甲基化水平差异仅表现在脑组织,而两组皮肤组织的DNA总体甲基化水平无显著差异,说明DNA总体甲基化模式在胎儿时期就出现了组织特异性。
在胚胎发育早期,一些神经发育关键基因的启动子区域的甲基化也需要重新修饰。本课题组前期研究应用MS-MLPA(MRC-Holland,ME002-A1)分析了MGMT、MSH6启动子区甲基化异常和NTDs的关系,发现NTDs组(特别是脑部NTDs组)的MSH6(1250-L0798)、MGMT(5670-L5146)位点甲基化状态显著低于对照组(3.5%vs5.3%,16.3%vs27.2%)[32]。本研究结果显示,MGMT-193的差异水平接近显著(P=0.05),进而比较了2个研究中的探针设计位置,发现MGMT-193和MGMT(5670-L5146)为MGMT基因的同一GCGC位点,再次证实MGMT基因启动子异常甲基化与NTDs的关系,而检验P值不同可能源于2个研究中脑部脊柱裂在NTDs组所占比例不同。本研究还发现NTDs组MSH6-301位点甲基化状态显著高于对照组,与本课题组的前期结果不同。通过分析探针位置,发现MSH6-301、MSH6-209、MSH6-160位点与MSH6(1250-L0798)所处基因组位置不同,说明了基因启动子CpG区甲基化修饰的复杂性,即使同一基因的同一区域,各位点的甲基化状态也存在差异。Liu等[33]研究NTDs胎儿的MLH1、MSH2启动子甲基化水平,发现NTDs组和正常对照组并无显著差异,且各位点的甲基化状态也不一致,如MSH2均为低甲基化水平位点,而MLH1有2个高甲基化水平位点。本研究分析了4个MSH2位点和6个MLH1位点,虽然研究位点不同,但也证实仅MSH2-246和MLH1-148为高甲基化水平位点,其余位点都处于低甲基化水平,并且NTDs组和对照组甲基化水平无显著差异。除已报道的MSH2、MSH6和MGMT外,本研究还新发现1个MMR(PMS2)启动子甲基化水平在NTDs组和对照组存在显著差异,提示了PMS2启动子甲基化异常和NTDs的关系。上述结果深化了对神经管发育过程中MMR的DNA甲基化修饰的认识。
总之,本研究对NTDs胚胎脑组织DNA总体甲基化、MMR启动子区甲基化水平进行了分析,发现NTDs胚胎脑组织DNA总体甲基化水平显著低于对照组,DNA总体低甲基化水平显著增加了NTDs患病风险。同时发现NTDs组的MSH6、PMS2基因启动子区甲基化水平不同于对照组。这些结果为进一步研究神经管发育过程中DNA总体低甲基化的发生发展、MMR甲基化修饰奠定基础,也为明确叶酸缺乏与DNA甲基化异常、NTDs发生的关系,叶酸预防NTDs机制提供理论依据。
目前关于基因特定位点甲基化检测方法有MS-MLPA、甲基化特异性PCR(MS-PCR)、结合重亚硫酸盐的限制性内切酶法(COBRA)、甲基化特异探针杂交法。MS-MLPA技术将甲基化敏感性限制性内切酶HhaⅠ和探针杂交技术结合,通过分析模板DNA酶切后的扩增比例来定量甲基化程度。该技术缺点是所分析位点受限制性内切酶位点(GCGC序列)限制,因而在本研究中,对于MMR的启动子区非HhaⅠ位点,其甲基化程度无法依赖MS-MLPA进行定量,今后需要利用其他甲基化研究技术继续分析MMR的启动子区甲基化水平。
[1]Botto LD,Moore CA,Khoury MJ,et al. Neural-tube defects. N Engl J Med,1999,341(20):1509-1519
[2]Feuchtbaum LB,Currier RJ,Riggle S,et al. Neural tube defect prevalence in California(1990-1994): eliciting patterns by type of defect and maternal race/ethnicity. Genet Test,1999,3(3):265-272
[3]van der Put NM,van Straaten HW,Trijbels FJ,et al. Folate,homocysteine and neural tube defects: an overview. Exp Biol Med(Maywood),2001,226(4):243-270
[4]Wang YP(王艳萍),Zhu J,Wu YQ,et al. Dynamic variation of incidence of neural tube defects during 1988 to 1992 in China. Chin J Prev Med(中华预防医学杂志),1998,32(6):369-371
[5]Gu X,Lin LM,Zheng XY,et al. High prevalence of NTDs in Shanxi Province: a combined epidemiological approach. Birth Defects Research(part A),2007,79:702-707
[6]Copp AJ,Green NDE,Murdoch JN. The genetic basis of mammalian neurulation. Nat Rev Genet,2003 ,4(10):784-793
[7]Blom HJ,Shaw GM,den Heijer M,et al. Neural tube defects and folate: case far from closed. Nat Rev Neurosci,2006,7(9):724-731
[8]Kibar Z,Capra V,Gros P. Toward understanding the genetic basis of neural tube defects. Clin Genet,2007,71(4):295-310
[9]Kibar Z,Torban E,McDearmid JR,et al. Mutations in VANGL1 associated with neural-tube defects. N Engl J Med,2007,356(14):1432-1437
[10]Smithells RW,Sheppard S,Schorah CJ,et al. Vitamin defi-ciencies and neural tube defects. Arch Dis Child,1976,51:944-950
[11]Czeizel AE,Dudas I. Prevention of the first occurrence of neural tube defect by periconceptional vitamin supplementation. N Engl J Med,1992,327(26):1832-1835
[12]Smithells RW,Nevin NC,Seller MJ,et al. Further experience of vitamin supplementation for prevention of neural tube defect recurrences. Lancet,1983,1(8332):1027-1031
[13]Wald N,Sneddon J,Densem J,et al. MRC Vitamin study research group: Prevention of neural tube defects: results of the medical research council vitamin study. Lancet,1991,338(8760):131-137
[14]Berry RJ,Li Z,Erickson JD,et al. Prevention of neural-tube defects with folic acid in China. China-U.S. Collaborative Project for Neural Tube Defect Prevention. N Engl J Med,1999,341(20):1485-1490
[15]Wolff GL,Kodell RL,Moore SR,et al. Maternal epigenetics and methyl supplements affect agouti gene expression in Avy/a mice. FASEB,1998,12(11):949-957
[16]Christman JK,Sheikhnejad G,Dizik M,et al. Reversibility of changes in nucleic acid methylation and gene expression induced in rat liver by severe dietary methyl deficiency. Carcinogenesis,1993,14(4):551-557
[17]Deaton AM,Bird A. CpG islands and the regulation of trans-cription. Genes Dev,2011,25(10):1010-1022
[18]Duthie SJ. Folic acid deficiency and cancer: mechanisms of DNA instability. Br Med Bull,1999,55(3):578-592
[19]Ehrlich M. DNA hypomethylation,cancer,the immuno-deficiency,centromeric region instability,facial anomalies syndrome and chromosomal rearrangements. J Nutr,2002,132(8S):2424-2429
[20]Eden A,Gaudet F,Waghmare A,et al. Chromosomal instabi-lity and tumors promoted by DNA hypomethylation. Science,2003,300(5618):455
[21]Van den Veyver IB. Genetic effects of methylation diets. Annu Rev Nutr,2002,22:255-282
[22]Hales B. DNA repair disorders causing malformations. Curr Opin Genet Dev,2005,15(3):234-240
[23]Jacob W,Kaplan D,Miller F. The p53 family in nervous system development and disease. J Neurochem,2006,97(6):1571-1584
[24]Frappart PO,McKinnon PJ. BRCA2 function and the central nervous system. Cell Cycle,2007,6(20):2453-2457
[25]Bao R(保睿),Zou JZ,Wu S,et al. A primary study on the correlation of DNA mismatch repair proteins(MLH1,PMS2,MSH2,MSH6) with neural tube defects(NTDs). Chinese Journal of Birth Health & Heredity(中国优生与遗传杂志),2010,18(5):10-13
[26]Zhang T,Xin R,Gu X,et al. Maternal serum vitamin B12,folate and homocysteine and the risk of neural tube defects in the offspring in a high-risk area of China. Public Health Nutr,2008,12(5):680-686
[27]Chen X,Guo J,Lei Y,et al. Global DNA hypomethylation is associated with NTD-affected pregnancy: A case-control study. Birth Defects Res A Clin Mol Teratol,2010,88(7):575-581
[28]Reik W,Dean W,Walter J. Epigenetic reprogramming in mammalian development. Science,2001,293(5532):1089-1093
[29]Okano M,Bell DW,Haber DA,et al. DNA methyltransferase Dnmt3a and Dnmt3b are essential for de novo methylation and mammalian development. Cell,1999,99(3):247-257
[30]Afman LA,Blom HJ,Drittij MJ,et al. Inhibition of transmethylation disturbs neurulation in chick embryos. Brain Res Dev Brain Res,2005,158(1-2):59-65
[31]Tang SQ(唐韶青),Zhang Y,Xu Q,et al. Analysis of methylation level of genome in various tissues of different animal species. Journal of Agricultural Biotechnology(农业生物技术学报),2006,14(4):507-510
[32]Tran S,Wang L,Le J,et al. Altered methylation of the DNA repair gene MGMT is associated with neural tube defects. J Mol Neurosci. 2011 Nov 19
[33]Liu Z,Wang Z,Li Y,et al. Association of genomic instability,and the methylation status of imprinted genes and mismatch-repair genes,with neural tube defects. Eur J Hum Genet,2012,242:1-5

