油酰乙醇胺对血管紧张素Ⅱ诱导的血管平滑肌细胞增殖的影响
张 乐,邹 军,田 风,魏 晓,金 鑫
(厦门大学 医学院,福建 厦门 361005)
油酰乙醇胺对血管紧张素Ⅱ诱导的血管平滑肌细胞增殖的影响
张 乐,邹 军,田 风,魏 晓,金 鑫
(厦门大学 医学院,福建 厦门 361005)
目的 研究油酰乙醇胺(OEA)对血管紧张素Ⅱ(AngⅡ)刺激大鼠主动脉血管平滑肌细胞(VSMCs)增殖的抑制作用以及对p38信号通路的影响。方法 分离大鼠胸主动脉,组织贴块法培养VSMCs,AngⅡ刺激VSMCs建立细胞增殖模型,不同浓度OEA(5,10,20μmol/L)作用后,用溴脱氧核苷尿嘧啶(BrdU)掺入的方法检测细胞增殖活性;流式细胞术检测细胞周期变化;Western-bolt法检测对P-p38和p38蛋白表达的影响。结果 与AngⅡ组比较,随着OEA浓度升高,VSMCs的增殖受到抑制、G0/G1比例显著升高,G2/M比例显著降低,且P-p38和p38蛋白的表达量降低并呈浓度依赖关系。结论 OEA对VSMCs的增殖有抑制作用,其机制可能是抑制了p38MAPK信号通路。
油酰乙醇胺;平滑肌细胞;增殖;p38;血管紧张素Ⅱ
血管平滑肌细胞(VSMCs)的增殖和迁移是血管再狭窄和动脉粥样硬化发展形成过程中的重要部分[1]。过氧化增殖因子活化受体-α(PPAR-α)与动脉粥样硬化的发生发展紧密相连,不仅是由于它跟脂质代谢、糖类代谢密切相关,而且还由于其抗炎和抗增殖作用[2]。油酰乙醇胺(OEA)是一种天然的脂肪酸乙醇胺,已有研究表明,OEA是PPAR-α的一个高亲和天然配体[3-4]。实验发现,OEA可以通过激活PPAR-α受体从而发挥血管内皮的保护[5]、脑缺血的保护[6]和抗炎等多种作用,但是对细胞增殖方面作用,尚未见报道。因此本实验的主要内容是对OEA在动脉粥样硬化后期形成过程中主要的抗增殖作用进行体外研究。
1 材料
OEA,自制;非诺贝特、血管紧张素Ⅱ(AngⅡ)、胰蛋白酶,美国Sigma公司;二甲亚砜,上海生物工程技术服务有限公司;胎牛血清,新西兰 Hyclone公司;低糖DMEM培养基,日本GIBCO公司;小鼠抗大鼠α-actin单克隆抗体,武汉博士德生物工程公司;溴脱氧核苷尿嘧啶(BrdU)标记及检测试剂盒,德国Roche公司;兔抗鼠Phospho-p38单克隆抗体、兔抗鼠p38单克隆抗体,美国Cell Signaling公司;鼠抗人β-actin单克隆抗体,美国Santa Cruz公司;羊抗兔二抗、羊抗鼠二抗,美国Muhisciences公司。
雄性SD大鼠,体重(100±5)g,上海斯莱克动物实验中心,许可证号:SCXK(沪)2007-0005。
SpectraMax-M2多功能酶标仪,美国 Molecular Devices公司;倒置荧光显微镜,日本 Nicon公司;FACSCal ibur型流式细胞仪,美国BD公司;Kodak IS4000R全自动图像工作站,美国Kodak公司。
2 方法
2.1 大鼠VSMCs的培养和鉴定
大鼠断头处死,无菌操作取一段胸主动脉,洗去血液,去除外膜纤维脂肪组织,用眼科剪纵行剪开血管,刀片刮血管内膜2~3遍,然后将血管切成约1 mm2大小碎片,分装贴入培养瓶中,加入含10%小牛血清的DMEM培养基,倒置3~4 h后翻转,于37℃,5%CO2的细胞培养箱中静置3 d,每2天换液。4~7 d平滑肌细胞从组织块中爬出,2~3周出现致密细胞层。待细胞快融合时用0.25%胰蛋白酶消化传代,取3~8代细胞做实验。在倒置显微镜下观察及 α-actin单克隆抗体,通过免疫组化法鉴定VSMCs的特异性肌动蛋白。
2.2 BrdU-ELISA 法检测
以细胞数10 000/孔接种96孔板培养48 h后,观察细胞生长状态良好,换无血清培养液,24 h同步化后,加入不同浓度的 OEA(分别为 5,10及20 μmol/L)和非诺贝特100μmol/L,1 h后再加入AngⅡ100 nmol/L,共同培养24 h后,每孔加入BrdU 10 μL标记细胞,37℃孵育2 h,弃培养液。经60℃干燥1 h,FixDenat固定液室温固定30 min。弃固定液加入Anti-BrdU-POD液室温放置90 min,吸弃抗体加洗涤工作液洗涤,每孔3次。加底物溶液100 μL,室温放置30 min。每孔加终止反应液(1 mol/L H2SO4)25μL,5 min内自动酶标仪测定,λ(测)=450 nm,λ(参)=690 nm。
2.3 细胞周期测定
将细胞接种于6孔培养板,37℃孵育24 h后换无血清培养液,将细胞阻滞在G0/G1期。48 h后换2%低血清培养液,分为正常组、AngⅡ组、不同浓度的OEA组和非诺贝特组,将细胞置37℃继续培养36 h,经碘化丙锭染色后,用流式细胞仪自动计数10 000个细胞,流式细胞仪测定细胞周期构成比。
2.4 Western blotting 检测
取VSMCs细胞,以细胞数1×105个/mL接种6孔板中,置于37℃、5%CO2培养箱内培养。细胞生长近融合后,弃上清液,以无血清高糖DMEM为空白对照,分别加入含不同浓度的OEA和非诺贝特培养基培养1 h后,AngⅡ刺激5 min,提取蛋白。用改良型RIPA细胞裂解液,冰浴裂解细胞30 min,BCA方法测定细胞总蛋白浓度,按常规方法进行SDSPAGE凝胶电泳,转膜并封闭后,分别加入P-p38、p38、GAPDH 单克隆抗体(1∶1 000)1 mL,4 ℃过夜。再加入二抗(1∶1 000)1 mL,室温孵 1 h,洗膜、使用Kodak IS4000R全自动图像工作站,检测、拍照,分析条带灰度值。
2.5 统计学分析
采用 Graphpad Prism 5(GraphPad Software Inc,USA)软件进行分析,所有数据以(s)表示,两组间样本均数比较采用t检验。
3 结果
3.1 OEA对AngⅡ诱导的VSMCs增殖的影响
不同浓度的OEA和非诺贝特作用1 h后,给予AngⅡ刺激,24 h后检测细胞增殖,结果显示OEA可以剂量依耐性抑制VSMCs增殖,并在20μmol/L浓度作用最好,见表1。
表1 OEA对AngⅡ诱导的VSMCs增殖的影响(n=6s)Tab.1 Effects of OEA on AngⅡ induced rat VSMCs proliferation(n=6s)
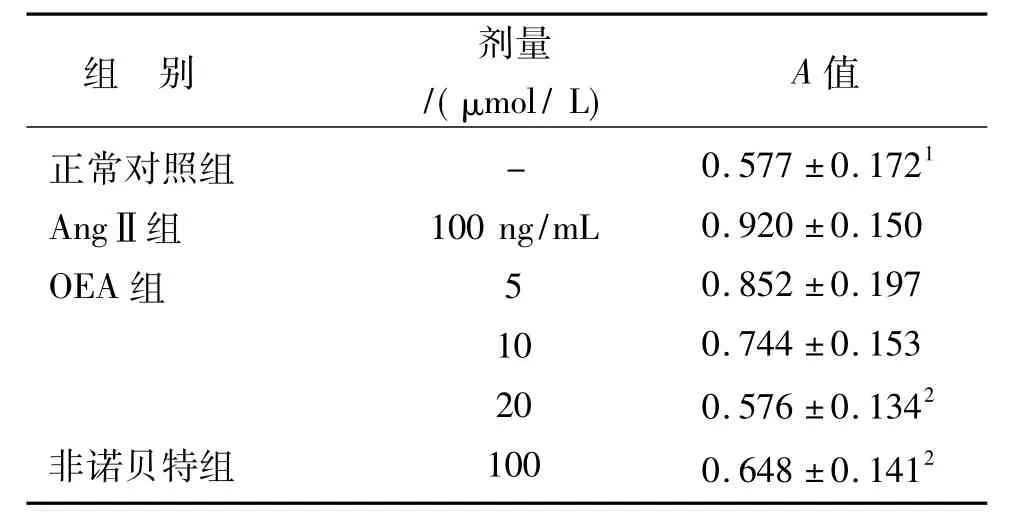
表1 OEA对AngⅡ诱导的VSMCs增殖的影响(n=6s)Tab.1 Effects of OEA on AngⅡ induced rat VSMCs proliferation(n=6s)
与 AngⅡ组比较:1P <0.05,2 P <0.011 P <0.05,2 P <0.01 vs AngⅡ group
?
3.2 OEA对AngⅡ诱导的VSMCs周期的影响
不同浓度的OEA和非诺贝特与AngⅡ共同作用36 h,可以影响VSMCs细胞周期分布使G0/G1期细胞比例增高,S期细胞比例降低,G2/M期比例降低,特别浓度在20μmol/L的OEA作用效果最好,与阴性对照组相比差异有显著性(P<0.05),结果见表2。表明 OEA将平滑肌细胞细胞周期阻滞于G0/G1期,从而抑制平滑肌细胞增殖。
表2 OEA对VSMCs周期的影响(n=6s)Tab.2 Effects of OEA on cell cycle of VMSCs(n=6s)
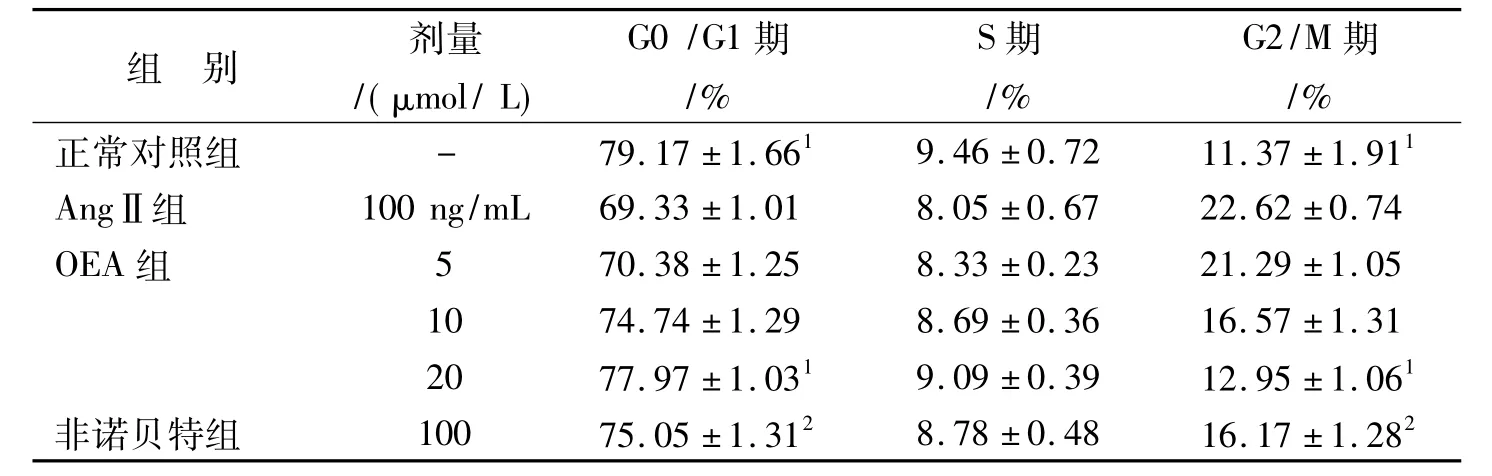
表2 OEA对VSMCs周期的影响(n=6s)Tab.2 Effects of OEA on cell cycle of VMSCs(n=6s)
与 AngⅡ组比较:1 P <0.05,2 P <0.011 P <0.05,2 P <0.01 vs AngⅡ group
?
3.3 OEA对AngⅡ诱导的VSMCs P-p38和p38蛋白的影响
与对照组相比,AngⅡ诱导后 P-p38的表达明显增加(P<0.001),加入 OEA,P-p38的表达呈一定的剂量依赖性减少,其中20μmol/L OEA对P-p38的下调作用最明显,作用好于100μmol/L非诺贝特,见表3和图1A。同样,AngⅡ诱导后,p38的表达增加(P<0.05),给予OEA或非诺贝特干预后,p38的表达下调,见图1B。
表3 OEA对VSMCs P-p38和p38蛋白表达的影响(n=4±s)Tab.3 Effects of OEA on protein expression of P-p38 and p38 in VMSCs(n=4±s)

表3 OEA对VSMCs P-p38和p38蛋白表达的影响(n=4±s)Tab.3 Effects of OEA on protein expression of P-p38 and p38 in VMSCs(n=4±s)
与 AngⅡ组比较:1 P <0.05,2 P <0.01,3 P <0.0011 P <0.05,2 P <0.01,3 P <0.001 vs AngⅡ group
?
4 讨论
VSMCs异常增殖是许多心血管疾病的共同病理过程,在众多促生长因子中,AngⅡ已成为当前研究的热点。AngⅡ是肾素-血管紧张素系统的主要活性物质,与VSMCs上其1型受体(Angiotensin type 1 recepto r,AT1R)结合后,可经丝裂原激动蛋白激酶(mitogen activated protein kinase,MAPK)、核因子-B(NF-κB)等多条信号通路,启动VSMCs的增殖和迁移。其中p38MAPK信号转导通路是MAPK通路一个重要分支,它在炎症、应激、凋亡、细胞周期和生长等多种生理和病理过程中发挥重要作用[7-9]。MKK3与MKK6是公认的p38上级激酶,它们通过直接磷酸化络氨酸、丝氨酸/苏氨酸残基激活p38,作用与 GADD153、c-myc等下游靶基因[10],控制多种转录因子的基因表达活性,如激活作用转录因子、生长停滞及DNA损伤基因、核因子NF-κB等。
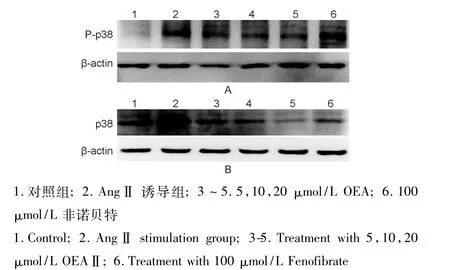
图1 OEA对VSMCs中P-p38(A)和p38(B)蛋白表达的影响Fig.1 Effects of OEA on protein expression of P-p38(A)and p38(B)in VSMCs
OEA作为一个重要的体内脂质调节因子,通过激活PPAR-α起到调节脂质、糖类代谢的作用。已有研究发现,PPAR-α可以抑制单核细胞转化为巨噬细胞,抑制血管平滑肌细胞增殖和迁移,抑制泡沫细胞的形成等[11-12]。PPAR-α的激动剂能够调节p38MAPK信号通路上调PPAR-α表达,诱导VSMCs凋亡[13]。Gizard 等[14]认为,PPAR-α 可以通过诱导细胞素依赖性激酶抑制子p16,阻断细胞周期中G1到S期的转变,抑制 VSMCs的增殖,这可能是PPAR-α影响动脉粥样硬化的发生发展和再狭窄的进程作用之一。本研究中,AngⅡ诱导VSMCs增殖周期从 G0/G1期向 S期、G2/M期转化,刺激VSMCs增殖,同时增强P-p38和p38蛋白表达。然而,5~20μmol/L的OEA能够阻止VSMCs向S期、G2/M期转化,显著抑制VSMCs增殖,降低P-p38和p38表达,且具有浓度依耐性。因此推测OEA能使细胞周期中静止和分裂前期的细胞显著增多,从而抑制VSMCs的增殖,且抗增殖的作用至少部分是由p38MAPK途径表达介导,至于OEA参与p38MAPK信号通路表达的分子机制尚不清楚,有待进一步研究。
综上所述,OEA至少部分通过调节p38 MAPK信号通路,从而抑制AngⅡ诱导的VSMC增殖,发挥血管保护作用。本文加深对PPAR-α在动脉粥样硬化中作用的认识,并为该药的临床应用提供了理论依据。
[1]Schmidt-Ott K M,Kagiyama S,Phillips M I.The multiple actions of angiotensinⅡ in atherosclerosis[J].Regul Peptides,2000,93(1-3):65-77.
[2] Lefebvre P,Chinetti G,Stael B,et al.Sorting out the roles of PPAR-α in energy metabolism and vascular homeostasis[J].J Clin Invest,2006,116(3):571-579.
[3]Fu J,Oveisi F,Gaetani S,et al.Oleoylethanolamide,an endogenous PPAR-α agonist,lowers body weight and hyperlipidemia in obese rats[J].Neuropharmacology,2005,48(8):1147-1153.
[4]Guzman M,Lo V J,Fu J,et al.Oleoylethanolamide stimulates lipolysis by activating the nuclear receptor peroxisome proliferator-activated receptor alpha(PPAR-alpha)[J].J Biol Chem,2004,279(27):27849-27854.
[5]秦 文,金 鑫,陈彩霞,等.油酰乙醇胺对人脐静脉内皮细胞血管细胞黏附分子-表达的影响[J].中国生化药物杂志,2008,29(6):374-377.
[6]杨立朝,杨武双,周 宇,等.油酰乙醇胺对小鼠局灶性脑缺血的保护作用[J].中国药理学通报,2009(9):1219-1223.
[7]Bao X M,W u CF,Lu G P.Atorvastatin attenuates homocysteineinduced apoptosis in human umbilical vein endothelial cells via inhibiting NADPH oxidase-related oxidative stress-triggered p38 MAPK signaling[J].Acta Pharmacol Sin,2009,30(10):1392-1398.
[8]Ho T C,Chen SL,Yang Y C,et al.Cytosolic phospholipase A2-alpha is an early apoptotic activator in PEDF-induced endothelial cell apoptosis[J].Am J Physiol Cell Physiol,2009,296(2):C273-284.
[9]Wang X H,Xu B,Liu JT,et al.Effect of beta-escin sodium on endothelial cells pro liferation,migration and apoptosis[J].Vascul Pharmacol,2008,49(4-6):158-165.
[10] Enslen H,Raingeaud J,Davis RJ.Selective activation of p38 mitogen-activated protein(MAP)kinase isoforms by the MAP kinase kinases MKK3 and MKK6[J].J Biol Chem,1998,273(3):1741-1748.
[11] Zapolska Downal D,Siennicka A,Kaczmarczyk M,et al.Butyrate inhibits cytokine-induced VCAM-1 and ICAM-1 expression in cultured endothelial cells:the role of NF-κB and PPAR-α[J].J Nutr Biochem,2004,15(4):220-228.
[12] Wang Y,Wang Y,Yang Q,et al.Effects of bezafibrate on the expression of endothelial nitric oxide synthase gene and its mechanisms in cultured bovine endothelial cells[J].Atherosclerosis,2006,187(2):265-273.
[13] Diep Q N,Touyz R M,Schiffrin E L.Docosahexaenoic acid,a peroxisome proliferator-activated receptor-α ligand,induces apoptosis in vascular smooth muscle cells by stimulation of p38 mitogen-activated protein kinase hypertension[J].2000,36(5):851-855.
[14] Gizard F,Amant C,Barbier O,et al.PPARα inhibits vascular smooth muscle cell proliferation underlying intimal hyperplasia by inducing the tumor suppressor p16INK4a[J].J Clin Invest,2005,115(11):3228-3238.
Inhibitory effect of oleoylethanolamide on proliferation of vascular smooth muscle cells induced by angiotensinⅡ
ZHANG Le,ZOU Jun,TIAN Feng,WEI Xiao,JIN Xin
(School of Medicine,Xiamen University,Xiamen 361005,China)
Purpose To investigate the inhibitory effect of oleoylethanolamide on the proliferation of cultured rat vascular smooth muscle cells(VSMCs)induced by angiotensinⅡand the effect on p38 signaling pathway.Methods VSMCs were primary cultured by tissue sticking method.Cell proliferation model was established by stimulation with AngⅡ.After incubation with various concentrations of OEA(5,10,20 μmol/L)for 24 h,the proliferation effect was measured by using the BrdU cell proliferation assay kit.Cell cycle distribution was determined by flow cytometry analysis and the protein expression of P-p38 and p38 was assessed using Western blotting.Results Compared with the AngⅡ group,along with the increased concentration of OEA,the proliferation of VSMCs was obviously inhibited,the cell ratio of G0/G1 phase obviously increased,and the cell ratio of G2/M phase significantly decreased.Besides,the expression of P-p38 and p38 protein decreased in a dose-dependent manner.Conclusion OEA had a inhibition on the proliferation of VSMCs,and might act by down-regulating p38MAPK pathway.
oleoylethanolamide;vascular smooth muscle cells;proliferation;p38;angiotensin Ⅱ
R285.5
A
1005-1678(2012)06-0709-04
2012-03-26
海峡(厦门)中医药科技平台项目(3502Z20100006);厦门市科技计划资助项目(3502Z20090009)
张 乐,女,硕士研究生;金 鑫,男,通信作者,教授,从事心血管药理学研究,Tel:0592-2188676,Email:xinjin@xmu.edu.cn。

