柱前衍生化HPLC法测定黄河滩枣多糖的单糖组成
郝蕾蕾,张典瑞,赵忠熙,刘 燕
(山东大学 药学院,药物制剂与释药系统研究中心,山东 济南 250012)
柱前衍生化HPLC法测定黄河滩枣多糖的单糖组成
郝蕾蕾,张典瑞,赵忠熙,刘 燕
(山东大学 药学院,药物制剂与释药系统研究中心,山东 济南 250012)
目的 建立PMP(1-苯基-3-甲基-5-吡唑啉酮)柱前衍生化HPLC法测定黄河滩枣多糖的单糖组成。方法 采用水提醇沉法提取黄河滩枣多糖,多糖水解后进行PMP衍生化,HPLC法测定黄河滩枣多糖的单糖组成及摩尔比,并对等度和梯度洗脱两种模式的测定结果进行分析比较。结果 黄河滩枣多糖由D-甘露糖、L-鼠李糖、D-半乳糖醛酸、D-葡萄糖、D-半乳糖、L-阿拉伯糖等六种单糖组成,它们的摩尔比约为 0.54∶0.50∶0.27∶2.03∶5.40∶1.00,等度和梯度洗脱测定结果基本一致。结论 本实验改进的等度洗脱方式更加简便易行,快速准确,适用于黄河滩枣多糖的单糖组成分析。
黄河滩枣多糖;单糖组成;PMP柱前衍生;高效液相色谱
黄河滩枣(以下简称“大枣”),是黄河流域两岸地带培育的大红枣,含有多糖、黄酮、皂苷、三萜、生物碱、环磷酸腺苷、环磷酸鸟苷等多种生物活性物质[1]。大枣多糖是其中最重要的活性成分之一,可作为免疫促进剂,能控制细胞的分裂和分化,调节细胞的生长与衰老,有效清除人体内的氧自由基,是抗衰老的主要活性成分。近年来的研究进一步证实,大枣多糖具有抗癌、治疗肝损伤、抗艾滋病、抗病毒等生理功能,并对放射性损伤有一定的保护作用[2-4]。
大枣由于产地、采摘时期的不同,都可能造成单糖的组分有差别,研究和改进单糖组分的测定方法对于深入开发大枣多糖很有必要。柱前衍生化HPLC法是目前分离和检测多糖中单糖组成较常用的方法,PMP(1-苯基-3-甲基-5-吡唑啉酮)作为还原性糖的最好衍生化试剂之一,在碱性条件下能与单糖定量缩合生成单糖-PMP衍生物,该衍生物不易裂解及产生异构峰并在250 nm波长处有强吸收[5]。本文采用PMP柱前衍生化HPLC法测定黄河滩枣多糖的单糖组成及摩尔比,并对等度和梯度洗脱两种方式测定结果进行比较,以探索更加准确,简单易行且重现性好的单糖组分分析方法。
1 材料
黄河滩枣(大枣),产自陕西榆林佳县,洗净,45℃烘干,适度粉碎后备用。
PMP(99.0%)、D-甘露糖(Man,≥99.0%)、L-鼠李糖(Rha,≥99.0%)、D-半乳糖醛酸(GalUA,≥97.0%)、D-葡萄糖 (Glc,≥99.5%)、D-半乳糖(Gal,≥99.0%)、L-阿拉伯糖(Ara,≥99.0%)等均购于美国Sigma公司;乙腈为色谱纯;苯酚、氯仿等试剂均为分析纯。
Agilent 1260型高效液相色谱仪(美国Agilent公司),包括G1311B型四元泵、G1367E型高性能自动进样器、G1316A型柱温箱、G4212B型DAD检测器等;UV-2102PCS型紫外可见分光光度仪(上海龙尼柯仪器有限公司);RE-52AA型旋转蒸发仪(菏泽市鑫源仪器仪表有限公司)。
2 方法与结果
2.1 大枣多糖的提取
采用水提醇沉法[6-8]提取大枣多糖:取去核枣粉50.0 g,加入 80% 乙醇 250 mL,回流脱脂两次,过滤,取枣渣加入10倍量的水,90℃水浴浸提3次,离心分离合并多糖提取液;将提取液旋转蒸发浓缩后缓慢加入无水乙醇,至溶液中乙醇浓度为80%时,收集多糖沉淀,用丙酮洗涤数次,再以水溶解沉淀,得到粗多糖溶液;用氯仿-正丁醇脱蛋白,用NaOH溶液调节pH值至8.8,加入多糖溶液体积40%的H2O2,40℃水浴保温4 h脱色;脱色液对水透析24 h,无水乙醇沉淀,离心分离,45℃真空干燥,即得大枣多糖。
2.2 苯酚-硫酸法测定大枣多糖的糖含量
分别取100 μg/mL Glc 溶液0.1,0.2,0.3,0.4,0.5,0.6,0.7 mL,依次加水使最终体积为 1 mL。另取水1 mL作空白对照,每支试管加5%苯酚溶液1.6 mL,再加入硫酸7 mL,摇匀放置冷却至室温。在491 nm波长处测定吸光度(A)值,以浓度(C,μg/mL)为横坐标,A为纵坐标,进行线性回归,回归方程为:A=0.008 2 C+0.017 0,r=0.998 9。取一定量的大枣多糖样品液进行测定,得大枣多糖的糖含量为42.58%,可进一步水解来分析大枣多糖的单糖组成。
2.3 大枣多糖的水解
准确称取精制大枣多糖30.0 mg,于安瓿中加入2 mol/L硫酸,用氮气排尽空气,封管后于110℃烘箱中水解8 h,得大枣多糖水解样品液。冷却至室温,NaOH 溶液中和至 pH 7.0,0.22 μm 微孔滤膜过滤,滤液用于PMP衍生化。
2.4 单糖对照品的柱前衍生[9-10]
分别准确称取 Man、Rha、GalUA、Glc、Gal和 Ara各1 mmol,分别溶于0.3 mol/L NaOH 溶液10 mL中,得到6种单糖的对照溶液,低温密封保存。各取相同体积的6种单糖对照溶液混匀,得到混合对照单糖溶液。分别取6种单糖溶液、混合溶液各100 μL与 0.5 mol/L PMP的甲醇溶液100μL混合,70℃水浴反应30 min,取出冷却至室温,加入0.3 mol/L HCl溶液100μL进行中和,再加入水1 mL及氯仿1 mL进行萃取,充分振荡离心,吸弃下层有机相,重复3次,合并上层水相,水相溶液经0.22μm滤膜过滤后,用水稀释至一定浓度用于HPLC分析。
2.5 大枣多糖水解液的柱前衍生
将大枣多糖水解样品液用0.3 mol/L NaOH溶液稀释一定浓度后,按2.4项下方法进行衍生化处理,HPLC进样分析。
2.6 色谱条件
色谱柱:Agilent Poroshell 120 SB-C18(4.6 mm ×100 mm,2.7 μm);流动相:0.05 mol/L 磷酸盐缓冲液(pH 6.8)-乙腈;等度洗脱时,缓冲液与乙腈体积比为82∶18;梯度洗脱时,时间从 0→10→20 min,对应的乙腈体积分数0→18%→25%;柱温:25℃;检测波长:250 nm;流速:1.0 mL/min;进样体积:10 μL。
2.7 柱前衍生化方法学考察
2.7.1 线性关系和最小检测限考察 配制6种单糖对照品一系列摩尔浓度的NaOH溶液,按2.4项下方法进行衍生化,得到单糖衍生物浓度为0.05~5.0 mmol/L的溶液,按等度洗脱依次进样10μL,根据测得的峰面积(y)对相应单糖的浓度(x,mg/L)进行线性回归。再将最小摩尔浓度的标准溶液逐级稀释,依次进样,计算当信噪比为3时所对应溶液的质量浓度以确定最低检测限(LOD),结果如表1所示。
2.7.2 进样精密度和方法重复性考察 6种单糖衍生物的溶液,连续重复进样分析7次,Man、Rha、GalUA、Glc、Gal和 Ara的仪器精密度(RSD,n=7)分别为 0.63%,0.90%,1.50%,1.72%,1.81%,1.82%。
同一批对照品平行配制3份混合溶液进行衍生处理,每一个样品连续进样3次,得到3个平行样中Man、Rha、GalUA、Glc、Gal和 Ara 的方法精密度(RSD,n=3)分别为 0.83%,0.47%,0.69%,1.04%,0.94%,1.07%。
可见,进样精密度和方法重复性的峰面积RSD均小于2.0%,因此PMP柱前衍生化HPLC法适用于简单含糖样品中单糖组成的分析。
2.7.3 回收率考察 精密吸取已知单糖含量的大枣多糖水解液6份,加入等量的单糖标准混合溶液,按2.4项下方法进行衍生化处理,HPLC等度洗脱测定峰面积,代入单糖的回归方程,计算回收率。得Man、Rha、GalUA、Glc、Gal和 Ara 的回收率分别为98.5%,100.2%,103.2%,96.7%,97.4% 和98.6%;RSD 分别为 1.02%,0.94%,1.61%,1.19%,1.29%和 1.32%。
2.7.4 衍生产物稳定性考察 将标准混合溶液按2.4项下方法进行衍生化处理,从氯仿萃取后开始计时,于 2,4,6,8,10,12 和 24 h 分别连续进样 3次,HPLC等度洗脱进行分析。12 h内 Man、Rha、GalUA、Glc、Gal和 Ara的衍生物峰面积的 RSD为1.12%,1.06%,1.37%,1.21%,1.58% 和 1.53%。但在24 h测定时所有衍生物峰面积下降较多,各峰面积减小幅度在8.0% ~12.0%之间。所以要想获得精确的结果,最好在12 h内分析。

表1 6种单糖的标准曲线Tab.1 Calibration curves of six monosaccharides
2.8 大枣多糖中的单糖组成分析
2.8.1 大枣多糖的PMP衍生化HPLC分析(等度洗脱) 混合标准单糖及大枣多糖水解衍生液的等度洗脱色谱图如图1所示。由图可见,大枣多糖的单糖组成包括 Man、Rha、GalUA、Glc、Gal和 Ara 等 6种单糖,在12 min内均达到基线分离,按文献方法[11]计算得到的单糖摩尔比为 0.54∶0.50∶0.27∶2.03∶5.40∶1.00。
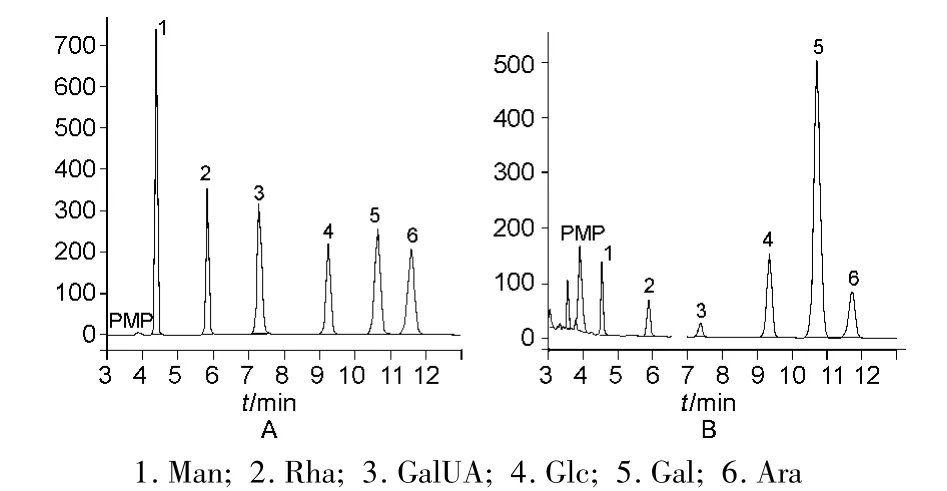
图1 混合标准单糖(A)及大枣多糖水解衍生液(B)的色谱分离图(等度洗脱)Fig.1 HPLC separation of standard monosaccharides(A)and the derivatives of jujube polysaccharide hydrolysates(B)(isocratic elution)
2.8.2 大枣多糖的PMP衍生化HPLC分析(梯度洗脱) 混合标准单糖及大枣多糖水解衍生液的梯度洗脱色谱图如图2所示。由图可见,大枣多糖的单糖组成包括 Man、Rha、GalUA、Glc、Gal和 Ara 等 6种单糖,在18 min内均达到基线分离,按文献方法[11]计算得到的单糖摩尔比为 0.53∶0.50∶0.27∶2.01∶5.36∶1.00。
两种洗脱方式测定结果基本一致。

图2 混合标准单糖(A)及大枣多糖水解衍生液(B)的色谱分离图(梯度洗脱)Fig.2 HPLC separation of standard monosaccharides(A)and the derivatives of jujube polysaccharide hydrolysates(B)(gradient elution)
3 讨论
本文直接将单糖样品溶于NaOH溶液,衍生之前按照一定的配比移取一定量的糖的NaOH溶液进行衍生,简化了操作步骤。但是糖的NaOH溶液如在常温下放置,隔夜后衍生产物峰面积会有变小趋势,有时会有杂峰出现。实验中发现Ara的NaOH溶液常温放置24 h后,衍生产物峰面积减小并且在保留时间6.8 min左右出现一个杂峰,可能是糖的醛基在碱性条件下容易氧化而导致了异构反应的发生,而在低温4℃保存3 d后峰面积依然没有明显改变且未见杂峰出现。所以该糖的NaOH溶液要低温密闭保存。
本实验将大枣多糖水解液用NaOH溶液中和(pH约为7.0)后直接进行PMP衍生化,由于PMP残留试剂出峰时间明显超前于单糖衍生物,因此省去了多糖水解样品及其衍生化产物的干燥过程,衍生化后的溶液用氯仿萃取后即可直接进样分析,对测定结果无影响,从而简化了操作步骤。
本实验采用HPLC法,以等度与梯度洗脱两种方式对大枣多糖的单糖组分及摩尔比进行了测定,并对等度洗脱模式进行了方法学考察。两种洗脱方式测定结果基本一致,但改进后的等度洗脱方法更加简便易行,短时间内即可达到单糖组分的有效分离,为大枣多糖及各种多糖类物质的组分分析提供了一个新途径。
[1]原 超,范三红,林勤保.红枣的功效成分[J].农产品加工,2010(9):12-13.
[2]Wang B.Chemical characterization and Ameliorating effect of polysaccharide from Chinese jujube on intestine oxidative injury by ischemia and reperfusion[J].Int J Biol Macromol,2011,48(3):386-391.
[3]Li JW,Shan L,Liu Y F,et al.Screening of a functional polysaccharide from Zizyphus Jujuba cv.Jinsixiaozao and its property[J].Int JBiol Macromol,2011,49(3):255-259.
[4]罗 莉,玉崧成,王金水.大枣多糖结构及药理活性的研究进展[J].安徽农业科学,2010,38(30):16860-16861.
[5]吴建元,肖玉玲,孙曼春,等.柱前衍生化高效液相色谱法分析茯苓多糖的单糖组成[J].医药导报,2009,28(9):1213-1214.
[6]蒋水星,陈雪峰,赵天殊.响应面法优化大枣多糖的提取工艺研究[J].安徽农业科学,2011,39(6):3652-3654.
[7]李 培,杨 洁,朱敖兰,等.若羌红枣多糖提取方法的研究[J].生物技术,2008,18(1):70-73.
[8]吴海玥.红枣多糖沉淀特性及脱蛋白质工艺研究[J].食品与药品,2008,10(3):21-23.
[9]林 雪,贾敬芬,黄琳娟,等.RP-HPLC用于芦荟多糖的单糖组成研究[J].食品科学,2006,27(4):192-195.
[10]姚瑞祺,刘海英,牛鹏飞,等.超声辅助提取大枣多糖及柱前衍生高效液相分析[J].西北农林科技大学学报,2007,35(12):162-166.
[11]马定远,陈 君,李 萍,等.柱前衍生化高效液相色谱法分析多糖中的单糖组成[J].分析化学,2002,30(6):702-705.
Determination of monosaccharide components of Huanghe jujube polysaccharides by pre-column derivatization HPLC method
HAO Lei-lei,ZHANG Dian-rui,ZHAO Zhong-xi,LIU Yan
(School of Pharmaceutical Sciences and Center for Pharmaceutical Research & Drug Delivery Systems,Shandong University,Jinan 250012,China)
Purpose To establish PMP pre-column derivatization HPLC method for determination of monosaccharide components of Huanghe jujube polysaccharides.Methods The polysaccharides of Huanghe jujube were extracted with water,precipitated by ethanol and then the monosaccharides were derivated with PMPafter hydrolyzed.HPLC method was used to study the monosaccharide components and molar ratio of Huanghe jujube polysaccharides,and the two patterns of isocratic elution and gradient elution were compared and analyzed.Results Huanghe jujube polysaccharides were composed of D-mannose,L-rhamnose,D-galacturonic acid,D-glucose,D-galactose,and L-arabinose and their molar ratio was about 0.54∶0.50∶0.27∶2.03∶5.40∶1.00,with almost the same results of isocratic elution and gradient elution.Conclusion The isocratic elution method used in this experiment is more simple,quick and accurate and can be used to analyze the monosaccharide components of Huanghe jujube polysaccharides.
Huanghe jujube polysaccharides;monosaccharide compositions;PMPpre-column derivatization;HPLC
R284
A
1005-1678(2012)06-0740-04
2011-12-22
国家重点基础研究发展计划(项目编号:2012CB126315)
郝蕾蕾,女,硕士研究生,Tel:0531-88380293;张典瑞,通信作者,教授,博士生导师,Tel:0531-88382015,E-mail:zhangdianrui2006@163.com。

