现代海底热液场低温弥散流区微生物生态的研究进展*
李季伟,周怀阳,彭晓彤,陈智强,孙治雷,李江涛,陈 顺,章力学
(1.西南交通大学 地球科学与环境工程学院,四川 成都610031;2.中国科学院 广州地球化学研究所,广东 广州510640;3.同济大学 海洋地质国家重点实验室,上海200092)
现代海底热液场低温弥散流区微生物生态的研究进展*
李季伟1,2,周怀阳3,彭晓彤3,陈智强2,孙治雷2,李江涛3,陈 顺3,章力学3
(1.西南交通大学 地球科学与环境工程学院,四川 成都610031;2.中国科学院 广州地球化学研究所,广东 广州510640;3.同济大学 海洋地质国家重点实验室,上海200092)
现代海底低温热液弥散流区微生物生态的发育情况已经成为当前热液系统研究关注的热点之一。大量的分析表明在低温热液弥散流区赋存着丰富的化能自养微生物,以硫、铁等元素的氧化还原反应获取新陈代谢能量,这些微生物的分布与低温热液流体的物理化学条件有着密切的联系。这些发现极大地丰富了我们对低温弥散流区微生物生态、关键地球化学过程与微生物新陈代谢耦合关系的认识。此外,低温热液流体是研究洋壳深部生物圈的窗口,通过这个窗口可以了解地壳内部生命的新陈代谢方式,进而理解地球内部微生物与洋壳内部流体、岩石之间的相互作用机制。
低温热液弥散流;微生物生态;化能自养微生物;深部生物圈
(陈 靖 编辑)
20世纪70年代后期,科学家在东太平洋洋隆(EPR)和加拉帕戈斯扩张中心发现了一种低温热液从玄武质基岩的裂隙中弥散溢出,在这些弥散流的溢出点周围发育着大量的与硫氧化菌共生的管状蠕虫和双壳贝类热液生物群落[1]。此后的几十年来,大量的现代海底热液活动相继被报道,而在这些海底热液场中,大范围的低温弥散流区域总是同时伴随着高温集中流出现[2-4]。这些热液环境中发育的生态群落与地球上其它以光合作用为基础的生态群落有所不同,它们是以化能合成的自养微生物为基础。这些微生物通过氧化热液流体中的还原性物质(CH4,H2,H2S,Fe2+和 Mn2+等),从而获取新陈代谢的能量[5-7]。研究者采用比较测量等手段对热液场进行详尽地分析后发现,低温弥散流的化学通量比高温集中流大[8],热通量也是高温集中流的几倍以上[9-10]。因此,低温热液对于依靠流体中的化学物质生长与繁衍的热液生态群落具有更重要的意义。然而相对高温热液喷口大量的微生物学研究,人们对低温热液弥散流的关注程度仍非常低[11-12]。近年来,随着对热液系统的研究深入,人们逐渐认识到低温热液对海洋热通量和化学通量的贡献,以及对生命起源和深部生物圈探索的意义,对低温热液弥散流的微生物研究也重视起来[13-17]。本研究综述了近年来低温热液弥散流区域微生物生态的研究进展,以及这些研究对深部生物圈探索的启示。
1 海底低温热液弥散流的形成机制与化学组成
研究低温弥散流的形成机制与热液地球化学环境参数的变化,对于理解低温弥散流区域微生物多样性与变化具有重要意义。研究者结合目前已经发现的低温热液弥散流热液场的数据,提出了低温热液流体的3种形成机制:1)高温热液相分离的流体与洋壳中海水相互混合而被稀释[11-12];2)高温热液流体在浅层地壳中的传导性冷却;3)高温流体、海水和被改造的海水的3组分相混合[18]。这3种机制中由第一种占据主导地位,共同控制现代海底热液弥散流的形成[19]。
海底低温热液弥散流体的化学组成复杂,通常富含CO2,CH4,H2,H2S和Si在一些样品中也富含Fe2+,Mn2+[4,20-24](表1)。它们的组成在时间和空间上是高度变化的[5,17,25-27],即使在同一个热液区域,如东北太平洋形成的低温热液流体,其热液化学成分的变化也很大(表1)。这种多变性是由热液终端端元流体的时空变化所控制,并受到深海底部的热液流体稀释强度的影响[2,5,25,28];另外,海底深部传导性热交换、沉淀过程、火山活动、潮汐作用以及微生物改造等也是影响化学成分多变性的重要因素[17]。总之,低温热液流体中化学组分多变,富含丰富的还原性物质,正是这些还原性物质所引起的氧化还原放能反应为海底热液生态系统的繁衍提供了充足的物质基础。
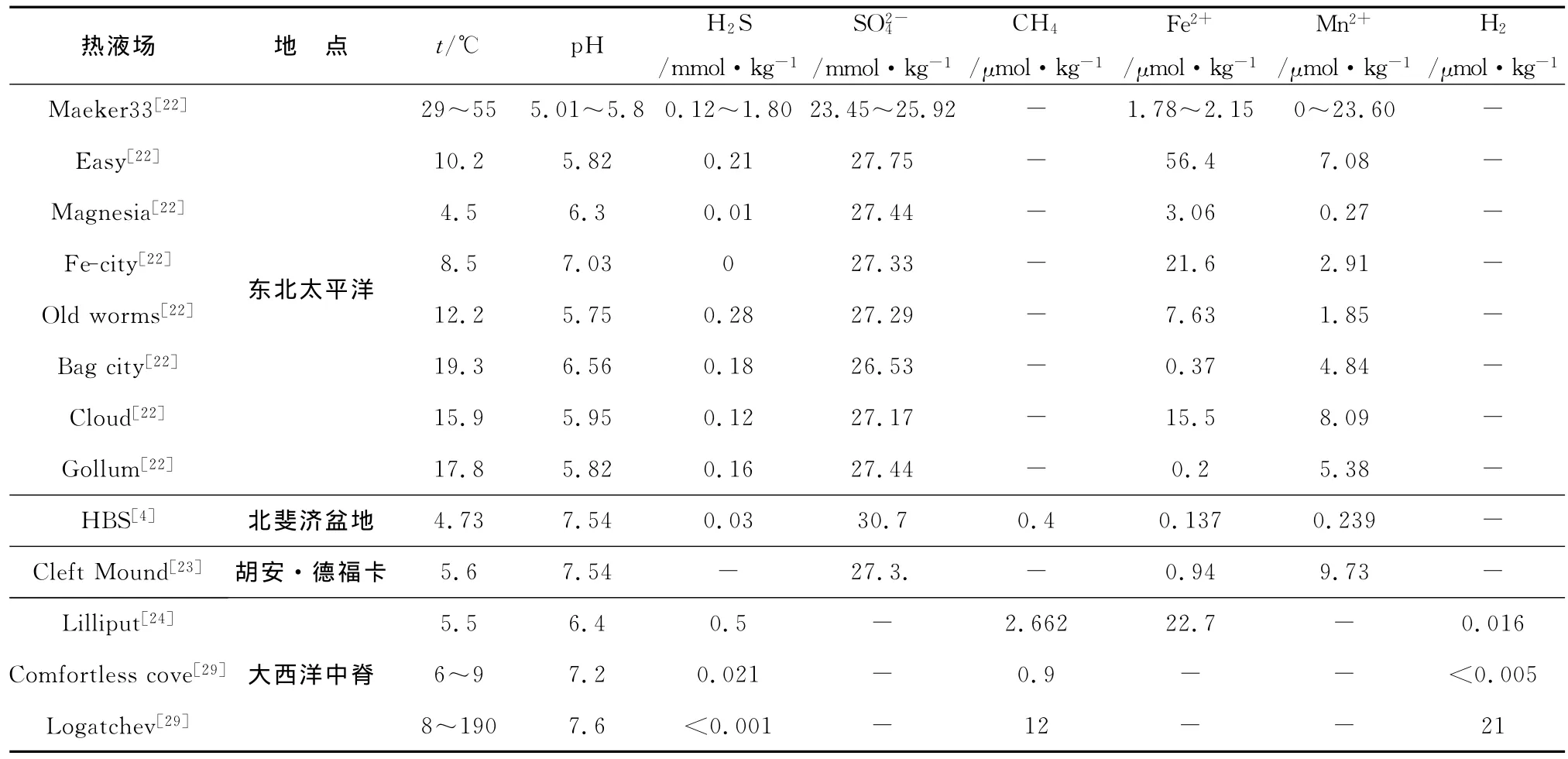
表1 热液低温弥散流的流体化学组成Table 1 Chemical compositions of the low-temperature hydrothermal diffuse flow
2 海底低温热液弥散流区微生物生态的研究进展
目前,对现代海底低温热液弥散流区微生物学的研究手段主要为传统的富集分离培养和非培养技术[30];特别是基于16SrRNA基因和特征性功能基因的系统发育分析等现代分子生物学技术的发展,加快了对现代热液系统微生物研究的步伐。目前在大多数已发现的低温热液区域都有关于热液微生物的研究报道,包括胡安·德福卡洋脊[13,15,31],大西洋中脊[24],有机质丰富的 Guaymas盆地[32],冲绳海槽[33],马里亚纳扩展盆地[34]和深海海山[22,35]等。研究结果表明,在这些低温弥散流热液场内的微生物具有一些共同的生态学特征:微生物生物量大、种类丰富、覆盖广。其中已发现的微生物种类包括α,β,γ,ε,ζ和δ变形杆菌,酸杆菌门(Acidobacteria)、产水菌目(Aquificales)、拟杆菌门(Bacteroidetes)、壁厚菌门(Firmicutes)、浮霉状菌(Planctomycetes)、各种Candidate Divisions细菌、嗜热球菌(Thermococcus)、甲烷球菌(Methanococcus)和其他一些嗜热和超嗜热古菌等[15,31-32,34,36-39]。在这些丰富的微生物类型中,化能合成自养微生物是海底热液系统中生命新陈代谢的初级能量制造者,它们的存在是热液生物群落繁衍的基础。这些化能合成反应包括了硫氧化、铁氧化、氢氧化、甲烷氧化和硫酸盐还原等,其中硫氧化与铁氧化反应最为重要,与之相关的微生物在低温热液场中的发现也最为频繁(表2)。

表2 低温热液弥散流区的微生物生态研究成果Table 2Results from the studies of microbial ecology in the low-temperature hydrothermal diffuse flow areas
2.1 硫氧化微生物
与硫氧化相关的新陈代谢反应是低温热液环境中微生物获取能量的重要途径。与周围背景环境相比,低温热液弥散流中H2S的浓度相对周围海水呈数量级倍数增加[22],这些含硫化合物的存在为化能合成自养微生物提供了新陈代谢反应所需的电子供体[42]。目前在低温热液系统中发现的硫氧化微生物主要属于ε、γ和α变形杆菌。
ε变形杆菌的生理机能多样,能在高温条件下以硫元素的化学反应进行自养或异养活动[43],其中的一些类群是典型的从硫或硫代硫酸盐氧化反应过程中获取能量的微生物,如Sulfurovumlithotrophica,Sulfurimonas,Thiovulumspp.和弓形杆菌Arcobacterspp.等。ε变形杆菌在热液环境中广泛存在,包括流体、微生物菌席或与热液大型生物共生[36,44-47]。Opatkiewicz等[43]在胡安·德福卡洋脊Axial海山上的低温热液场中就发现了丰富的ε变形杆菌,并指出它们的分布与流体中氢、硫和铁等元素的浓度有关。Rassa等[35]在夏威夷Loihi海山上的低温热液场中不同温度梯度的弥散流处放置了41个原位生长微腔体(microbial growth chambers)。经过短期(4~10d)和长期(1~6a)的观测,发现在中间温度(51℃)的弥散流处ε变形杆菌是微生物群落的主要组成之一,而在温度较高处(71℃)其占据更主导的地位。此外,Perner等[24]在大西洋中脊最南部(9°S)的Lilliput低温热液场中也发现了大量的ε变形杆菌,有长杆、丝缕、短杆和球状等多样形态结构。
除了ε变形杆菌外,γ变形杆菌中的Thiomicrospiraspp.也是热液环境中常见的硫氧化菌。如在Lilliput低温热液场,γ变形杆菌中的Thiomicrospiraspp.与ε变形杆菌一样占据优势地位[24]。Podgorsek等[40]在斐济盆地北部的富H2S的低温弥散流热液场中也分离获得大量α和γ变形杆菌中的自养或兼养硫氧化细菌。
2.2 铁氧化微生物
铁既可以作为化能自养的电子供体也可以作为厌氧呼吸的电子受体[48]。低温热液弥散流体中富含的还原性铁为铁氧化的自养微生物提供了丰富的能量,因此在富铁的海底热液低温弥散流区域内发现了铁氧化菌的广泛分布。目前在热液场中已经发现的铁氧化微生物包括α、β和γ变形杆菌,如赭色纤毛菌Leptothrixochracea,含铁嘉氏铁柄杆菌Galliionellaferruginea,Gallionellacapsiferriformans,Sideroxydans lithotrophicus等[49-51],以及最近发现的ζ变形杆菌[52]。
Mariprofundusferrooxydans是从Loihi海山上富铁菌席中分离获得(图1a),它是1种嗜中性的化能自养铁氧化菌,以二氧化碳为碳源,能从二价铁转变成三价铁的氧化反应中获取新陈代谢的能量[52-53]。通过对纯培养微生物M.ferrooxydans的分类鉴定结果进行评估,人们将其划归为变形杆菌门下一个新的亚类-ζ变形杆菌。
ζ变形杆菌在低温热液流体及其沉积物中的发现具有重要意义。因为从20世纪80年代开始,在现代和古代的热液矿物中发现了大量的茎状铁氧化物[54],当时科学家从形态学上推测这是1种生物成因的铁氧化物,但却缺乏有力的生物学证据。而最近的研究发现,M.ferrooxydans在生长过程中能够产生结构相似的铁氧化物(图1b)[53],当其死亡后铁氧化物并能在其表面保存下来(图1c)[53,55]。因而,ζ变形杆菌的发现为茎状铁氧化物的生物成因推论提供了有力的支持。
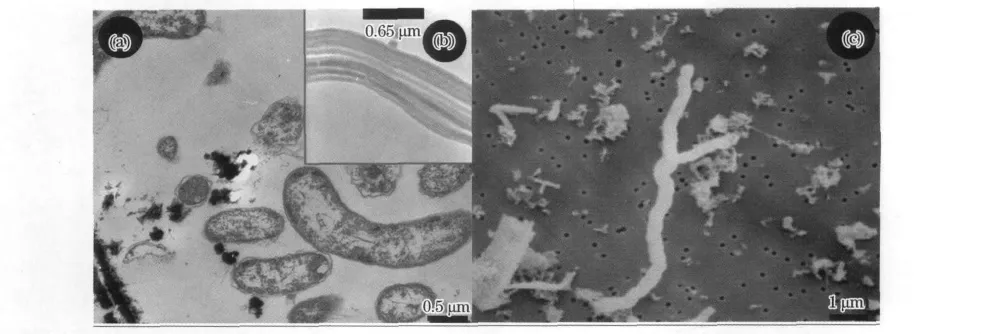
图1 Mariprofundusferrooxydans的形态Fig.1 Morphology of Mariprofundusferrooxydans
人们最初认为ζ变形杆菌在自然界中的分布比较少,而随着进一步调查后发现它们其实广泛分布于一些富铁的低温热液场中。例如,在Tonga Arc海山上发现了一些富铁低温弥散流(30~70℃,Volcano 1),其流体形成的主要矿物是二峰水铁矿(two-line ferrihydrite)。透射电镜显示,这些铁氧化物的形态与M.ferrooxydans形成的构型非常一致[56],随后的分子生物学的研究结果也证实了在Volcano 1处分布了大量的ζ变形杆菌[41]。此外,Davis等[23]在胡安·德福卡洋脊Cleft段低温弥散流场中所采集的沉积物柱也发现大量的ζ变形杆菌。而在马里亚纳盆地的低温热液弥散流区的微生物菌席中,荧光定量PCR的结果表明,它们更是占到了原核细胞总数的22%[34]。关于低温弥散流中发现ζ变形杆菌的报道还有很多,如马尼亚纳岛弧中的Eifuku海山和夏威夷Loihi海山[35]等。
虽然对ζ变形杆菌发现的报道越来越多,然而目前对它们的研究尚属起步阶段,上述研究也表明,M.ferrooxydans只是ζ变形杆菌中一个较小的分支,仅凭一株可培养的M.ferrooxydans还不能将ζ变形杆菌的所有功能研究清楚。因此,还需要开展大量的ζ变形杆菌的适应性培养工作,深入探索它们的生理化学特征。
2.3 氢氧化微生物
在超基性基岩上发育的海底低温热液弥散流体中通常富含H2,H2在氧化过程中能释放大量的能量,这就为以H2的氧化反应获取能量的微生物提供了存在的基础。微生物消耗或产生氢气是由氢化酶所催化,氢化酶包括3种,分别为[NiFe]-氢化酶、[FeFe]-氢化酶和[Fe]-氢化酶,它们之间并没有分子进化上的联系[29,57]。Perner等[29]对大西洋中脊不同基底上发育的低温热液场进行了对比,研究对象包括Comfortless Cove热液场中的Clueless低温弥散流喷口(玄武质基底)和Logatchev热液场中的Quest弥散流喷口(超基性岩基底)。结果表明,以玄武质为基底的Clueless低温热液流体中H2浓度很低,且氢化酶基因仅有2种;而以超基性岩为基底的Quest低温热液流体中H2浓度非常高,相应的氢化酶基因也非常丰富。这一研究结果同时表明在海底低温热液场中影响氢氧化微生物分布的重要因素是水体中H2和O2的浓度的大小[29]。目前在低温热液区域发现的氢氧化微生物有产水菌目(Aquificales),Dehalococcoidales,Desulfurococcale和ε变形杆菌中的一些下属菌种微生物,以及利用H2和CO2产甲烷的甲烷球菌目Methanococcales等[29,58-60]。
2.4 其他新陈代谢途径的微生物
除硫氧化、铁氧化和氢氧化等化能自养微生物的频繁出现外,在低温热液喷口微生物系统中,甲烷氧化菌、产甲烷古菌、氨氧化古菌和硫酸盐还原菌也是不可忽略的组成部分,它们通过自养或异氧方式进行生命活动。前人利用甲烷氧化(pmoA)、氨氧化(amoA)和硫酸盐还原(dsrAB)等功能基因已经对这些微生物在热液环境中的分布进行了研究。Nercessian等[61]对东太平洋洋隆13°N和大西洋中脊Rainbow热液场的低温流体、沉积物进行了分析,通过功能基因发现了大量的甲烷氧化、产甲烷与硫酸盐还原微生物的存在,包括超嗜热的Methanopyrales和甲烷暖球菌科(Methanocaldococcaceae)、嗜热和喜温的甲烷球菌科(Methanococcaceae),嗜热的甲基热菌属(Methylothermus)和喜温的I型甲烷氧化菌,和超嗜热的古烷菌目(Archaeoglobales)、嗜热的热脱硫杆菌目(Thermodesulfobacteriales)和喜温的脱硫叶菌科(Desulfobulbaceae)。
3 海底低温热液弥散流体所揭示的深部生物圈
低温热液流体研究的一个重要意义在于其环境是研究地球深部生物圈的窗口[62]。Gold[63]认为嗜热与超嗜热微生物占据了地壳的部分区域,其生物量很可能超过地表生物的总和。因为海底上部500m以内的洋壳中孔隙度较高,热液流体与海水在其中能够轻易运移而循环,这种循环能引起化学梯度的变化,其为一些极端微生物在洋壳深部中的生存提供了良好的物质基础和环境。在纽芬兰岛边缘的ODP210钻探结果显示微生物存在的深度甚至可以延伸至1 600多m[64]。由于样品采集的限制,直接导致对洋壳内部的研究非常困难,所以,通过低温热液流体的研究来探测洋壳深部生物圈就显得弥足珍贵[13,15,31]。通过对流体中地球化学参数的分析,可以有效地了解微生物在深部生物圈中的生物地球化学作用,如O2,S2-,NO-3,SO2-4和H2的消耗,NH+4和CH4的产生都是微生物在热液流体中作用的标志[16-17,25,65-66]。例如,在东太平洋9°50′N和Suiyo海山的热液场中,通过对低温热液流体与高温热液流体中的甲烷与二氧化碳同位素的分馏证明了深海底部存在着产甲烷与甲烷消耗的微生物活动的存在[19,27]。通过培养和非培养手段对低温热液流体中微生物进行研究,能更直接反映深部微生物的分布状态和新陈代谢方式。例如,Holden等[13]在胡安·德福卡洋脊CoAxial低温热弥散流体(15~30℃)中分离出了一些最佳生长温度为55~60℃的嗜热和超嗜热微生物;在排除了这些微生物来自周围高温流体的微生物污染这个可能后,研究人员指出它们应当来源于环境温度更适合其生存的洋壳深部。另外,Kato等[67]研究了马里亚纳南部热液场中采用钻孔所取得的低温洋壳流体(2~69℃),表明在这些流体中存在大量的细菌和古菌,其中Thiomicrospira和ζ变形杆菌占优势地位,ζ变形杆菌的细胞数量占原核细胞总数的32%。这些对低温热液流体的研究结果证明了洋壳深部生物圈的存在,其新陈代谢的能量主要来源于甲烷、铁的氧化和硫的氧化与还原。
Huber等[15]通过对东北太平洋Axial海山的低温热液场(Marker33)中流体微生物多样性的长期跟踪,基于前人对该区域地质和化学的报道,提出了洋壳深部生物圈的微生物种群与热液化学过程的理想模式(图2)[15]。根据热液与海水两端元的混合模式,将洋壳上部深部生物圈内划分成3个层位:1)上层,以海水为主,混入了少量的热液。海水为这一层中的微生物提供了足够的碳源、能量和电子受体,其优势群体为喜温的硫、铁或甲烷的氧化者,如ε,ζ,β和γ变形杆菌等;2)最下面的深部层为厌氧、温度高于50℃的环境,以热液流体为主,并混入少量的海水。这个区域为一些喜温嗜热的硫还原菌和利用热成因有机质的嗜热古菌提供了适合的生存环境,如脱硫杆菌属(Desulfurobacterium)和热球菌目(Thermococcales)[13,22,64];3)中间层是化学梯度变化最大的氧化还原层,热液流体和海水在此能够充分混合,提供了从无氧到有氧,中温到高温的各种微环境。该层中主要发育一些厌氧嗜温的产甲烷生物,如甲烷球菌目(Methanococcales)或一些新发现的细菌,如Candidate Division ABY1和 WS6以及一些需氧或微需氧的硫、铁与甲烷氧化细菌,如ε和γ变形杆菌[15]。
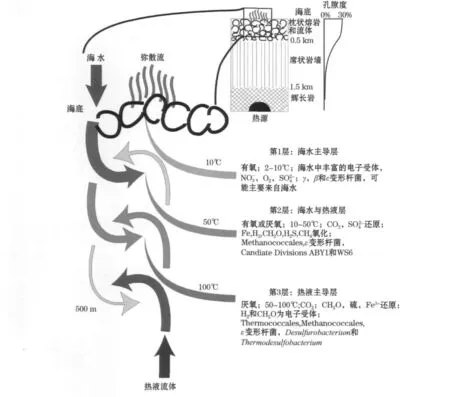
图2 低温弥散流微生物生态研究所启示的深部生物圈分布图Fig.2 Diagram of the deep biosphere indicated by the microbial community occurring in the low temperature diffuse flow area
4 结 语
海底热液系统是现代海洋科学研究的热点,近年来,该系统中的低温热液弥散流受到越来越多的关注。通过对低温弥散流区域微生物学的研究,我们逐步了解低温弥散流区域的微生物生态学特征及化能合成自养微生物,尤其是铁氧化和硫氧化相关的化能自养微生物在低温热液区域的分布规律,充分认识到这些自养微生物在热液生态系统中的支柱作用,并肯定了地球化学因素对微生物生态分布的制约。对低温热液流体中的微生物研究,也为我们得以窥探深部生物圈,进一步揭示地壳深部微生物的新陈代谢机理,从而了解其生命演化与发展奠定了基础。
然而,目前国内外在这方面所开展的研究工作还有一定的局限性,包括样品的采集、原位地球化学参数的分析以及生物学手段自身的缺陷,都会对当前的研究结果造成影响。其局限性主要表现为:首先,由于DNA在常温条件下容易降解,这就为样品的保存和及时分析提出了严格的要求。但受到船载实验设备的限制,样品在船上不能立即展开分析,只能采取室内分析,而且从采集、存储、运输和室内分析这一过程往往需要花费较长的时间,这就在一定程度上导致了样品中微生物量的失真和群落结构的细微变化。其次,原位流体化学数据缺失严重。原位流体化学数据能够有效反映原位沉积环境的信息,但是目前的采样手段主要是电视抓斗和海底拖网,这些采样设备在起样的过程中会导致背景海水与原位流体大量的混合,从而造成原位流体数据失真。因此,这就需要科学与技术的完美结合,进一步完善海底热液研究的技术手段,如我国正大力发展的载人深潜器和海底观测网的建设。这些技术手段的实现将对海底低温热液场原位数据的准确测量和连续观测提供有力的保障。另外,基因芯片的应用可以全面而翔实地获取原位环境中微生物新陈代谢途径的信息,而针对低温热液,目前世界上还未展开类似的工作。这些新的采样、测量和分析技术的运用,将进一步揭示低温热液区微生物与地球化学的相互耦合、生物矿化机制、微生物对洋壳的改造、深部生物圈的演化以及生命起源等重大科学问题的答案。
(References):
[1]HESSLER R R,KAHARL V A.The deep-sea hydrothermal vent community:an overview[M]∥HUMPHRIS S E,ZIERENBERG R A,MULLINEAUX L S,et al.Seafloor hydrothermal systems:physical,chemical,biological and geological interactions.Washington D C:American Geophysical Union,1995:72-84.
[2]VON DAMM K L.Temporal and compositional diversity in seafloor hydrothermal fluids[J].Reviews of Geophysics,1995,33(Suppl.1):1297-1306.
[3]LOWELL R P,RONA P A,VON HERZED R P.Seafloor hydrothermal systems[J].J.Geophys.Res.,1995,100(B1):327-352.
[4]KOSCHINSKY A,SEIFERT R,HALBACH P,et al.Geochemistry of diffuse low-temperature hydrothermal fluids in the North Fiji basin[J].Geochim.Cosmochim.Acta,2002,66(8):1409-1427.
[5]JOHNSON K S,CHILDRESS J J,HESSLER R R,et al.Chemical and biological interactions in the Rose Garden hydrothermal vent field,Galapagos spreading center[J].Deep-Sea Res.,1988,35(10-11):1723-1744.
[6]ELDERFIELD H,SCHULTZ A.Mid-ocean ridge hydrothermal fluxes and the chemical composition of the ocean[J].Ann.Rev.Earth Planet.Sci.,1996,24:191-224.
[7]SCHULTZ A,ELDERFIELD H.Controls on the physics and chemistry of seafloor hydrothermal circulation[M]∥CANN J R,ELDERFIELD H,LANGHTON A.Mid-ocean ridges:dynamics of processes associated with creation of new ocean crust.Cambridge:Cambridge University Press,1999:171-209.
[8]DE VILLIERS S,NELSON B K.Detection of low-temperature hydrothermal fluxes by seawater Mg and Ca anomalies[J].Science,1999,285(5248):721-723.
[9]RONA P A,TRIVETT D A.Discrete and diffuse heat transfer at ASHES vent field,Axial Volcano,Juan de Fuca Ridge[J].Earth Planet.Sci.Lett.,1992,109(1-2):57-71.
[10]ELDERFIELD H,MILLS R A,RUDNICKI M D.Geochemical and thermal fluxes,high-temperature venting and diffuse flow from mid-ocean ridge hydrothermal systems:the TAG hydrothermal field,mid-Atlantic ridge 26degrees N [J].Geol.Soc.London,Spec.Pub.,1993,76:295-307.
[11]BUTTERFIELD D A,MASSOTH G J.Geochemistry of north cleft segment vent fluids:temporal changes in chlorinity and their possible relation to recent volcanism [J].J.Geophys.Res.,1994,99(B3):4951-4968.
[12]BUTTERFIELD D A,JONASSON I R,MASSOTH G J,et al.Seafloor eruptions and evolution of hydrothermal fluid chemistry[M]∥CANN J R,ELDERFIELD H,LAUGHEON A.Mid-ocean ridges:dynamics of processes associated with creation of new ocean crust.Cambridge:Cambridge University Press,1999.
[13]HOLDEN J F,SUMMIT M,BAROSS J A.Thermophilic and hyperthermophilic microorganisms in 3-30℃hydrothermal fluids following a deep-sea volcanic eruption[J].FEMS Microbiol.Ecol.,1998,25(1):33-41.
[14]COOPER M J,ELDERFIELD H,SCHULTZ A.Diffuse hydrothermal fluids from Lucky Strike hydrothermal field:evidence for a shallow conductively heated system [J].J.Geophys.Res.,2000,105(B8):19369-19375.
[15]HUBER J A,BUTTERFIELD D A,BAROSS J A.Bacterial diversity in a subseafloor habitat following a deep-sea volcanic eruption[J].FEMS Microbiol.Ecol.,2003,43(3):393-409.
[16]BUTTERFIELD D A,ROE K K,LILLEY M D,et al.Mixing,reaction,and microbial activity in the subseafloor revealed by temporal and spatial variation in diffuse flow vents at Axial Volcano[M]∥WILCOCK W S D,DELONG E F,KELLEY D S,et al.The subseafloor biosphere at mid-ocean ridges.Washington D C:American Geophysical Union,2004,144:269-289.
[17]LILLEY M D.VON DAMM K L.Diffuse flow hydrothermal fluids from 9°50′N,East Pacific Rise:origin,evolution and biogeochemical controls[M]∥WILCOCK W S D,DELONG E F,KELLEY D S,et al.The Subseafloor Biosphere at mid-ocean ridges,Washington D C:American Geophysical Union,2004,144.
[18]RAVIZZA G,BLUSZTAJN J,VON DAMM K L,et al.Sr isotope variations in vent fluids from 9°46′-9°54′N East Pacific Rise;evidence of a non-zero-Mg fluid component[J].Geochimica et Cosmochimica Acta,2001,65(5):729-739.
[19]PROSKUROWSKI G,LILLEY M D,OLSON E J.Stable isotopic evidence in support of active microbial methane cycling in low-temperature diffuse flow vents at 9°50′N East Pacific Rise[J].Geochimica et Cosmochimica Acta,2008,72(8):2005-2023.
[20]HALBACH P,KOSCHINSKY A,SEIFERT R,et al.Diffuse hydrothermal fluid activity,biological communities,and mineral formation in the North Fiji Basin(SW Pacific):preliminary results of the R/V sonne cruise SO-134[J].InterRidge News,1999,8:38-47.
[21]LILLEY M D,OLSON E J,LAUGHLIN E M.Methane,hydrogen and carbon dioxide in vent fluids from the 9°N hydrothermal system[J].Eos.Trans.,1991,72:481.
[22]HUBER J A,BUTTERFIELD D A,BAROSS J A.Diversity and distribution of subseafloor Thermococcales populations in diffuse hydrothermal vents at an active deep-sea volcano in the northeast Pacific Ocean[J].J.Geophys.Res.,2006,111,G04016,doi:10.1029/2005JG000097.
[23]DAVIS R E,STAKES D S,WHEAT C G,et al.Bacterial variability within an Iron-Silica-Manganese-rich hydrothermal mound located Off-axis at the cleft segment,Juan de Fuca Ridge[J].Geomicrobiology Journal,2009,26(8):570-580.
[24]PERNER M,SEIFERT R,WEBER S,et al.Microbial CO2fixation and sulfur cycling associated with low-temperature emissions at the Lilliput hydrothermal field,southern Mid-Atlantic Ridge(9°S)[J].Environ.Microbiol.,2007,9(5):1186-1201.
[25]EDMOND J M,MEASURES C,MCDUFF R E,et al.Ridge crest hydrothermal activity and the balances of the major and minor elements in the ocean:The Galapagos data[J].Earth Planet.Sci.Lett.,1979,46(1):1-18.
[26]SHANK T M,FORNARI D J,VON DAMM K L,et al.Temporal and spatial patterns of biological community development at nascent deep-sea hydrothermal vents(9°50′N,East Pacific Rise)[J].Deep Sea Res.:Part I,1998,45(1-3):465-515.
[27]TOKI T,TSUNOGAI U,ISHIBASHI J,et al.Methane enrichment in low-temperature hydrothermal fluids from the Suiyo Seamount in the Izu-Bonin Arc of the western Pacific Ocean[J].J.Geophys.Res.,2008,113,B08S13,doi:10.1029/2007JB005476.
[28]VON DAMM K L,OOSTING S E,KOZLOWSKI R,et al.Evolution of East Pacific Rise hydrothermal vent fluids following a volcanic eruption[J].Nature,1995,375:47-50.
[29]PERNER M,PETERSEN J M,ZIELINSKI F,et al.Geochemical constraints on the diversity and activity of H2-oxidizing microorganisms in diffuse hydrothermal fluids from a basalt-and an ultramafic-hosted vent[J].FEMS Microbiology Ecology,2010,74(1):55-71.
[30]AMANN R I,LUDWIG W,SCHLEIFER K H.Phylogenetic identification and in situ detection of individual microbial cells without cultivation[J].Microbiol.Rev.,1995,59:143-169.
[31]HUBER J A,BUTTERFIELD D A,BAROSS J A.Temporal changes in Archaeal diversity and chemistry in a mid-ocean ridge subseafloor habitat[J].Appl.Environ.Microbiol.,2002,68(4):1585-1594.
[32]TESKE A,HINRICHS K-U,EDGCOMB V,et al.Microbial diversity of hydrothermal sediments in the Guaymas Basin:evidence for anaerobic methanotrophic communities[J].Appl.Environ.Microbiol.,2002,68(4):1994-2007.
[33]PERNER M,BACH W,HENTSCHER M,et al.Short-term microbial and physico-chemical variability in low temperature hydrothermal fluids near 5Son the Mid-Atlantic Ridge[J].Environ.Microbiol.,2009,11(10):2526-2541.
[34]KATO S,KOBAYASHI C,KAKEGAWA T,et al.Microbial communities in iron-silica-rich microbial mats at deep-sea hydrothermal fields of the southern Mariana Trough[J].Environ.Microbiol.,2009a,11(8):2094-2111.
[35]RASSA A C,MCALLISTER S M,SAFRAN S A,et al.Zeta-Proteobacteria dominates the colonization and formation of microbial mats in low-temperature hydrothermal vents at Loihi Seamount,Hawaii[J].Geomicrobiology Journal,2009,26(8):623-638.
[36]LPEZ-GARCÍA P,DUPERRON S,PHILIPPOT P,et al.Bacterial diversity in hydrothermal sediment and epsilonproteobacterial dominance in experimental microcolonizers at the Mid-Atlantic Ridge[J].Environ.Microbiol.,2003,5(10):961-976.
[37]ALAIN K,OLAGNON M,DESBRUYERES D,et al.Phylogenetic characterization of the bacterial assemblage associated with mucous secretions of the hydrothermal vent polychaete Paralvinella palmiformis[J].FEMS Microbiol.Ecol.,2002,42(3):463-476.
[38]GOFFREDI S K,WAREN A,ORPHAN V J,et al.Novel forms of structural integration between microbes and a hydrothermal vent gastropod from the Indian Ocean[J].Appl.Environ.Microbiol.,2004,70(5):3082-3090.
[39]PAGE A,JUNIPER S K,OLAGNON M,et al.Microbial diversity associated with a Paralvinella sulfincola tube and the adjacent sub-stratum on an active deep-sea vent chimney[J].Geobiol.,2004,2(4):225-238.
[40]PODGORSEK L,PETRI R,IMHOFF J.Cultured and genetic diversity,and activities of sulfur-oxidizing bacteria in low-temperature hydrothermal fluids of the North Fiji basin[J].Mar.Ecol.Prog.Ser,2004,266:65-76.
[41]FORGET N L,MURDOCK S A,JUNIPER S K.Bacterial diversity in Fe-rich hydrothermal sediments at two South Tonga Arc submarine volcanoes[J].Geobiology,2010,8(5):417-432.
[42]LEVIN L A,MICHENER,R H.Isotopic evidence for chemosynthesis-based nutrition of macrobenthos:the lightness of being at Pacific methane seeps[J].Limnology and Oceanography,2002,47(5):1336-1345.
[43]OPATKIEWICZ A D,BUTTERFIELD D A,BAROSS J A.Individual hydrothermal vents at Axial Seamount harbor distinct subseafloor microbial communities[J].FEMS Microbiology Ecology,2009,70(3):413-424.
[44]MOYER C L,DOBBS F C,KARL D M.Phylogenetic diversity of the bacterial community from a microbial mat at an active,hydrothermal vent system,Loihi Seamount,Hawaii[J].Applied and Environmental Microbiology,1995,61(4):1555-1562.
[45]CORRE E,REYSENBACH A-L,PRIEUR D.ε-proteobacterial diversity from a deep-sea hydrothermal vent on the Mid-Atlantic Ridge[J].FEMS Microbiol.Lett.,2001,205(2):329-335.
[46]REY SENBACH A-L,LONGNECKER K,KIRSHTEIN J.Novel Bacterial and Archaeal lineages from an in situ growth chamber deployed at a Mid-Atlantic Ridge hydrothermal vent[J].Appl.Environ.Microbiol.,2000,66(9):3798-3806.
[47]REYSENBACH A-L.SHOCK E L.Merging genomes with geochemistry in hydrothermal ecosystems[J].Science,2002,296(5570):1077-1082.
[48]LOVLEY D R.Dissimilatory Fe(III)and Mn(IV)reduction[J].Microbiol.Rev.,1991,55(2):259-287.
[49]GHIORSE W C.Biology of iron-and manganese-depositing bacteria[J].Ann.Rev.Microbiol.,1984,38:515-550.
[50]EMERSON D.Microbial oxidation of Fe(II)and Mn(II)at circumneutral pH [M]∥LOVELY D R.Environmental microbe-metal interactions.Washington D C:ASM Press,2000:31-52.
[51]SOBOLEV D,RODEN E E.Suboxic deposition of ferric iron by bacteria in opposing gradients of Fe(II)and oxygen at circumneutral pH[J].Appl.Environ.Microbiol.,2001,67(3):1328-1334.
[52]EMERSON D,MOYER C L.Neutrophilic Fe-oxidizing bacteria are abundant at the Loihi Seamount hydrothermal vents and play a major role in Fe oxide deposition[J].Applied and Environmental Microbiology,2002,68(6):3085-3093.
[53]EMERSON D,RENTZ J A,LILBURN T G,et al.A novel lineage of Proteobacteria involved in formation of marine Fe-oxidizing microbial mat communities[J].PLoS ONE,2007,2(8):e667,doi:10.1371/journal.pone.0000667.
[54]JUNIPER S K,FOUQUET Y.Filamentous iron-silica deposits from modern and ancient hydrothermal sites[J].Canadian Mineralogist 1988,26(3):859-869.
[55]KENNEDY C B,SCOTT S D,FERRIS F G.Characterization of Bacteriogenic Iron Oxide Deposits from Axial Volcano,Juan de Fuca Ridge,Northeast Pacific Ocean[J].Geomicrobiology Journal,2003,20(3):199-214.
[56]LANGLEY S,IGRIC P,TAKAHASHI Y,et al.Preliminary characterization and biological reduction of putative biogenic iron oxides(BIOS)from the Tonga-Kermadec Arc,Southwest Pacific Ocean[J].Geobiology,2009,7(1):35-49.
[57]VIGNAIS PM,BILLOUD B.Occurrence,classification,and biological function of hydrogenases:an overview[J].Chem.Rev.,2007,107(10):4206-4272.
[58]LÖFFLER F E,TIEDJE J M,SANFORD R A.Fraction of electrons consumed in electron acceptor reduction and hydrogen thresholds as indicators of halorespiratory physiology[J].Appl.Environ.Microbiol.,1999,65(9):4049-4056.
[59]HUBER H,STETTER K O.Desulfurococcales[M]∥ DWORKIN M,FALKOW S,ROSENBERG E,et al.The Prokaryotes.New York:Springer,2006:52-68.
[60]THAUER R K,KASTER A-K,SEEDORF H,et al.Methanogenic archaea:ecologically relevant differences in energy conservation[J].Nat.Rev.Microbiol.,2008,6:579-591.
[61]NERCESSIAN O,BIENVENU N,MOREIRA D,et al.Diversity of functional genes of methanogens,methanotrophs and sulfate reducers in deep-sea hydrothermal environments[J].Environ.Microbiol.,2005,7(1):118-132.
[62]SUMMIT M,BAROSS J A.A novel microbial habitat in the mid-ocean ridge subseafloor[J].Proc.Natl.Acad.Sci.USA,2001,98(5):2158-2163.
[63]GOLD T.The deep,hot biosphere[J].Proc.Natl.Acad.Sci.USA,1992,89(13):6045-6049.
[64]ROUSSEL E G,CAMBON BONAVITA M-A,QUERELLOU J.Extending the sub-sea-floor biosphere [J].Science,2008,320(5879):1046.
[65]JANNASCH H W,MOTTL M J.Geomicrobiology of deep-sea hydrothermal vents[J].Science,1985,229(4715):717-725.
[66]LILlEY M D,BAROSS J A,GORDON L I.Reduced gases and bacteria in hydrothermal fluids:the galapagos spreading center and 21°N East Pacific Rise,in Hydrothermal Processes at Seafloor Spreading Centers[M].New York:Springer,1984:411-449.
[67]KATO S,YANAGAWA K,SUNAMURA M,et al.Abundance of Zetaproteobacteria within crustal fluids in back-arc hydrothermal fields of the Southern Mariana Trough[J].Environmental Microbiology,2009b,11(12):3210-3222.
A Review of Microbial Ecology in Low-Temperature Diffuse Flow Area of Modern Submarine Hydrothermal System
LI Ji-wei1,2,ZHOU Huai-yang3,PENG Xiao-tong3,CHEN Zhi-qiang2,SUN Zhi-lei2,LI Jiang-tao3,CHEN Shun3,ZHANG Li-xue3
(1.FacultyofGeoscienesandEnvironmentalEngineering,SouthwestJiaotongUniversity,Chengdu 610031,China;2.GuangzhouInstituteofGeochemistry,ChineseAcademyofSciences,Guangzhou 510640,China;3.StateKeyLaboratoryofMarineGeology,TongjiUniversity,Shanghai 200092,China)
The development of microbial ecology in the areas where low-temperature hydrothermal diffuse flow is dominant has presently become one of the hot scientific topics on the study of submarine hydrothermal system.Many surveys have shown that a large number of chemolithautotrophic microorganisms are present in the low-temperature hydrothermal diffuse flow areas and they obtain energy for metabolism from the redox of elements such as sulfur and Fe(II)supplied by hydrothermal fluids.Their distributions are closely related to the physicochemical conditions of low-temperature hydrothermal fluids.These discoveries have greatly enriched our knowledge of microbial ecology in the low-temperature hydrothermal diffuse flow areas and enhanced our understandings about the relationship between the key geochemical processes and the microbial metabolism in the submarine hydrothermal system.In addition,the low-temperature hydrothermal fluid may be a window for studying the biosphere in the deep oceanic crust,through which the metabolism approach of the life within the oceanic crust could be learned and the interaction mechanisms between the microorganisms and the fluids and rocks within the oceanic crust might be understood.
low-temperature hydrothermal diffuse flow;microbial ecology;chemolithautotrophic microorganism;deep biosphere
February 11,2011
P738
A
1671-6647(2012)02-0295-10
2011-02-11
西南交通大学青年教师百人计划资助项目——表生环境下黑色页岩风化体系中的微生物作用的机理研究(SWJTU12BR010)
李季伟(1983-),男,四川绵阳人,讲师,博士,主要从事地微生物学方面研究.E-mail:lijiwei@163.com
——以西北印度洋为例

