副溶血弧菌一种糖蛋白酶(复苏促进因子)在大肠杆菌中的表达及性质*
赵明君,贾俊涛,陈吉祥,3**
(1.中国海洋大学海洋生物遗传学与基因资源利用教育部重点实验室,山东青岛266003;2.山东出入境检验检疫局,山东青岛266002;3.兰州理工大学石油化工学院,甘肃兰州730050)
副溶血弧菌一种糖蛋白酶(复苏促进因子)在大肠杆菌中的表达及性质*
赵明君1,贾俊涛2,陈吉祥1,3**
(1.中国海洋大学海洋生物遗传学与基因资源利用教育部重点实验室,山东青岛266003;2.山东出入境检验检疫局,山东青岛266002;3.兰州理工大学石油化工学院,甘肃兰州730050)
用PCR方法从副溶血弧菌8621.4基因组中扩增出1种细胞复苏促进因子家族的糖蛋白酶(Glycoprotease,Gcp)基因,核酸序列分析表明其含有完整的gcp基因开放阅读框,编码233个氨基酸组成的蛋白质。核酸序列与副溶血弧菌糖蛋白酶家族基因的序列相似性为100%。其氨基酸序列与哈维氏弧菌HY01、弧菌Ex25、溶珊瑚弧菌、拟态弧菌和杀鲑弧菌LFI1238等糖蛋白酶的序列相似性为67%~92%。将该基因克隆到表达载体p ET28a,在大肠杆菌BL21(DE3)中诱导表达,用Ni琼脂糖亲和柱层析纯化的蛋白为单一条带,利用纯化的Gcp免疫新西兰大白兔制备特异性抗体,Western-Blotting分析发现正常生长及活的非可培养状态(VBNC)诱导过程中的副溶血弧菌细胞内表达的Gcp蛋白为1条带,分子量约为27 k Da,而在VBNC状态的菌体中检测到2条蛋白带。研究结果为进一步探索海洋弧菌活VBNC的形成和复苏机制奠定基础。
副溶血弧菌;复苏促进因子;糖蛋白酶;表达;性质
副溶血弧菌(Vibrio parahaemolyticus)广泛分布于江湖河口及海洋环境,是引起鱼、虾等水产动物疾病的条件性致病菌,也是引起人食物中毒的重要病原菌[1-2]。副溶血弧菌的致病因子有溶血素、脂多糖、胞外蛋白酶、尿素酶及Ⅲ型分泌系统等[3-5]。许多病原菌在不良环境中能形成活的非可培养状态(Viable but Nonculturable State,VBNC),VBNC状态的细菌在一定条件下复苏为可培养形式,并保持其致病性[6]。已发现大肠杆菌(Escherichia coli)、荧光假单胞菌(Pseudomonas fluorescens)、鼠伤寒沙门氏菌(Salmonella typhimurium)、痢疾志贺氏菌(Shigella dysenteriae)等60多种细菌能形成活的非可培养状态[7-9],其中包括弧菌属的许多细菌,如创伤弧菌(Vibrio vulnificus)、霍乱弧菌(Vibrio cholerae)、哈维氏弧菌(Vibrio harveyi)、副溶血弧菌等[10-14],副溶血弧菌在低温寡营养条件下进入活的非可培养状态后,采用升温和添加营养物质能复苏为可培养状态[15],但有关细菌复苏的机制仍不清楚。
细胞复苏促进因子(Resuscitation-promoting factor,Rpf)是一类能够有效促进休眠期细菌复苏的生长因子。Mukamolova等最初将过滤的滕黄微球菌(Micrococcus luteus)培养上清液加到非可培养状态的细菌中能促进其恢复生长,发现培养液中有复苏促进因子存在[16]。随后在许多高G+C含量的革兰氏阳性细菌,如分枝杆菌属(Mycobacteria)、链霉菌属(Strepto-mycetes)、棒杆菌属(Cornebacteria)等中发现与Rpf功能类似的蛋白[17]。现已报道的功能和基因序列相似的蛋白还包括结核分枝杆菌(Mycobacteria tuberculosis)的Rpf[18]、肠沙门氏菌(Salmonella enterica)、溶血性巴斯德氏菌(Pasteurella haemolytica)和金黄色葡萄球菌(Staphylococcus aureus)的糖蛋白酶(Glycoprotease,Gcp)[19-21]、枯草芽孢杆菌(Bacillus subtilis)的YabE[19]、鼠伤寒沙门氏菌(Salmonella typhimurium)的Rpf和YeaZ蛋白等[22-23]。有关弧菌细胞复苏促进因子家族蛋白的结构与功能研究报道较少,本文拟对副溶血弧菌的Rpf家族的基因进行克隆、表达、纯化及性质研究,以便进一步探索海洋弧菌VBNC状态的形成和复苏机制。
1 材料与方法
1.1 菌株和质粒
副溶血弧菌(V.parahaemolyticus)8621.4分离于食用海鲜而腹泻的病人,经API 20 E生理生化、Vitek 32系统及16S r DNA序列分析鉴定后由本实验室保存。质粒p MD19-T购自大连Ta KaRa公司,大肠杆菌DH5α和BL21(DE3)购自TIANGEN公司,质粒p ET28a(+)购自Novagen公司。
1.2 主要试剂和仪器
Taq DNA聚合酶、d NTP、IPTG、各种限制性内切酶、DL2000 DNA Marker和DNA凝胶回收纯化试剂盒购自大连Ta KaRa公司,Ni琼脂糖亲和层析柱购自Novagen公司,硝酸纤维素(NC)膜购自美国Bio-Rad公司,预染蛋白标准分子量购自TIANGEN公司。辣根过氧化物酶HRP标记羊抗兔IgG购自武汉博士德生物工程有限公司。主要仪器包括PCR仪(BIORAD,Mexico),UV-2100 PC分光光度计(Unico),凝胶成像仪(BIO-BEST),MIKRO 22R离心机(Hittich,Germany)和电泳仪(BioRad)。
1.3 副溶血弧菌gcp基因克隆及序列分析
根据已发表的副溶血弧菌基因组序列及其他细菌复苏促进因子家族蛋白的基因序列进行对比,设计特异性引物,上游引物为:5’-CGCGAATTCATGAGCGCAAAAATTCTTGCTATCG-3’,含Eco RⅠ酶切位点,下游引物为:5’-CGCCTCGAGTTATTCGCGGCCTGGAAGCTT-3’,含XhoⅠ酶切位点,引物由上海生物工程公司合成。
用酚-氯仿法提取副溶血弧菌基因组DNA,用50 μL PCR反应体系,PCR反应参数:94℃变性5 min,1个循环;94℃变性50 s,58℃退火1 min,72℃延伸1.5 min,共30个循环;末次循环后72℃延伸10 min。PCR扩增产物用1%的琼脂糖凝胶电泳检测,DNA凝胶回收试剂盒纯化,回收片段连接p MD19-T,转化大肠杆菌DH5α,重组质粒命名为p MD19-T-gcp,由上海生物工程公司进行序列测定,在NCBI(http://blast.ncbi.nlm.nih.gov/blast.cgi)进行序列分析。
1.4 副溶血弧菌gcp基因表达质粒的构建及在大肠杆菌中表达
根据已克隆测序的副溶血弧菌gcp基因序列设计表达引物:上游引物为:5’-CGCGAATTCATGAGCGCAAAAATTCTTGCTATCG-3’,起始于起始密码子,引入酶切位点EcoRⅠ;下游引物为:5’-CGCCTCGAGTTCGCGGCCTGGAAGCTT-3’,引物终止于终止密码子前(不包含终止密码子),引入XhoⅠ酶切位点。以重组克隆质粒p MD19-T-gcp为模板,扩增出gcp基因。PCR反应条件如前。将PCR扩增产物和质粒pET28a(+)分别用EcoRⅠ和XhoⅠ酶切。回收酶切的gcp基因片段和质粒pET28a(+),用T4-DNA连接酶连接,转化至DH5α,挑取阳性克隆接种于5 mL含30μg/m L卡那霉素的LB培养液中,37℃振荡培养过夜,PCR扩增及EcoRⅠ、XhoⅠ双酶切鉴定阳性克隆,构建表达质粒pET28a-gcp。将重组表达质粒转化至BL21(DE3)得到重组菌BL21-p ET28a-gcp。
将重组菌BL21-pET28a-gcp接种于5 mL含30μg/mL卡那霉素的LB液体培养基中,37℃过夜培养后取50μL接种于5 mL相同的培养基,于37℃振荡培养3 h,加入终浓度为0.8 mmol/L的IPTG进行诱导表达,继续培养6 h后,吸取1 m L菌液,12 000 r/min低温离心20 min,分别收集菌体和上清液。在收集的菌体中加入生理盐水、5×SDS-PAGE Loading buffer,混匀后100℃煮沸变性10 min,离心取上清后用SDS-PAGE(12%的分离胶和5%的浓缩胶)分析表达的蛋白。
1.5 Ni琼脂糖柱亲和层析纯化表达的Gcp蛋白
将5 m L Ni琼脂糖装层析柱,用10 mmol/L咪唑洗涤缓冲液(20 mmol/L Tris-HCl,p H=8.0,10 mmol/L咪唑,0.5 mmol/L NaCl)平衡。10 mmol/L咪唑洗涤缓冲液重悬收集的诱导表达菌体,在低温环境中超声破碎,12 000 r/min低温离心10 min,上清液经0.22μm滤器抽滤后上柱。分别用2倍体积的10 mmol/L咪唑洗涤缓冲液和10倍体积的20 mmol/L咪唑洗涤缓冲液(50 mmol/L Tris-HCl,p H=8.0,20 mmol/L咪唑,0.5 mmol/L NaCl)洗涤。最后用150 mmol/L咪唑洗脱缓冲液(20 mmol/L Tris-HCl,p H=8.0,150 mmol/L咪唑,0.5 mmol/L NaCl)洗脱,收集洗脱液。将洗脱液置于透析袋中4℃透析24 h得带有His标签的表达蛋白。
1.6 Gcp特异性抗血清制备及检测
体质量2 000 g左右的新西兰大白兔2只,正常饲养1周后,纯化的Gcp与等量弗氏完全佐剂(FCA,Sigma)混合乳化,对新西兰大白兔背部皮下多点注射,每只兔子注射抗原的剂量为0.8~1 mg,首次免疫21 d后,将Gcp与弗氏不完全佐剂混合乳化进行第2次免疫,免疫剂量相同;免疫21 d后用相同剂量加强免疫1次,最后一次免疫7 d后通过心脏取血,将血清分装于离心管中,保存于-70℃冰箱备用。免疫期间定期取血用ELISA法检测抗体效价。
1.7 Western-Blotting检测正常生长副溶血弧菌gcp基因表达
取过夜培养的副溶血弧菌8621.4 100μL,涂布于含无菌玻璃纸的2216E平板,于28℃培养24 h。无菌生理盐水洗脱2216E平板上的菌体,12 000 r/min离心10 min。分别收集菌体和上清液,上清液于10 k Da超滤离心管浓缩,经SDS-PAGE电泳后,电转至NC膜,用含0.2 g/L封闭蛋白的PBST 4℃封闭过夜;PBST摇床振荡洗涤NC膜5 min,与稀释的Gcp特异性抗体(1∶1 000)于37℃孵育2 h;PBST摇床振荡洗涤NC膜3次,与HRP标记的羊抗兔IgG(1∶400)于37℃孵育2 h;PBST摇床震荡洗涤NC膜4次、每次5 min,DAB显色1 min并观察结果。
1.8 副溶血弧菌进入VBNC状态过程中gcp基因表达
对数生长期的副溶血弧菌8621.4接种于灭菌的过滤海水中,使其终浓度为107CFU/m L,静置于4℃冰箱,并定期取样进行检测。分别用吖啶橙染色荧光显微镜直接计数法(AODC)、活菌直接计数法(DVC)和涂布平板法(PC)测定细菌总数、活细菌数和可培养细菌数[15]。当可培养细菌数降到0时,再加大接种量,即每个平板接种1 mL,连续测定3 d可培养细菌数仍然为0时,即认为实验水体中的细菌进入活的非可培养状态。
收集上述在自然海水中低温条件下培养45 d和进入VBNC状态的副溶血弧菌8621.4菌悬液,12 000 r/min离心10 min。分别收集菌体,SDS-PAGE电泳,用上述Western-blotting方法分析。
2 结果
2.1 副溶血弧菌gcp基因克隆及序列分析
从副溶血弧菌8621.4基因组中扩增出702 bp特异性片段,与预期大小一致(见图1)。DNA序列分析表明含有gcp基因阅读框,编码233个氨基酸残基的蛋白质,没有明显的信号肽及跨膜蛋白结构域。BLAST结果显示该基因序列与副溶血弧菌糖蛋白酶家族基因(BA000031.2、ACFM01000021.1、ACKB01000150.1、ACFO01000021.1、ACFN01000071.1)的序列相似性为100%。其氨基酸序列与哈维氏弧菌HY01(ZP 01988470.1)、副溶血弧菌16(ZP 05120599.1)和杀鲑弧菌LFI1238(YP 002262409.1)的糖蛋白酶的序列相似性分别为92%、75%和67%。与弧菌(Vibrio sp)Ex25(YP 003286719.1)、溶珊瑚弧菌ATCC BAA-450(ZP 05885243.1)和拟态弧菌VM223(ZP 06033833.1)M22肽酶的序列相似性分别为90%、79%和74%。与伤寒沙门氏菌LT2(NP 460776.1)、肠沙门氏菌(AAX08054.1)和大肠杆菌(ACG59770.1)的复苏促进因子的序列相似性为57%。与变形杆菌HI4320的复苏促进因子(糖蛋白酶,YP 002150897.1),鲁氏耶尔森氏菌ATCC 29473(ZP 04616226.1)和克氏耶尔森氏菌ATCC 33638(ZP 04623921.1)M22肽酶YeaZ的序列相似性为55%。
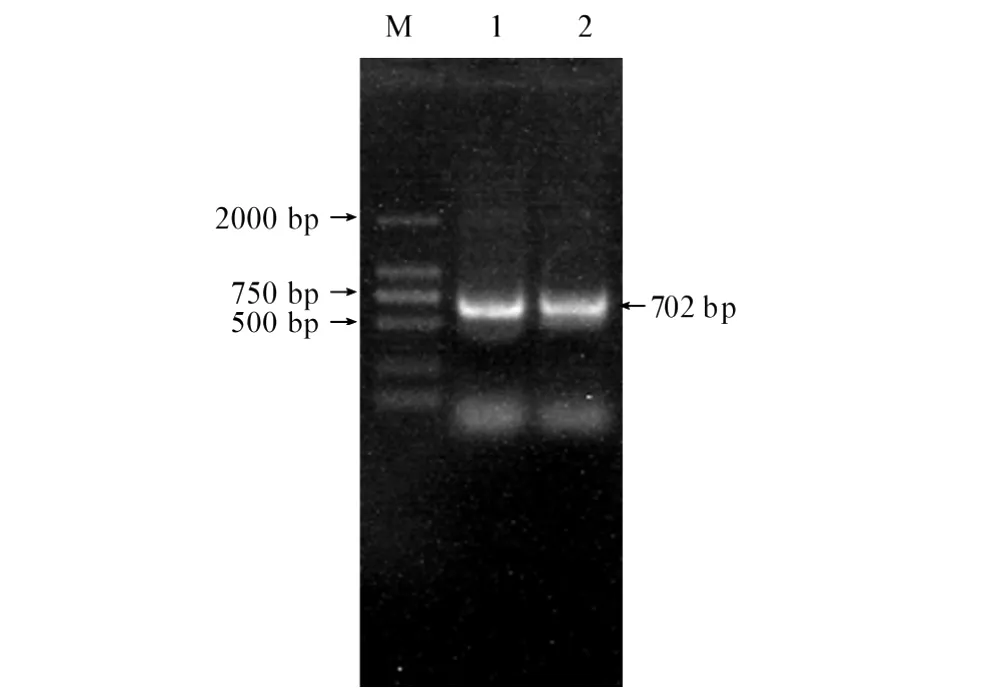
图1 副溶血弧菌8621.4 gcp基因的PCR扩增Fig.1 PCR product of gcp gene obtained by amplification from V.parahaemolyticus 8621.4
将其氨基酸序列与上述不同种属复苏促进因子及相似性蛋白的氨基酸序列通过Clustal(Clustalw multiple alignment)进行多序列比对,采用MEGA3.1的邻接法(Neighbor-joining)构建系统进化树。其结果见图2。

图2 副溶血弧菌Gcp的系统进化树Fig.2 Phylogenetic tree based on Gcp protein from V.parahaemolyticus 8621.4
2.2 副溶血弧菌gcp基因在大肠杆菌中的表达及纯化
副溶血弧菌gcp基因克隆至原核表达载体p ET28a,转化大肠杆菌BL21得到阳性表达菌株BL21-p ET28a-gcp。重组菌在含卡那霉素的LB液体培养基中培养,IPTG诱导表达,菌体裂解液经Ni亲和层析柱分离纯化,进行SDS-PAGE电泳可见有1条30 k Da的特异性表达蛋白带,理论推测值为26.98 k Da,培养上清液中未检测到特异性表达蛋白(见图3)。

图3 重组菌BL21-p ET28a-gcp表达蛋白的SDS-PAGEFig.3 SDS-PAGE analysis of Gcp expressed in E.coli M.Protein molecular weight marker

图4 Western-blotting分析不同生长状态下副溶血弧菌gcp基因表达Fig.4 Western-blotting analysis of gene from V.parahaemolyticus 8621.4 in different cultural conditions
2.3 副溶血弧菌在不同生长状态下gcp基因的表达
由BL21-p ET-28a-gcp表达及纯化的Gcp免疫新西兰大白兔后制备抗血清,ELISA法检测制备的Gcp抗血清效价为1∶1 024 000,Western-blotting结果显示该抗血清能与Gcp蛋白很好的反应。
分别收集正常生长状态、低温条件下培养45 d和进入VBNC状态的副溶血弧菌8621.4菌悬液,12 000 r/min离心10 min收集菌体,SDS-PAGE电泳后,进行Western-blotting,结果表明正常培养和低温培养45 d的副溶血弧菌8621.4菌体中表达Gcp,分子量为27 k Da,VBNC状态的菌体中出现2条蛋白带,分子量为27和54 k Da(见图4),而在培养上清中没有发现特异性表达的蛋白带。
3 讨论
微生物可以通过改变自身生理代谢和基因表达调控以适应不良环境,活的非可培养状态是细菌对不良环境的一种适应,当条件适宜时又恢复为可培养形式。不同病原菌在这一过程中的基因表达和生理代谢有一定差异。具有细胞复苏作用和促进细菌生长的因子最初在藤黄微球菌中发现,微量的Rpf能有效促进休眠的微球菌以及非生长细菌的复苏和生长,藤黄微球菌Rpf蛋白具有胞壁溶解活性和胰蛋白酶样活性,当重组表达的蛋白分泌到大肠杆菌细胞质中时能够引起细胞裂解,Rpf蛋白能水解人工合成的溶菌酶底物和藤黄微球菌细胞壁粗提物,其氨基酸序列中第54位谷氨酸突变后水解肽聚糖的活性降低[24],rpf基因敲除后藤黄微球菌无法生长[25]。目前结核分枝杆菌的Rpf样蛋白研究较多,已经发现了Rpf A-E 5种功能相似的Rpf样蛋白,其中Rpf A和Rpf D被认为是分泌到细胞外的,其余3种则被认为附着在细胞表面[26]。同时敲除rpf A-rpf B-rpf C或rpf A-rpf C-rpf D 3个基因后细菌生长受到明显抑制。敲除其中任意1个基因或同时敲除rpf B-rpf C-rpf D 3个基因对细菌存活和生长没有显著影响[27-28],进一步发现Rpf B是结核分枝杆菌唯一和必需的复苏促进因子[29]。利用酵母双杂交印迹发现了1种能够与结核分枝杆菌RpfB结合的伴侣蛋白分子,称作Rpf结合蛋白A(Rpf-interacting protein A,Rip A),是1种与细胞膜结合的分泌蛋白,具有肽聚糖水解活性,100 pmol/L的Rip A蛋白即可显著促进休眠的耻垢分枝杆菌复苏和生长[30]。荧光显微检测RpfB和Rip A定位在分裂期结核分枝杆菌的隔膜上,两者相互作用的结构域位于蛋白的羧基端,靠近溶菌酶结构域,表明Rpf B和Rip A复合物在细菌复苏时可促进细胞分裂[31]。谷氨酸棒杆菌含有rpf1和rpf2 2个基因,这2个基因编码2种Rpf类似蛋白[32]。Panutdaporn等[22]在伤寒沙门氏菌LT2中发现1种复苏促进因子,由696 bp组成,表达的蛋白分子量约为25 k Da,能促进细胞分裂,也能促进VBNC细胞复苏,与滕黄微球菌Rpf有24.2%的序列相似性,但没有种间活性。Nichols等[23]提出沙门氏菌复苏促进因子YeaZ类似于Gcp,这2种蛋白都有肌动蛋白折叠,没有明显的分泌信号,但两者都是所研究的物种必需的蛋白。金黄色葡萄球菌的Gcp在细菌细胞壁合成过程及细胞自溶、细胞分裂中有重要作用,为细菌存活所必须,可能涉及底物肽聚糖的修饰及调节水解酶(Murein hydrolases)的表达和活性,gcp突变株细菌存活能力及对Triton X-100和抗生素的抵抗力降低[20]。
大部分Rpf蛋白家族成员包含信号肽和(或)跨膜结构域,表明它们可以与膜结合或者分泌到胞外行使功能。关于Rpf引发休眠状态细菌复苏的作用机制还处在探索阶段,多数学者认为Rpf样蛋白的作用机制与溶菌酶有相似之处,都是对细胞壁的肽聚糖进行了水解[24-33]。也有学者认为Rpf样蛋白的作用类似于细胞因子,能够与细菌细胞表面的某种传递生长信号的受体相结合刺激细菌生长,然而至今仍未找到相关的受体[22]。
本文从副溶血弧菌基因组中克隆的Rpf家族糖蛋白酶基因由702 bp组成,编码233个氨基酸残基的蛋白质,没有明显的信号肽和跨膜结构域,其序列与哈维氏弧菌、溶珊瑚弧菌、拟态弧菌、费氏弧菌、杀鲑弧菌等的糖蛋白酶或肽酶有较高的相似性,相似性范围为67%~92%,与变形杆菌和沙门氏菌复苏促进因子的相似性分别为55%和57%,与耶尔森氏菌的M22肽酶YeaZ的相似性为55%。将该基因克隆于大肠杆菌表达载体,SDS-PAGE电泳分析表明目的蛋白在大肠杆菌中高效表达;采用Ni亲和层析柱纯化的Gcp为单一的蛋白带,利用纯化的Gcp免疫新西兰大白兔制备特异性抗体,Western-blotting方法检测发现正常生长的副溶血弧菌8621.4细胞内表达Gcp蛋白,在培养上清中检测不到表达的Gcp,分子量约为27 k Da,与已报道其他细菌的Rpf分子量相近;VBNC状态诱导过程中(低温寡营养)的副溶血弧菌8621.4菌体也能特异性表达该蛋白,而在VBNC状态的菌体中检测到2条特异表达蛋白带,其中1条蛋白的分子量为27 k Da,另一条蛋白的分子量约为54 k Da,推测其为Gcp蛋白的二聚体,这可能是其N端的NH2和C端的COOH发生偶联所致,而且这种偶联不能被SDS打断,但偶联的具体化学键很难断定。随后的研究工作将集中于表达蛋白的生物学功能及突变株的构建及性质研究。
[1] Lee K K,Liu P C,Huang C Y.Vibrio parahaemolyticus infectious for both humans and edible mollusk abalone[J].Microbiol and Infection,2003,5(6):481-485.
[2] Chowdhury M A R,Yamanaka H,Miyoshi S,et al.Ecology and seasonal distribution of Vibrio parahaemolyticus in aquatic environments of a temperate region[J].FEMS Microbiol Ecol,1990,74(1):1-10.
[3] Honda T,Iida T.The pathogenicity of Vibrio parahaemolyticus and the role of the thermostable direct heamolysin and related heamolysins[J].Reviews in Medical Microbiol,1993,4:106-113.
[4] Lee C Y,Cheng M F,Yu M S,et al.Purification and characterization of a putative virulence factor,serine protease,from Vibrio parahaemolyticus[J].FEMS Microbiol Lett,2002,209(1):31-37.
[5] Makino K,Oshima K,Kurokawa K,et al.Genome sequence of Vibrio parahaemolyticus:a pathogenic mechanism distinct from that of V.cholerae[J].Lancet,2003,361(9359):743-749.
[6] Xu H S,Roberts N,Singleton F L,et al.Survival and viability of nonculturable Escherichia coli and Vibrio cholerae in the estuarine and marine environment[J].Microbiol Ecol,1982,8(4):313-323.
[7] Oliver J D.The Viable but nonculturable state in bacteria[J].J Microbiol,2005,43:93-100.
[8] Caro A,Got P,Lesne J,et al.Viability and virulence of experimentally stressed nonculturable Salmonella typhimurium[J].Appl Environ Microbiol,1999,65(7):3229-3232.
[9] Rahman I,Shahamat M,Chowdhury M A,et al.Potential virulence of viable but nonculturable Shigella dysenteriae type 1[J].Appl Environ Microbiol,1996,62(1):115-120.
[10] Chaiyanan S,Huq A,Maugel T,et al.Viability of the nonculturable Vibrio cholerae O1 and O139[J].Syst Appl Microbiol,2001,24(3):331-341.
[11] Hoff K A.Survival of Vibrio anguillarum and Vibrio salmonicida at different salinities[J].Appl Environ Microbiol,1989,55(7):1775-1786.
[12] Whitesides M D,Oliver J D.Resuscitation of Vibrio vulnificus from the viable but nonculturable state[J].Appl Environ Microbiol,1997,63(3):1002-1005.
[13] Sun F R,Chen J X,Zhong L H,et al.Characterization and virulence retention of viable but nonculturable Vibrio harveyi[J].FEMS Microbiol Ecol,2008,64(1):37-44.
[14] Wong H C,Wang P,Chen S Y,et al.Resuscitation of viable but non-culturable Vibrio parahaemolyticus in a minimum salt medium[J].FEMS Microbiol Lett,2004,233(2):269-275.
[15] 杜萌,陈吉祥,孙丰蓉,等.低温寡营养条件下副溶血弧菌形成活的非可培养状态及其复苏研究[J].水生生物学报,2008,32(2):178-183.
[16] Votyakova T V,Kaprelyants A S,Kell D B.Influence of viable cells on the resuscitation of dormant cells in Micrococcus luteus cultures held in an extended stationary phase:the population effect[J].Appl Environ Microbiol,1994,60(9):3284-3291.
[17] Mukamolova G V,Kaprelyants A S,Young D I,et al.A bacterial cytokine[J].Proc Natl Acad Sci USA,1998,95(15):8916-8921.
[18] Mukamolova G V,Turapov O A,Young D I,et al.A family of autocrine growth factors in Mycobacterium tuberculosis[J].Mol Microbiol,2002,46(3):623-635.
[19] Ravagnani A,Finan C L,Young M.A novel firmicute protein family related to the actinobacterial resuscitation-promoting factors by non-orthologous domain displacement[J].BMC Genom-ics,2005,6(1):39.
[20] Sakata N,Terakubo S,Mukai T.Subcellular location of the soluble lytic transglycosylase homologue in Staphylococcus aureus[J].Curr Microbiol,2005,50(1):47-51.
[21] Abdullah K M,Lo R Y,Mellors A.Cloning,nucleotide sequence,and expression of the Pasteurella haemolytica A1 glycoprotease gene[J].J Bacteriol,1991,173(18):5597-5603.
[22] Panutdaporn N,Kawamoto K,Asakura H,et al.Resuscitation of the viable but non-culturable state of Salmonella enterica serovar Oranienburg by recombinant resuscitation-promoting factor derived from Salmonella Typhimurium strain LT2[J].International Journal Food Microbiol,2006,106(3):241-247.
[23] Nichols C E,Johnson C,Lockyer M,et al.Structural characterization of Salmonella typhimurium YeaZ,an M22 O-sialoglycoprotein endopeptidase homolog[J].PROTEINS,2006,64(1):111-123.
[24] Mukamolova G V,Murzin A G,Salina E G,et al.Muralytic activity of Micrococcus luteus Rpf and its relationship to physiological activity in promoting bacterial growth and resuscitation[J].Mol Microbiol,2006,59(1):84-98.
[25] Mukamolova G V,Turapov O A,Kazarian K,et al.The rpf gene of Micrococcus luteus encodes an essential secreted growth factor[J].Mol Mirobiol,2002,46(3):611-621.
[26] Mukamolova G V,Turapov O A,Young D I,et al.A family of autocrine growth factors in Mycobacterium tuberculosis[J].Mol Microbiol,2002,46(3):623-635.
[27] Downing K J,Mischenko V V,Shleeva M O,et al.Mutants of Mycobacterium tuberculosis lacking three of the five rpf-like genes are defective for growth in vivo and for resuscitation in vitro[J].Infect Immun,2005,73(5):3038-3043.
[28] Kana B D,Gordhan B G,Downing K J,et al.The resuscitationpromoting factors of Mycobacterium tuberculosis are required for virulence and resuscitation from dormancy but are collectively dispensable for growth in vitro[J].Mol Microbiol,2008,67(3):672-684.
[29] Ruggiero A,Tizzano B,Pedone E,et al.Crystal structure of the resuscitation-promoting factor(DeltaDUF)RpfB from M.tuberculosis[J].J Mol Biol,2009,385(1):153-162.
[30] 师长宏,赵勇,毛峰峰,等.复苏促进因子结合蛋白A的原核表达及对耻垢分枝杆菌的促生长作用[J].现代医学进展,2010,10(11):2001-2004.
[31] Hett E C,Chao M C,Steyn A J,et al.A partner for the resuscitation-promoting factors of Mycobacterium tuberculosis[J].Mol Microbiol,2007,66(3):658-668.
[32] Hartmann M,Barsch A,Niehaus K,et al.The glycosylated cell surface protein Rpf2,containing a resuscitation-promoting factor motif,is involved in intercellular communication of Corynebacterium glutamicum[J].Arch Microbiol,2004,182(4):299-312.
[33] Cohen-Gonsaud M,Keep N H,Davies A P,et al.Resuscitationpromoting factors possess a lysozyme-like domain[J].Trends Biochem Sci,2004,29(1):7-10.
Expression and Characterization of a Resuscitation-Promoting Factor Like Glycoprotease Gene from Vibrio parahaemolyticus
ZHAO Ming-Jun1,JIA Jun-Tao2,CHEN Ji-Xiang1,3
(1.The Key Laboratory of Marine Genetics and Gene Resource Exploitation of Ministry of Education,Ocean University of China,Qingdao 266003,China;2.Shandong Entry-Exit Inspection and Quarantine Bureau,Qingdao 266002,China;3.Institute of Petrochemical Technology,Lanzhou University of Technology,Lanzhou 730050,China)
A resuscitation-promoting factor like glycoprotease gene was cloned from the chromosomal DNA of pathogenic Vibrio parahaemolyticus 8621.4 by PCR amplification.The ORF of the glycoprotease gene consisted of 702 base pairs,encoding a polypeptide of 233 amino acids.The homologies of the nucleotide sequence with those of other V.parahaemolyticus stains were 100%.The similarities of the amino acid sequence with glycoproteases of Vibrio harveyi HY01,Vibrio sp.Ex25,Vibrio coralliilyticus,Vibrio mimicus and Vibrio salmonicida were from 67%to 92%.The glycoprotease gene was then subcloned into p ET28a and expressed in BL21(DE3).The polyclonal antibody was prepared by immunization of rabbits with the expressed protein,which was purified by Ni(+)-affinity chromatography.A specific protein band of 27 k Da was detected in the whole-cell lysate preparation of normal cultural cells and 45 days culture cells of V.parahaemolyticus 8621.4 at low temperature conditions by western-blotting analysis,and one additional band could be detected in the VBNC cells.These results may be of significance in evaluating the role of Gcp in entering into the VBNC state under starvation stresses and recovering from the VBNC state.
Vibrio parahaemolyticus;resuscitation-promoting factor;glycoprotease;expression;characterization
S941
A
1672-5174(2012)03-057-07
国家自然科学基金项目(30972275);国家高技术研究发展计划项目(2007AA09Z416);国家质检总局科研项目(2010IK180)资助
2011-04-25;
2011-06-27
赵明君(1986-)女,硕士生,从事海洋微生物分子生物学研究。
**通讯作者:E-mail:betcen@ouc.edu.cn
责任编辑 朱宝象

