从马比木根中提取喜树碱的工艺研究
郑 涓,王发松,*,罗庆林
(1.湖北民族学院 化学与环境工程学院,湖北 恩施 445000;2.重庆恒星生物技术有限责任公司,重庆 黔江 409000)
喜树碱(Camptothecin,CPT)是一种含有内酯环结构的吲哚类生物碱,其具有显著的抗癌活性[1],也是迄今为止发现的唯一通过拓扑异构酶发挥细胞毒性的天然活性成分[2].喜树碱最早是从珙桐科植物喜树(CamptothecinacuminateDecne)中分离得到[1],但据文献报道喜树中喜树碱的含量较低,一般都在0.01%~0.1%之间[3-7],而茶茱萸科植物马比木〔Nothapodytespittosporoides(Oliv.) sleum.〕根中喜树碱的含量相对较高,一般都在0.1%~0.4%之间[8-10].在武陵山区有较大储量的马比木植物资源.本文通过以马比木为原料,研究喜树碱的最优提取工艺,为武陵山区中开发利用马比木植物资源奠定基础.
1 材料与方法
1.1 试验材料
试验材料:马比木(Nothapodytespittosporoides)的根采自重庆黔江.切片,阴干后于提取前粉碎.
主要试剂:甲醇(分析纯),乙腈(色谱纯),喜树碱对照品(纯度为98.5%).
1.2 主要仪器
提取工艺各因素考察采用单因素法和正交试验法,含量测定采用HPLC法.分析用高效液相色谱仪为安捷伦1120型.
1.3 HPLC方法学考察
1.3.1 色谱条件 色谱柱为Agilent TC-C18(5 μm,250 mm×4.6 mm) ;流动相为乙腈:水(40∶60);检测波长为254 nm;流速为1.0 mL/min;进样量为20 μL;柱温为室温.
1.3.2 标准曲线的绘制 精密称取喜树碱标准品5.0 mg,用甲醇定容至50 mL,得浓度为0.1 mg/mL的喜树碱标准液.分别取标准液2.0、3.0、4.0、5.0、6.0、7.0、8.0 mL置于10 mL的容量瓶中,加甲醇定容于刻度,摇匀,分别在1.3.1节所述色谱条件下进样分析.以峰面积(Y)为纵坐标,喜树碱浓度(X)为横坐标,绘制标准曲线,计算得线性回归方程为:Y=886 628X+1×106,相关系数R=0.999 7,线性范围为:0.02~0.18 mg/mL.
1.3.3 样品测定 精密称取马比木根的干燥粉末10 g,加入100 mL甲醇,70℃水浴中加热回流1 h,得样品提取液;将提取液转入100 mL容量瓶中,定容;在1.3.1节所述色谱条件下进样,得峰面积,代入1.3.2节所述线性回归方程中,得到样品喜树碱含量,再计算得出喜树碱提取率.
1.3.4 精密度试验 取同一标准溶液,在1.3.1节所述色谱条件下连续进样5次,测得喜树碱含量,计算RSD值为2.6%.
1.3.5 重现性试验 精密称取5份马比木根的干燥粉末10 g,通过1.3.3节所述样品测定方法测定喜树碱含量,并计算RSD值为1.2%.
1.3.6 稳定性试验 同一份样品提取液,在1.3.2节所述色谱条件下,分别在2、4、8、12、48 h时各进样一次,测得喜树碱含量,计算RSD值为3.1%.
1.3.7 加标回收率试验 精密称取5份马比木根的干燥粉末10 g,通过1.3.3节所述样品测定方法得到样品提取液,分别加入0.02 mg/mL的喜树碱标准溶液1 mL,在1.3.2所述色谱条件下进样,测得加标回收率为97.4%.

表1 甲醇浓度对喜树碱提取率影响

表2 温度对喜树碱提取率的影响

表3 时间对喜树碱提取率的影响
2 结果与分析
2.1 单因素试验
2.1.1 甲醇浓度对提取率的影响 精密称取5份马比木根的干燥粉末10 g,分别加入50%、60%、70%、80%、90%的甲醇100 mL,70℃水浴中加热回流1 h,重复提取三次,分别编号1、2、3,并计算喜树碱的平均提取率,如表1所示.
2.1.2 温度对提取率的影响 精密称取5份马比木根的干燥粉末10 g,加入70%的甲醇100 mL,分别在40、50、60、70、80℃水浴中加热回流1 h,重复提取三次,分别编号1、2、3,并计算喜树碱的平均提取率,如表2所示.
2.1.3 时间对提取率的影响 精密称取5份马比木根的干燥粉末10 g,加入70%的甲醇100 mL,分别在70℃水浴中回流0.5、1.0、1.5、2、2.5 h,重复提取三次分别编号1、2、3并计算喜树碱的平均提取率,如表3所示.
由单因素试验可知,在低浓度下随甲醇浓度的升高提取率逐渐提高,可能是因为喜树碱在甲醇中溶解度比在水中溶解度大;而超过70%后,随甲醇浓度的升高,提取率逐渐降低,这可能是因为高浓度的甲醇不利于穿透细胞导致的结果.
在温度较低时,随温度的升高提取率逐渐提高,这可能是因为升高温度可以提高有效成分在溶剂中的扩散速率,使得提取率有所升高,但是超过70℃之后,可能是因为喜树碱本身具有热不稳定性,过高的温度促使其分解,使得提取率下降.
提取过程中,喜树碱随提取时间延长提取率逐渐提高,但是超过1.5 h后,可能由于喜树碱本身分解损失,导致提取率减低.

表4 L9(33)正交试验因素水平表
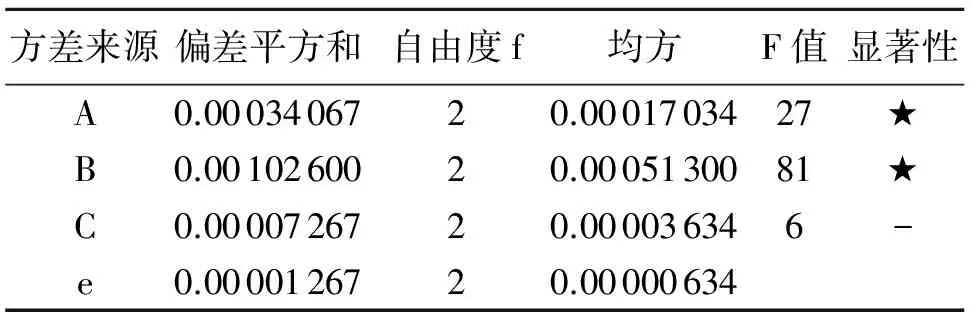
表6 方差分析结果
2.2 正交试验
通过单因素试验,选取提取溶液浓度、提取温度、提取时间三个因素设计三因素三水平的正交试验,见表4;采用L9(33)正交表进行正交试验设计,以喜树碱提取率为考察指标,结果及分析见表5.
2.3 正交试验结果及方差分析
精密称取马比木根的干燥粉末10 g,共9份,置于250 mL圆底烧瓶中,按表4进行试验,采用HPLC进样分析提取液中喜树碱的浓度,并计算出喜树碱的提取率.正交试验结果及方差分析见表5及表6.

表5 正交试验结果
通过比较表5中R(极差)值的大小,各因素极差大小为RB>RA>RC,优先顺序为B>A>C.
由表6的方差结果可知,在提取喜树碱的过程中甲醇浓度和提取温度对提取率有显著影响,而提取时间对提取率影响不显著.对于工艺化生产中,优化条件为A2B2C2,即甲醇浓度为70%,提取温度为70℃,提取时间1.5 h.
3 讨论
采用上述提取工艺,马比木根中喜树碱的提取率可以达到0.16%,而据文献报道,喜树果实中喜树碱的提取率为0.734‰[5],喜树叶中喜树碱的提取率为0.114 2%[6],由此可见马比木根中喜树碱的提取率较高,可做为喜树碱的药源植物进行进一步的研究和开发利用.
该工艺以甲醇为提取溶剂,提取时间短,能量消耗低,在实际生产过程中溶剂便于回收利用,降低了经济成本,减少环境污染.所以,以马比木为原料,利用此工艺条件提取喜树碱,可以产生很好的经济效益.
[1] Wall M E,Wani M C,Cook C E,et al. Plant antitumor agents I: The isolation and structure of camptothecin, a novel alkaloidal leukemia and tumor inhibitor from Camptotheca acuminata[J].J Amer Chem Soc,1966,88(16):3888-3890.
[2] Hsiang Y H,Hertzberg R, Hecht S,et al.Camptothecin induces protein_linked DNA breaks via mammalian DNA topoisomerase Ⅰ[J].J Biol Chem, 1985, 260(27): 14873-14878.
[3] Devanand P,Ramesh K. Comparsion of techniques for the estraction of the anti-cancer drug canptothecin from Nothapodyes foetidap[J].Joumao of Chromatography A, 2005, 1063(1/2):9-13.
[4] 赵春建,李佳慧,杨磊,等. 优化喜树果中喜树碱和10-羟基喜树碱的匀浆提取工艺[J].森林工程, 2009,25(2):22-27.
[5] 王洋,于涛,张玉红,等.碱法提取喜树碱工艺的研究[J].植物研究, 2004, 20(4):433-437.
[6] 王洋,于涛,张玉红,等. 从喜树叶中碱法提取喜树碱新工艺[J].中草药,2001,32(10):882-884.
[7] 邓仕明,王发松,周大寨,等.喜树不同部位喜树碱的质量分数比较研究[J].湖北民族学院学报:自然科学版,2009,27(3):258-260.
[8] 吴开慧,蔡其辉,吕江明,等.夷陵山区不同产地马比木药材中喜树碱的含量比较[J].中南药学,2011,9(3): 197-200.
[9] 邓仕明,王发松,周大寨,等.HPLC法测定马比木根中喜树碱的含量[J].安徽农业科学,2010,38(9):4965-4966.
[10] 蒲尚饶,杨朗生,蹇凯,等.马比木根中喜树碱含量的HPLC测定方法[J].安徽农业科学,2010,38(6):2934-2935,2942.

