TiO2/N可见光光催化降解邻苯二甲酸二甲酯
张科军,曾黎明,王联芝,但悠梦
(湖北民族学院 化学与环境工程学院,湖北 恩施 445000)
邻苯二甲酸酯(phthalate esters,PAEs,俗称酞酸酯)主要用作塑料的改性添加剂,以增大塑料的可塑性和强度;也可用于农药、涂料、印染、化妆品和香料等的生产加工.同时,PAEs具有雌激素效应,可能会干扰动物及人类的内分泌及生殖系统,损害生殖和发育[1].因此,对现存的大量的,已经且仍将会继续对人类赖以生存的地球环境造成重大危害的邻苯二甲酸酯类污染物,如何实现高效、快速的降解,使之生成对环境没有二次污染的有机或无机小分子,有着重要的理论价值和现实意义.
目前邻苯二甲酸酯类污染物的降解方法主要包括生物降解法[2-6]、活性炭吸法[7-8]和光催化氧化[9-12]等.生物降解存在培养菌种困难、治理种类单一、耗时长等不足之处.而活性炭吸附成本高,本质上只是转移PAEs,会引起二次污染.光催化氧化技术具有高效、节能、无二次污染、能将污染物完全矿化的特点,可望使用太阳光,在治理难降解有机废水方面比其他治理方法更具优势.探索合适的光催化剂是近几年环境科学家研究的重点.用于光催化降解环境污染物的催化剂多为n型半导体材料金属氧化物,如TiO2、ZnO、WO3、SnO2、Fe2O3、ZrO2等.在众多的半导体光催化剂中,TiO2以其具有高活性、安全无毒、廉价易得、化学性稳定(耐化学和光腐蚀)、成本低等优势,被公认为环境污染治理领域最具开发前导的环保型光催化材料[13-28].目前光催化技术大多采用人工紫外光作光源,造成其成本较高;如何实现TiO2可见光催化仍具有十分重要的意义.本文合成一种新型TiO2改性材料,并利用可见光做光源,探索在本体系下邻苯二甲酸酯类化合物的光催化降解效率,从而发展一种新的邻苯二甲酸酯类化合物的绿色消减技术.
1 实验部分
1.1 试剂与仪器

图1 DMP标准曲线
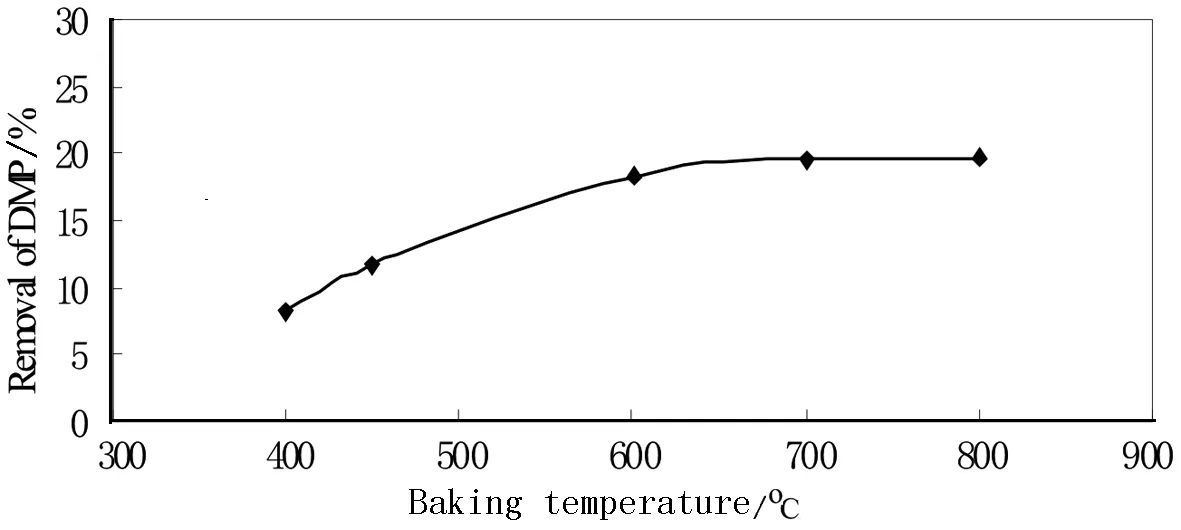
图2 不同煅烧温度的TiO2/N催化降解DMP
邻苯二甲酸二甲酯(DMP):分析纯,天津市博迪化工有限公司;二氧化钛:分析纯,天津市化工厂.
光化学反应仪:BL-GHX-Iv型,上海比朗仪器有限公司;紫外可见分光光度计:UV-2501,日本岛津.
1.2 DMP光催化降解实验
1.2.1 TiO2催化剂的制备 采用TiCl4直接氨水解法制备锐钛矿型掺氮纳米TiO2.将一定量TiCl4溶液缓慢滴入10%稀氨水中,剧烈搅拌下得到大量凝胶,陈化2 d.在90℃水浴中充分水解2 h,过滤,用蒸馏水反复洗涤,得到白色沉淀,放入干燥箱中100℃干燥2 h,再将粉体用1∶1氨水浸渍1 d,过滤后在干燥箱中105℃干燥10 h,制得了TiO2前驱体.
将所制备的TiO2前驱体在管式炉中在一定温度下煅烧一定时间,得到锐钛矿型为主的掺氮纳米TiO2.

表1 TiO2/N催化剂保温时间、保护气的筛选(600℃焙烧)
1.2.2 DMP原液的配制及其标准曲线的绘制 称取一定量的DMP,配制成质量浓度为100 mg/L的DMP储备液,储存于4℃的冰箱中备用.
采用0、1、5、10、15、20、30、40、50 mg/L的DMP标准溶液在其最大吸收波长(230 nm)处测定吸光度,得到吸光度与浓度的标准曲线图(图1).
1.2.3 DMP的光催化降解实验 配制一定浓度的DMP溶液,取一定体积置于光化学反应仪中与灯光同心的圆柱形玻璃质的反应试管中,加入一定量的TiO2/N作为降解催化剂,在磁力搅拌下,以500 w氙灯为光源,进行光催化降解实验.
2 结果与讨论
2.1 TiO2/N催化剂的筛选
TiO2/N活性与制备方法的煅烧温度有关.在空气中,采用不同的焙烧温度,如400、450、500、600、700、800℃制备TiO2(焙烧时间30 min),考察焙烧温度对掺氮纳米TiO2光催化降解DMP的影响.结果如图2.
由图中可以看出,温度较低时焙烧的TiO2/N催化降解率也较低.随着焙烧温度的升高,TiO2/N的催化活性逐渐增强,当焙烧温度达到600℃后DMP的降解率无明显变化.可能原因是,当焙烧温度低于550℃度时样品主要以锐钛型存在,而焙烧温度高于700℃时,样品几乎全部转换成金红石型.适当的条件下可以得到二者以适当比例共存的复合半导体,该复合体表现出比单纯锐钛矿TiO2/N更高的活性.故选用在600℃下焙烧催化剂为宜.
催化剂TiO2/N的制备过程中除受焙烧温度影响外,还与焙烧时间以及充气环境等因素有关.因此,对焙烧时间及充气环境进行了考察.结果如表1.
在同一温度下随焙烧时间的延长,金红石型TiO2的比例会增加,锐钛型转换为金红石型的过程是很缓慢的.由表1中可以看出,相同焙烧温度下,随着焙烧时间延长催化剂的活性增加,但在1 h后变化并不明显.而对于不同的保护气,NH3比空气及N2略好,但催化效果相差不大.考虑到催化剂制备过程中的操作可行性及环境友好性,实验中采用在600℃下,在空气氛围中焙烧60 min制备TiO2催化剂.
2.2 光催化降解反应的影响因素
2.2.1 光照时间对光催化降解反应的影响 在50 mg/L的DMP溶液中(pH=6.20),加入TiO2/N催化剂(1 g/L),在避光及在氙灯照射下进行催化降解实验(光强为35×1000 uw/cm2),结果见图3.
由图中可看出,TiO2/N催化剂在黑暗避光条件下对DMP的降解没有明显效果,但在光照条件下DMP降解较明显.随着光照时间延长,DMP的降解率逐渐增大,光照5 h后,降解率可达51.9%.
2.2.2 DMP初始浓度对光催化降解反应的影响 分别对浓度为10、20、40、50、60、80 mg/L的DMP溶液,在TiO2/N(1 g/L)催化剂存在下,光照2 h,测定其降解率.结果如图4.
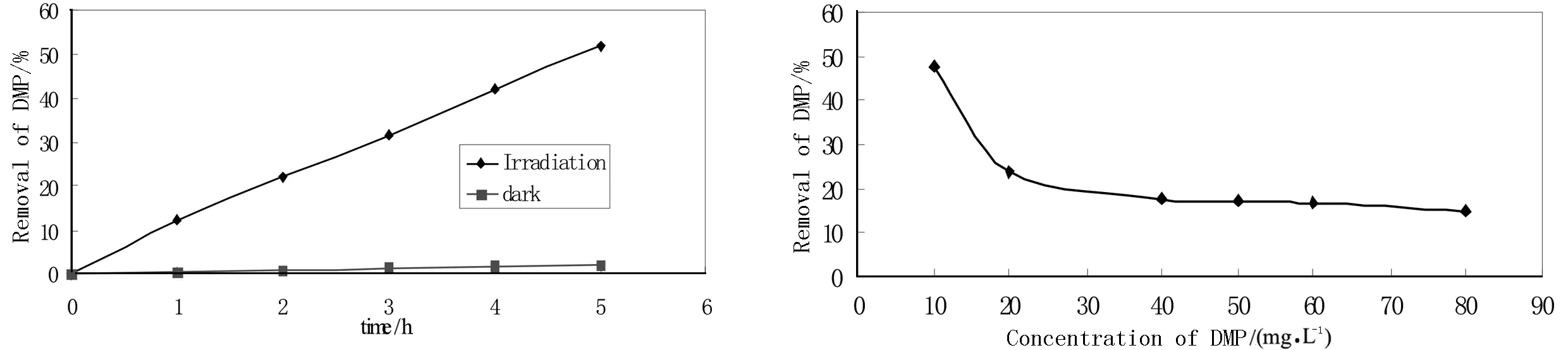
图3 光照时间对光催化降解反应的影响 图4 DMP初始浓度对光催化降解反应的影响
由图4中可知:DMP初始浓度从10 mg/L升至40 mg/L时,随着浓度的增大,降解速率明显降低;当浓度大于40 mg/L时,降低趋势变慢.这是因为在催化剂用量一定的情况下,产生的具有高度催化活性的羟基自由基的量也一定.一般认为催化剂TiO2的表面羟基为活性点,有机物等首先在活性点附近发生反应,随着反应物浓度的增大,吸附量不断增大,当浓度达到一定值以后,吸附也趋近于饱和状态,那么更多的溶质就会被吸附在催化剂的表面,导致活性部位减小,此后浓度增大就不会产生太大的影响.为了达到较好的降解效果,选取10 mg/L的DMP溶液进行光催化降解实验.
2.2.3 催化剂TiO2的量对光催化降解反应的影响 在10 mg/L的DMP溶液中加入不同量的TiO2,其投加量分别为0.1、0.3、0.5、0.8、1.0、1.2、1.5、2.0 g/L,进行光催化降解实验,测定4 h时的降解率,结果如图5.
由图5中结果可知,TiO2/N催化剂对DMP有较好的光催化降解作用,未加催化剂时,DMP在光照条件下没有明显的降解.在较低的催化剂量时,降解速率随着TiO2/N催化剂量的增加而增大,当催化剂TiO2/N的量达到1.0 g/L后,继续增加催化剂量,DMP的降解率变化不明显.这可能是由于适量浓度的催化剂TiO2/N可增加反应物与催化剂颗粒物的接触表面积,产生更多的活性自由基,提高降解效率.但当TiO2/N的添加量过多时会造成较强的光散射,增大电子-空穴的复合几率,使较多的催化剂被覆盖以致于接触不到光催化过程中的光源,导致在光催化降解过程中催化剂TiO2/N未被充分激发出来,继而不能产生更多的羟基自由基,使单位质量催化剂的催化效果反而下降.因此,选择催化剂的用量为1.0 g/L.
2.2.4 pH值对光催化降解反应的影响 对10 mg/L的DMP溶液,考察pH值对其降解效率的影响.分别在不同的pH条件下进行光催化降解,测定光照5 h后的降解率,结果如图6.

图5 TiO2/N催化剂投加量对光催化降解反应的影响 图6 pH值对光催化降解反应的影响
结果发现pH值对DMP的光催化降解没有明显的影响.在酸性到中性的条件下,DMP的降解率没有明显的变化;但在碱性环境中,可能因为DMP的水解而使反应溶液变浑浊,致使降解反应不能正常进行.因此,在本实验中不用调节pH值,即在其本身的pH环境(pH=6.2)下进行光降解即可.
2.3 DMP降解曲线及动力学分析
对TiO2/N光催化降解DMP实验进行动力学分析,用C0表示DMP的初始质量浓度,C表示DMP某一时刻的质量浓度,在上述最佳实验条件下进行光降解试验,以初始浓度与剩余浓度比值的自然对数(lnC0/C)对照射时间(t)作线性回归,如图7,得出线性方程及相关系数r,从相关系数可知DMP的光降解为一级动力学反应.直线的斜率为反应速率K(h-1),用公式可计算出半衰期t1/2=2.317.
DMP ln(C0/C)=0.020 5+0.290 3tR2=0.997 6
2.4 对DMP降解中化学需氧量(COD)去除率的分析
DMP光降解是一个复杂的过程,不可能一步完全矿化为CO2和H2O,而是降解生成一系列中间产物,可能对环境产生二次污染,而理想情况下力求能使有机物完全矿化.我们在优化的条件下,在不同的时间测定了DMP的降解率及其COD去除率,结果如图8.
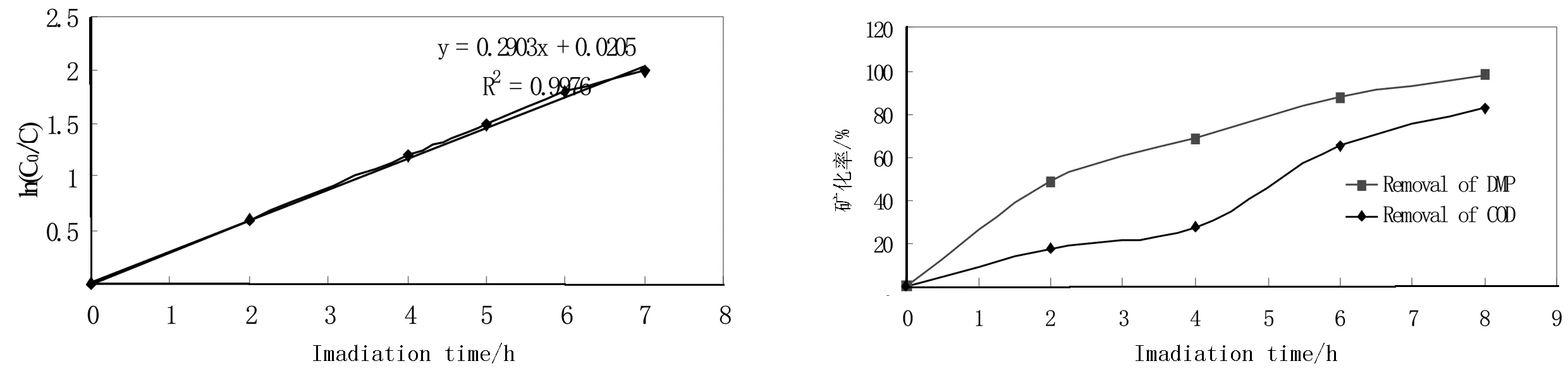
图7 DMP降解过程中ln(C0/Ct)随着时间变化曲线 图8 DMP在不同时间下的降解率及矿化率
由图8中可知:在开始前4 h,其矿化率较小,且矿化率的改变不是很明显,说明在光催化降解的起始阶段,DMP并没有完全直接降解为CO2和H2O,而是先转化成其他的有机中间产物.随后,随着DMP的降解率的明显提高,矿化率也明显增加,说明随着光照时间的延长,中间产物逐渐被矿化.当光照时间为8 h时,DMP的降解率大于98%,其COD去除率达到82.8%.
3 结论
氮掺杂TiO2催化剂对邻苯二甲酸二甲酯类有机污染物有明显的光催化降解作用.在600℃下焙烧30 min得到的TiO2/N催化效果最好,当DMP的初始浓度为10 mg/L时,使用1.0 g/L的催化剂量,在DMP溶液本身的pH条件下,经8 h的光照后,DMP的降解率大于98%,COD去除率达到82.8%.相关动力学研究发现,该降解过程为动力学一级反应.
[1] Saillenfait A M, Laudet-Hesbert A. Phtalates[J]. EMC-Toxicologie-Pathologie,2005 2:1-13.
[2] Huang M H, Li Y M, Gu G W.The effects of hydraulic retention time and sludge retention time on the fate of di-(2-ethylhexyl) phthalate in a laboratory-scale anaerobic anoxic aerobic activated sludge system[J]. Bioresource Technology,2008,99:8107-8111.
[3] Otton S, Sura S, Blair J,et al.Biodegradation of mono-alkyl phthalate esters in natural sediments[J]. Chemosphere,2008,71:2011-2016.
[4] Jee S, Dutta T. Complete degradation of butyl benzyl phthalate by a defined bacterial consortium: role of individual isolates in the assimilation pathway[J]. Chemosphere,2008,70:933-941.
[5] Brar S,Verma M,Tyagi R,et al.Concurrent degradation of dimethyl phthalate (DMP) during production of Bacillus thuringiensis based biopesticides[J]. J. Hazard. Mater,2009,171:1016-1023.
[6] Lu Y, Tang F, Wang Y,et al.Biodegradation of dimethyl phthalate, diethyl phthalate and di-n-butyl phthalate by Rhodococcus sp. L4 isolated from activated sludge[J].J Hazard Mater,2009,168:938-943.
[7] Zhang W, Xu Z, Pan B. et al. Equilibrium and heat of adsorption of diethyl phthalate on heterogeneous adsorbents[J]. J Colloid Interface Sci,2008,325:41-47.
[8] Venkata M,Shailaja S, Rama K,et a1.Adsorptive removal of phthalate ester(Di-ethyl phthalate) from aqueous phase by activated carbon: A kinetic study[J]. J Hazard Mater,2007,146:278-282.
[9] Ye Z,Cao C,He J,et al.Photolysis of organic pollutants in wastewater with 206 nm UV irradiation[J]. Chin Chem Lett,2009,20:706-710.
[10] Olmez-Hanci T, Imren C, Arslan-Alaton I, et al. H2O2/UV-C oxidation of potential endocrine disrupting compounds: a case study with dimethyl phthalate[J]. Photochem Photobiol Sci,2009,8:620-627.
[11] Nie Y,Hu C,Qu J,et al.Photoassisted degradation of endocrine disruptors over CuOx-FeOOH with H2O2at neutral pH[J].Appl Catal B:Environmental,2009,87:30-36.
[12] Xu B, Gao N, Cheng H, et al. Oxidative degradation of dimethyl phthalate (DMP) by UV/H2O2process[J].J Hazard Mater,2009,162:954-959.
[13] Chen Y,Chen L, Shang N. Photocatalytic degradation of dimethyl phthalate in an aqueous solution with Pt-doped TiO2-coated magnetic PMMA microspheres[J]. J Hazard Mater,2009,172:20-29.
[14] Yuan B, Li X, Graham N. Reaction pathways of dimethyl phthalate degradation in TiO2-UV-O2and TiO2-UV-Fe(VI) systems[J]. Chemosphere,2008,72:197-204.
[15] Yuan B,Li, X,Graham N. Aqueous oxidation of dimethyl phthalate in a Fe(VI)-TiO(2)-UV reaction system[J]. Water Research,2008,42:1413-1420.
[16] Xu L, Yang X, Guo Y,et al.Simulated sunlight photodegradation of aqueous phthalate esters catalyzed by the polyoxotungstate/titania nanocomposite[J].J Hazard Mater,2010,178:1070-1077.
[17] Yuan B,Li X,Nigel G.Aqueous oxidation of dimethyl phthalate in a Fe(VI)-TiO2·UV reactions system[J]. Water Rearch,2008,42:1413-1420.
[18] Xu X, Li S, Li X, et al. Degrdation of n-butyl benzyl phthalate using TiO2/UV[J]. J Hazard Mater,2007,164:278-282.
[19] Li L, Zhu W, Chen L, et al. Photocatalytic ozonation of dibutyl phthalate over TiO2film[J]. J Photochem Photobiol A:Chemistry,2005,175:172-177.
[20] Chan C, Chana C, Hsu W,et al.Photocatalytic activities of Pd-loaded mesoporous TiO2thin films[J]. Chem Engin J,2009,152:492-497.
[21] Wang X C, Yu J C, Yip H Y,et al.A mesoporous Pt/TiO2nanoarchitecture with catalytic and photocatalytic functions[J].Chem Eur J,2005,11:2997-3004.
[22] Yu Z Q, Steven S, Chuang C. The effect of Pt on the photocatalytic degradation pathway of methylene blue over TiO2under ambient conditions[J]. Appl Catal B:Environ,2008,83:277-285.
[23] Ishibai Y,Sato J, Nishikawa T,et al.Synthesis of visible light active TiO2photocatalyst with Pt-modification: Role of TiO2substrate for high photocatalytic activity[J]. Appl Catal B:Environ,2008,79:117-121.
[24] Li J, Zeng H C. Preparation of monodisperse Au/TiO2nanocatalysts via self-assembly[J].Chem Mater,2006,18:4270-4277.
[25] Li H X, Bian Z F, Zhu J, et al. Mesoporous Au/TiO2nanocomposites with enhanced photocatalytic activity[J].J Am Chem Soc,2007,129:4538-4539.
[26] Aramendia M A, Borau V, Colmenares J C, et al.Modification ofthe photocatalytic activity of Pd/TiO2and Zn/TiO2systems through different oxidative and reducfive calcination treatments[J]. Appl Catal B: Environ,2008,80:88-97.
[27] AoY, Xu J, Fu D, et al.Preparation of Ag-doped mesoporous titania and its enhanced photocatalytic activity under UV light irradiation[J]. J Physics Chem Solids,2008,69:2660-2664.
[28] Jiang D L,Zhang S Q,Zhao H J. Photocatalytic degradation characteristics of different organic compounds at TiO2nanoporous film electrodes with mixed Anatase/Rutile phases[J]. Environ Sci Technol,2007,41:303-308.

