紫番薯原花青素的提取和稳定性研究
刘 萍王文君
(1秦皇岛市海港区农业局,秦皇岛066000) (2遵义医学院珠海校区,珠海 519041)
·基础研究·
紫番薯原花青素的提取和稳定性研究
刘 萍1*王文君2
(1秦皇岛市海港区农业局,秦皇岛066000) (2遵义医学院珠海校区,珠海 519041)
采用乙醇提取紫番薯原花青素,运用AB-8大孔树脂进行纯化,洗脱液分别为体积浓度10%、30%、50%和70%的乙醇。洗脱液经浓缩、冷冻干燥制得4种紫番薯原花青素样品,并对每个样品的稳定性进行了研究。
紫番薯;原花青素;稳定性
原花青素(procyanidins,PC) 是从植物中分离得到的一类可在热酸处理下产生红色花色素的多酚类化合物,因其具有较强的清除自由基、抗氧化、改善心血管疾病、抗癌、抗辐射和抗病毒等生物活性,广泛应用于农业和医药等领域。目前市场上的商品原花青素主要源于葡萄籽提取物,而葡萄籽原花青素的稳定性比较差。因此,近几年有许多探索从其他的植物中提取原花青素并分析稳定性的研究报道。我们研究发现紫番薯中也富含原花青素,因此对紫番薯原花青素进行了提取,并用AB-8大孔树脂进行了纯化,同时对样品的稳定性进行了研究,希望对紫番薯原花青素的开发利用提供理论依据。
1 试剂与仪器
紫番薯,珠海市三灶市场;原花青素标准品,上海中药研究所;AB-8型国产大孔吸附树脂,北京慧德易科技有限责任公司;其他试剂均为国产分析纯。
UV2550型紫外可见分光光度计,日本岛津;CQ-200B型超声波振荡器,上海跃进医学用光学器械厂;400 g摇摆式高速中药粉碎机,温岭市林大机械有限公司;RE-52型旋转蒸发仪,上海亚荣生化仪器厂;Scientz-10N型冷冻干燥机,宁波新艺生物科技股份有限公司。
2 试验方法
2.1 脱脂紫番薯粉的制备
取新鲜紫番薯洗净、切成细丝放在阴凉避风处自然风干,将风干后的紫番薯丝用粉碎机粉碎,过80目筛,称重,细粉用石油醚按料液比1 g∶1 mL的比例浸泡1 h,然后超声波20 min,抽滤至近干,45℃烘烤24 h,备用。
2.2 原花青素的提取
脱脂紫番薯粉用体积浓度30%的乙醇以料液比1 g∶3 mL浸提2.5 h,超声提取20 min,抽滤,收集滤液。将滤渣再用体积浓度30%乙醇以料液比1 g∶2 mL进行浸提,再次超声提取20 min,抽滤,收集滤液。将滤渣再用体积浓度30%乙醇按料液比1 g∶1 mL进行浸提,再次超声提取20 min,抽滤,收集滤液。将滤液合并用旋蒸仪蒸至黏稠状,然后用AB-8大孔树脂进行吸附洗脱,洗脱液分别用体积浓度10%、30%、50%、70%的乙醇,把洗脱液真空浓缩至20 mL左右,冷冻干燥24 h,分别得到紫番薯原花青素样品 S1、S2、S3、S4。
2.3 原花青素含量测定(标准曲线的绘制)
原理:铁盐作为催化剂的条件下,原花青素在酸性条件下加热转化为红色,红色的深浅与原花青素的含量成正比关系。该方法特征性显著,操作方便,重现性好。
试验方法:称取原花青素标准品10.00 mg溶于乙醇中,定容至10 mL,吸取该溶液0.10 mL、0.25 mL、0.50 mL、1.00 mL、1.50 mL分别置于5个10 mL容量瓶中,加乙醇至刻度,摇匀。将正丁醇与盐酸按95∶5的体积比混合后,取出6.00 mL分别置于5个10 mL具塞比色管中,再加入0.20 mL硫酸铁铵溶液(24.1 mg/mL) 和1.00 mL原花青素标准品溶液,混匀,置沸水浴回流,加热40 min,立即置冰水中冷却。以V(正丁醇—盐酸溶液)∶V(硫酸铁铵溶液)∶V(乙醇)=6.00∶0.20∶1.00的试剂作空白参比,在549 nm处用紫外分光光度计测定其吸光度,并绘制标准曲线。样品同样条件下测定吸光度。
2.4 金属离子对原花青素稳定性的影响
配制质量分数均为0.1%的各种金属离子溶液(K+、Ca2+、Zn2+、Na+、Fe3+)各50mL,分别取9mL置于10 mL容量瓶中,向其中加入1 mL一定浓度的样品溶液或标准品溶液,摇匀,立即取样测定280 nm波长处吸光度,然后密封避光放置并测定24 h和48 h后吸光度;另取9 mL水加入相同浓度的样品溶液或标准品溶液1 mL摇匀(结果中记为原液),同法测定做对照。
2.5 食品添加剂对原花青素稳定性的影响
配制0.4 mol/L的葡萄糖溶液、0.1 mol/L的食盐溶液和质量分数0.02%的谷氨酸钠溶液、0.02%的柠檬酸溶液各50 mL,分别取9 mL置于10 mL容量瓶中,向其中加入1 mL一定浓度的样品溶液或标准品溶液,摇匀,立即取样测定280 nm波长处吸光度,然后密封避光保存并测定24 h和48 h后吸光度;另取9 mL水加入1 mL相同浓度的样品溶液或标准品溶液摇匀(结果中记为原液),同法测定做对照。
3 结果
3.1 紫番薯原花青素含量
根据原花青素标准曲线得回归方程为D(λ)=1.7418 ρ-0.0104,R2=0.999,线性关系很好,可以用于定量分析。乙醇洗脱得到的4个紫番薯样品原花青素的含量(质量分数) 分别为1.6%、10.8%、8.2%、4.3%。从这里可以看出,AB-8大孔树脂对紫番薯色素具有一定的富集能力,但效果有限。
3.2 金属离子对原花青素稳定性的影响
金属离子对原花青素稳定性的影响见图1~图5。

图1 金属离子对S1稳定性的影响

图2 金属离子对S2稳定性的影响
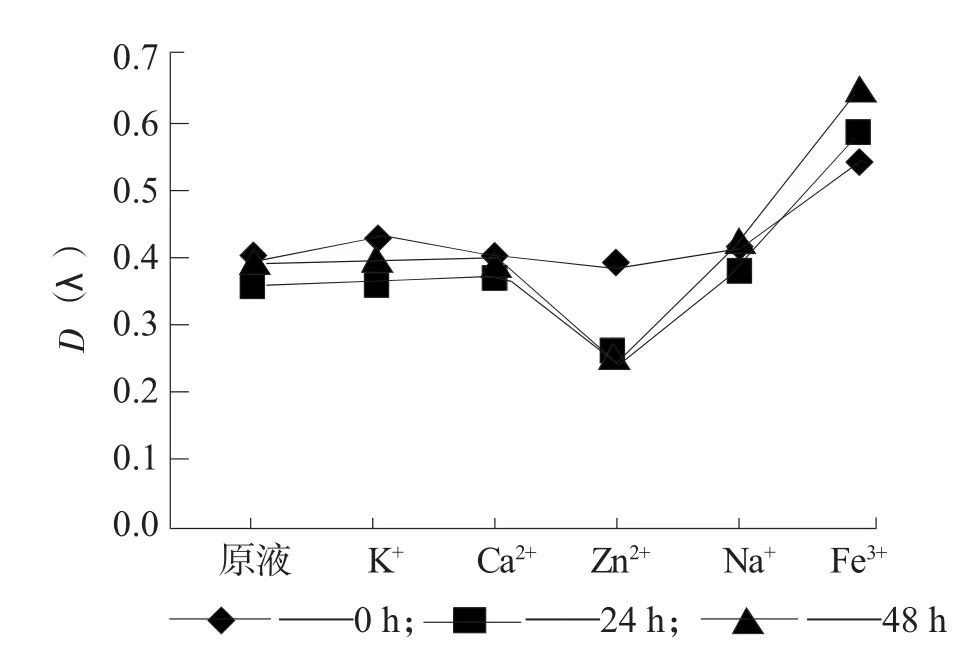
图3 金属离子对S3稳定性的影响

图4 金属离子对S4稳定性的影响

图5 金属离子对S5稳定性的影响
由图1~图5可知,紫番薯原花青素在加入各种金属离子后吸光度均有不同程度的变化。各样品和标准品溶液稳定性受Fe3+和Zn2+的影响比较大,Fe3+的加入后有絮状沉淀物产生;K+、Ca2+、Na+对其稳定性影响较小。
3.3 食品添加剂对原花青素稳定性的影响
食品添加剂对原花青素稳定性的影响见图6~图10。
由图6~图10可以看出,常用的食品添加剂对4个紫番薯原花青素稳定性影响均较小。同一种添加剂放置24 h、48 h后值基本不变;各种不同的添加剂加入后初始的吸光度值也非常接近。这些均表明紫番薯原花青素对食品添加剂表现出良好的稳定性。

图6 食品添加剂对S1稳定性的影响

图7 食品添加剂对S2稳定性的影响
图8 食品添加剂对S3稳定性的影响
图9 食品添加剂对S4稳定性的影响
图10 食品添加剂对S10稳定性的影响
4 结 论
研究表明,紫番薯原花青素对食品中常用的金属离子、添加剂等具有良好的稳定性。AB-8大孔树脂对紫番薯原花青素具有一定的富集能力(粗提物含量为7.442 mg/g),但效果有限。
[1] JAME A K,GRAHAM P J.Analysis of proanthocyanidin cleavage products of following acidcatalysis in the presence of excess phloroglucinol[J].Agric Food Chem,2001,49:1 740-1 746.
[2] PINENT M,BLADE C,SALVADO M J,et al.Procyanidin effects on adipocyte-related pathologies [J].Critical Reviews in Food Science and Nutrition,2006,46(7):543-550.
[3] YUSUF Y,TOLEDO R T.Health aspects of functional grape seed constituents [J].Trends in Food Science&Technology,2004,15(9):422-433.
[4] 吴娟,魏和平,许远.油菜籽皮中原花青素的提取及稳定性分析,[J].中国油脂,2010,35(3):67-69.
[5] 姜洪芳,张卫明,张玖.樱桃李色素提取及稳定性研究,[J].中国野生植物资源,2008,27(5):56-59.
[6] 汪志慧,孙智达,谢笔钧.莲房原花青素的稳定性及热降解动力学研究[J].食品科学,2011,32(7):77-82.
[7] 张海晖,李金凤,段玉清,等.板栗壳原花青素提取及其稳定性研究[J].食品科学,2011,32(8):5-9.
Research on extraction and stability ofprocyanidin from purple sweet potato
LIUPing1*WANGWen-jun2
1(Haigangarea agriculture bureau ofQinhuangdaocity,Qinhuangdao 066000,China)1(Zunyi medical college zhuhai campus,Zhuhai 519041,China)
Procyanidins in purple sweet potatoes extracted by ethanol were studied.And the extract was purified with AB-8 macroporous resin.The eluent concentration included 10%,30%,50%and 70%of ethanol solution.Four samples were obtained byconcentration and freeze dryingtreatment.Stabilityofeach sample was studied.
purple sweet potatos;procyanidins;stability
TS201.2+4
A
1673-6004(2012)02-0024-04
* 刘萍,女,1974年出生,2002年毕业于河北农业大学,水产工程师
2012-03-20

