NADPH-氧化酶抑制剂二苯基碘对软脂酸培养中胰岛细胞的影响*
中国医科大学附属第四医院内分泌科(沈阳110000) 王 露 张 微 索琳娜
“脂毒性”是指血循环中游离脂肪酸浓度过高以及脂肪组织分泌的各种脂肪素含量增高所引起的致糖尿病作用。脂毒性对胰岛β细胞的数量和功能均可产生不利影响。Moore等[1]指出软脂酸盐可以抑制胰岛素分泌。其机制可能与氧化应激有关,而应用抗氧化剂能否减轻此反应也不完全清楚。本实验应用软脂酸培养胰岛细胞,并进一步探讨NADPH-氧化酶抑制剂二苯基碘(DPI)对此的影响。
材料与方法
1 材 料 细胞株和试剂:大鼠胰岛细胞株INS-1(购自武汉大学细胞库),软脂酸购于美国Calbiochem公司,DPI购于美国CalBiochem公司;放射免疫法测定试剂盒购自解放军总医院科技开发中心放免研究所。
2 方 法
2.1 细胞培养:大鼠胰岛细胞株INS-1培养于含10%%FBS的RPMI1640培养基中(含10%mmol/L Hepes,1mmol/L丙酮酸钠,50μmol/L 2- 巯基乙醇,100U/ml青 霉 素 和 100μg/ml 的 链 霉 素 ),置 于37%℃,5%CO2饱和湿度培养箱常规培养,将处于对数生长期贴壁生长的INS-1细胞用0.25%胰酶消化离心,用RPMI1640培养液制成单细胞悬液,并校正细胞浓度至1×106/ml。分别将INS-1细胞按1×105个/ml种植于24孔板内,分为①正常对照组;②软脂酸组0.25mmol/L处理24h;③软脂酸0.25mmol/L DPI处理组.孵育24h收集上清液,-20°C保存。
2.2 胰岛素含量:采用放免法测定。
2.3 GSH-Px、MDA含量:采用比色法测定。
2.4 统计学分析:数据采用平均值±标准差表示,应用SPSS11.5对数据进行单因素方差(ANOVA)分析。
结 果
1 胰岛素含量的比较:单用软脂酸培养组的胰岛素水平较对照组明显降低(P﹤0.05),加用DPI干预后胰岛素水平较单用软脂酸组明显增加(P﹤0.05),见附表。
2 GSH-Px、MDA含量的比较:单用软脂酸培养组的GSH-Px含量较对照组明显降低(P﹤0.05),加用DPI干预后明显改善(P﹤0.05)。与对照组比较,单用软脂酸培养组的MDA含量明显增加(P﹤0.05),经DPI干预后明显得到抑制(P ﹤0.05),见附表。
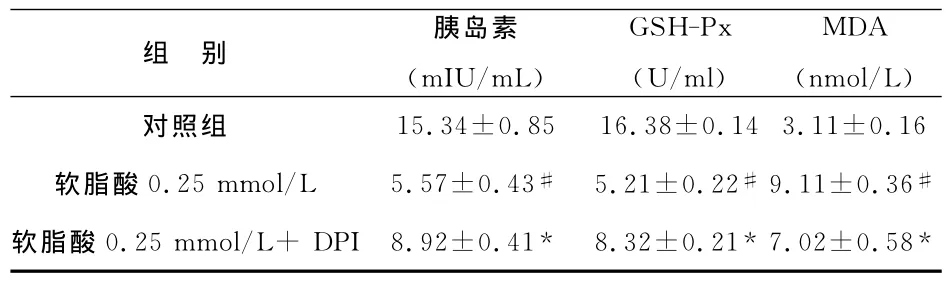
附表 各组胰岛素及GSH-Px、MDA含量的比较
讨 论
本研究应用软脂酸培养胰岛细胞发现胰岛素水平明显降低,进一步证明了游离脂肪酸对胰岛细胞脂毒性的作用,脂毒性可以诱导胰岛细胞凋亡[2],影响胰岛素分泌。Rao等[3]也发现将大鼠胰腺B细胞置入含有过氧化氢的环境中培养后,其凋亡数量较正常对照组明显增加,过氧化氢浓度越高,凋亡数量越多。这其中的机制,目前比较公认的是由于内质网应激和氧化应激[4,5]。胰岛是所有组织中对氧化应激最敏感的组织,胰岛中抗氧化酶的含量在所有组织中是最低的。本实验也研究发现软脂酸培养组的GSH-Px含量明显减低,MDA含量明显增加,表明软脂酸组氧化应激水平明显增加。氧化应激时过剩的活性氧族可以直接对脂质、蛋白、溶酶体、DNA造成氧化损伤,大量氧自由基可使细胞膜脂质过氧化,线粒体膜形状改变,导致线粒体功能障碍,生成减少,使质膜和肌浆网膜的钙泵失活,导致细胞内游离的钙离子增多,激活磷脂酶活性,使膜磷脂分解,导致B细胞凋亡。
抗氧化剂的应用是否能保护胰岛细胞功能,到目前为止国际上也开展了各种研究,有学者用不同浓度的自由基清除剂MIC-186处理后,其抗胰腺B细胞凋亡的作用呈剂量效应关系,提示MIC-186对胰腺B细胞有保护作用[3]。此外Piro等[6]也研究发现能抑制活性氧簇的烟酰胺可以抑制游离脂肪酸诱导的胰岛细胞凋亡。国内有学者应用N-乙酰半胱酸进行对胰岛细胞的保护研究[7],而氧化酶抑制剂DPI是否能保护胰岛细胞,目前研究很少,动脉粥样硬化是糖尿病的严重及常见并发症,糖尿病的主要临床特点是血糖升高,而高糖可以刺激血管产生氧化应激,损伤内皮细胞,诱发动脉粥样硬化。探讨氧化应激产生的机制,抑制活性氧的产生,对于防止糖尿病并发动脉粥样硬化有十分重要的作用。NADPH氧化酶(NOX)是血管内皮细胞中活性氧产生的主要来源,而DPI是NADPH氧化酶的抑制剂。在本实验中就发现加入DPI培养后,GSH-Px含量明显增加,MDA含量明显降低。
本研究发现NADPH-氧化酶抑制剂二苯基碘(DPI)显著改善了由软脂酸造成的胰岛细胞分泌减少和氧化应激水平增加,这不仅说明氧化应激在胰岛功能损伤中起一定作用,同时也为改善胰岛功能损伤的治疗提供了一条思路。
[1] Moore PC,Ugas MA,Hagman DK,et al.Evidence against the involvement of oxidative stress in fatty acid inhibition of insulin secretion[J].Diabetes,2004,53:2610-2616.
[2] Unger RH,Zhou YT.Lipotoxicity of beta cells in obesity and other causes of fatty acid spillover[J].Diabetes,2001,50(suppl 1):s118-s121.
[3] Rao P,Maeda H,Yutong X,et al.Protective effect of a radical scavenger,MCI-186on islet cell damages induced by oxidative stress[J].Transplant Proc,2005,37:3457-3458.
[4] Hansen M.Connecting endoplasmic reticulum stress to autophagy by unfolded protein response and Ca2+[J].Cell Death and Differentiation,2007,14:1576-1582.
[5] Scherz-Shouval R,Elazar Z.ROS mitochondria and the regulation of autophagy[J].Trends Cell Biol,2007,17:422-427.
[6] Piro S,Anello M,Dipietro C,et al.Chronic exprosure to free fatty acids or high glucose induces apoptosis in rat pancreatic islets:possible role of oxidative stress[7].Metabolism,2002,51:1340-1347.
[7] 王 露,张 微,彭观景,等.N-乙酰半胱酸对软脂酸培养中胰岛细胞的影响.陕西医学杂志,2011,40:785-786.

