铅暴露对生长发育期大鼠肝、肾功能及血液学指标的损伤作用研究*
徐 焰,车红磊,张建彬,黄 萍,柯 涛,袁亚娟,郝晓柯△,陈景元▲
(1.第四军医大学西京医院检验科,西安 710032;2.第四军医大学预防医学院军队劳动与环境卫生学教研室,西安 710032)
铅是环境中普遍存在的重金属污染物之一。人体经由空气、灰尘、食物、饮用水等接触暴露,并可在体内长期蓄积,造成全身多系统和器官的损伤及功能障碍。儿童是铅损伤的高危易感人群,铅对儿童的损伤呈连续的剂量-效应过程,可导致儿童认知缺陷、心理及行为异常,并严重危害儿童生长和发育,铅已成为危害儿童健康的“隐形杀手”[1-2]。儿童的铅吸收率较成人高且吸收速度快,一旦进入体内则难以排出,造成机体的累积损伤。目前,铅暴露对儿童机体损伤的详细作用机制不详,因此,本研究采用动物实验研究铅暴露对发育早期大鼠肝、肾功能的影响及其相关的毒性作用机制,现报道如下。
1 材料与方法
1.1材料 80只断乳(21 d)SD雄性大鼠,体质量为50~70 g,随机分为对照组及100 ppm、200 ppm和300 ppm醋酸铅浓度组各20例。铅组以不同浓度醋酸铅作为饮用水供给大鼠染毒,对照组无限制自由饮用去离子水,每天监测各组动物饮水量。各组大鼠分笼饲养,染毒期间始终自由进食普通饲料,染铅周期为6周。
1.2仪器与试剂 采用醋酸铅(PbC4H6O4·3H2O(美国Sigma公司); AA-6800 石墨炉原子吸收分光光度计(日本岛津公司);BH5100五通道原子吸收光谱仪(北京博晖新光电子技术公司);7170全自动生化分析仪(日立公司);XE-2100全自动血细胞分析系统(西森美康公司)。
1.3方法
1.3.1染铅对大鼠生长发育的影响 实验过程中,逐日观察并记录染铅大鼠的生长发育状况,包括:外观、情绪、饮食及饮水等变化。每周测量体质量并观察大鼠皮毛改变。
1.3.2染铅大鼠血铅水平检测 染毒后不同时间点(1~6周)、不同染铅剂量组大鼠利用原子吸收光谱进行尾血铅水平检测。
1.3.3铅暴露对大鼠肝、肾功能的影响 2%戊巴比妥钠麻醉动物,心脏取血,血清样本分离后,利用7170全自动生化分析仪检测各组大鼠血清中肝功能指标:天门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、总蛋白(TP)、清蛋白(ALB)、碱性磷酸酶(ALP)、谷氨酰转肽酶(GGT)、胆碱酯酶(CHE);肾功能指标:尿素氮(BUN)、肌酐(Cr)、尿酸(UA)、胱抑素C(CYS-C)。
1.3.4铅暴露对大鼠血液学指标的影响 2%戊巴比妥钠麻醉动物,心脏取血,加入乙二胺四乙酸二钾(EDTA-2K)标本采集管中,XE-2100全自动血液分析系统进行白细胞总数(WBC)、红细胞总数(RBC)、血红蛋白(Hb)、平均红细胞血红蛋白浓度(MCHC)、血小板总数(PLT)等项目的检测,输出结果。
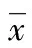
2 结 果
2.1染铅对大鼠情绪及皮毛缺损程度的影响 实验全程中,对照组大鼠情绪表现正常,无异常兴奋或抑制,皮毛整齐光亮,缺损程度为0级,染铅各组大鼠均可见皮毛粗乱,但无掉毛现象,缺损程度Ⅰ级。
2.2铅暴露对大鼠血铅水平的影响 原子吸收分光光度法检测结果证实,经过6周的饮水染毒,大鼠的血铅含量组间比较,差异有统计学意义(P<0.05)。 单因素方差分析显示,血铅浓度在对照组与100 ppm剂量组或对照组与200 ppm、300 ppm剂量组之间比较,差异有统计学意义(P<0.05),见表1。
2.3铅暴露对大鼠肝脏功能的影响 酶学及蛋白定量检测结果证实,经过6周的饮水染毒,大鼠的AST、ALP水平增加显著,差异有统计学意义(P<0.05)。 单因素方差分析显示,AST、ALP浓度在对照组与100 ppm剂量组或对照组与200 ppm、300 ppm剂量组之间比较,差异有统计学意义(P<0.05),且AST、ALP水平在铅染毒不同剂量组组间比较,差异有统计学意义(P<0.05),见表2。
2.4铅暴露对大鼠肾脏功能的影响 免疫浊度法和化学定量法检测结果证实,经过6周的饮水染毒,大鼠的BUN、CYS-C水平增加显著,差异有统计学意义(P<0.05)。 单因素方差分析显示,BUN、CYS-C浓度在对照组与100 ppm剂量组或对照组与200 ppm、300 ppm剂量组之间比较,差异有统计学意义(P<0.05),且铅染毒不同剂量组组间比较,差异有统计学意义P<0.05),见表3。
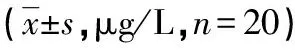
表1 铅暴露对大鼠血铅水平的影响
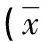
表2 铅暴露对大鼠肝脏功能的影响±s,n=20)
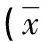
表3 铅暴露对大鼠肾脏功能的影响±s,n=20)
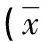
表4 铅暴露对大鼠血液学指标的影响±s,n=20)
2.5铅暴露对大鼠血液学指标的影响 血细胞分析检测结果证实,经过6周的饮水染毒,大鼠的RBC、Hb、PLT水平显著降低,差异有统计学意义(P<0.05)。单因素方差分析显示,RBC、Hb、PLT水平在对照组与100 ppm剂量组或对照组与200 ppm、300 ppm剂量组之间比较,差异有统计学意义(P<0.05),见表4。
3 讨 论
从2009年至今,中国儿童铅中毒事件的不断发生,已引起政府及相关部门的高度关注[3]。据不完全统计,中国不同地区、不同年龄段的儿童血铅浓度均值和几何标准差分别为5.94 μg/dL和1.58 μg/dL,以国际公认的儿童铅中毒诊断标准(10 μg/dL),超标率为12.74%,高于欧美国家1%~5%的超标率。中国血铅污染没有明显的区域特征,主要以沈阳、南昌、云南等地为血铅浓度比较高的典型区域[3-4]。儿童的生理特点和生活习性使其铅吸收率达成人的5~8倍,而排铅能力只有成人的30%,是铅污染的最大受害者[5]。大量动物实验也进一步证实,铅的胃肠道吸收有年龄依赖性,加之儿童较成人吸收率高(成人约10%,儿童可达53%),导致大量铅进入体内[6-7]。
全血血铅浓度是监测铅暴露首选的生物标志物,在成人吸入铅中大于50%被转运到血液里,而其中又有超过98%存在于血细胞中,儿童则更高。因此,全血铅主要指红细胞铅,是一个最典型的软组织铅,这一最主要的铅暴露生物标志物,被广泛用于人群筛查、诊断、体内负荷生物监测和金属吸收剂量评价[8-9]。
铅损伤涉及神经、血液、消化、泌尿生殖、免疫、内分泌、骨骼及牙齿等全身多系统和器官。覆盖不同年龄段儿童血铅水平对儿童发育影响的调查研究显示,0~5岁期间的铅暴露对儿童健康的危害更为严重[10-11]。
铅中毒早期缺乏特异性表现,消化系统常见症状为食欲减退、恶心呕吐、腹泻便秘、消化不良等肠胃机能紊乱;婴幼儿表现为厌食、哭闹;较大儿童可诉腹痛,但齿龈铅线及肠绞痛少见[12]。上述症状与铅直接作用于平滑肌,抑制其自主运行,并使其张力增加有关。本研究证实,肝脏功能的损伤程度与铅暴露浓度呈正相关,染铅大鼠AST水平升高提示低铅诱导肝细胞损伤;ALP水平升高提示低铅诱导大鼠肝细胞及骨代谢损伤;染铅大鼠CHE水平减低提示低铅诱导肝细胞损伤。
有研究者提出,铅是慢性肾病和高血压的诱因。铅引起的肾脏损伤包括:肾间质纤维化、肾小管退化和肾近基细胞核内包涵体等[13]。铅中毒可引起肾小管上皮细胞减少,致使肾小管对物质的排泄和重吸收功能受损。临床上出现氨基酸尿、糖尿。晚期出现尿少、氨质血症肾功能衰竭症状。本研究显示,铅的肾脏损伤程度与铅暴露浓度呈正相关,染铅大鼠BUN水平升高,提示低铅诱导肾脏功能受损;染铅大鼠CYS-C水平升高提示低铅诱导肾小球率过功能受损。
铅通过干扰机体铁摄入和置换铁在Hb合成途径中酶的作用位点影响Hb的合成,致机体贫血。铅影响亚铁血红素生物合成途径的机制与ALAD活化和靶向亚铁原卟啉合成酶的作用位点有关,最终导致亚铁原卟啉合成酶具有不同效应活性从而影响Hb的合成[14]。
本研究通过建立染铅大鼠损伤模型,发现铅致大鼠肝、肾功能及血液学损伤的作用靶分子,为阐明铅损伤机制提供实验支持,为铅中毒的预防及治疗措施提供借鉴。
[1]Luo W,Ruan D,Yan C,et al.Effects of chronic lead exposure on functions of nervous system in Chinese children and developmental rats[J].Neurotoxicology,2012,33(4):862-871
[2]Watts J.Lead poisoning cases spark riots in China[J].Lancet,2009,374(9693):868.
[3]Binns HJ,Campbell C,Brown MJ.Interpreting and managing blood lead levels of less Than 10 microg/dL in children and reducing childhood exposure to lead:recommendations of the centers for disease control and prevention advisory committee on childhood lead poisoning prevention[J].Pediatrics,2007,120(5):e1285-e1298.
[4]董兆敏,吴世闽,胡建英.中国部分地区铅暴露儿童健康风险评价[J].中国环境科学,2011,31(11):1910-1916.
[5]Lin GZ,Wu F,Yan CH,et al.Childhood lead poisoning associated with traditional Chinese medicine:a case report and the subsequent lead source inquiry[J].Clin Chim Acta,2012,413(13/14):1156-1159.
[6]Wang Q,Luo W,Zheng W,et al.Iron supplement prevents lead-induced disruption of the blood-brain barrier during rat development[J].Toxicol Appl Pharmacol,2007:219(1):33-41.
[7]Zhu ZW,Yang RL,Dong GJ,et al.Study on the neurotoxic effects of low-level lead exposure in rats[J].J Zhejiang Univ Sci B,2005,6(7):686-692.
[8]Barbosa F,Tanus-Santos JE,Gerlach RF,et al.A critical review of biomarkers used for monitoring human exposure to lead:advantages,limitations,and future needs[J].Environ Health Perspect,2005,113(12):1669-1674.
[9]Smith D,Hernandez-Avila M,Téllez-Rojo MM,et al.The relationship between lead in plasma and whole blood in women[J].Environ Health Perspect,2002,110(3):263-268.
[10]Revich BA,Sharov PO,Sergeev OV.Lead and children′s health:results of some Russian studies in 2000~2009[J].Gig Sanit,2011,(6):12-16.
[11]Callan AC,Hinwood AL.Exposures to lead[J].Rev Environ Health,2011,26(1):13-15.
[12]Ramos CL,Barros HM,Stein AT,et al.Risk factors contributing to childhood poisoning[J].J Pediatr(Rio J),2010,86(5):435-440.
[13]Ursula CB,Mark AP.A review of chronic lead intoxication:an unrecognized cause of chr onic kidney disease [J].Am J Med Sci,2004,327(6):341-347.
[14]Pawlas N,Broberg K,Olewińska E,et al.Modification by the genes ALAD and VDR of lead-induced cognitive effects in children[J].Neurotoxicology,2012,33(1):37-43.

