Hpa和VEGF-C在大肠癌中的表达及意义
甄运寰,颜登国,张汝一
(贵阳医学院附属医院肛肠外科,贵阳 550004)
大肠癌是消化道常见的恶性肿瘤。目前,手术切除仍是治疗大肠癌的主要措施。但术后5年生存率仍较低[1]。50%~60%的患者死于肿瘤的复发和转移[2-3]。引起肿瘤复发和转移的主要原因是肿瘤具有侵袭和转移性。肿瘤的侵袭转移是肿瘤细胞与宿主细胞之间一系列复杂的、多步骤、多因素相互作用的动态过程,主要包括肿瘤细胞与细胞外基质黏附、贴近肿瘤细胞的基质降解、肿瘤细胞在趋化因子的作用下向纵深方向移动和肿瘤淋巴管生成等。乙酰肝素酶(hparanase,Hpa)能降解细胞外基质(ECM)和基底膜(BM)组成的屏障,从而促进肿瘤的侵袭及转移[4]。而血管内皮生长因子-C(vascular endothelial growth factor-C,VEGF-C)诱导在肿瘤外周形成新的淋巴管[5],使肿瘤细胞从新生淋巴管进入淋巴结,发生淋巴结转移[6-8]。作者通过免疫组织化学检测大肠癌组织中Hpa和VEGF-C蛋白的表达,探讨其与大肠癌侵袭和转移的关系。
1 资料与方法
1.1一般资料 收集贵阳医学院附属医院肛肠外科1994~1999年收治的40例术前未经放化疗,术后肿瘤组织石蜡块仍保存完好的大肠癌病例。其中,男19例,女21例。年龄25~77岁,平均55.7岁。结肠癌11例,直肠癌29例。40例均为腺癌,高分化9例,中分化25例,未分化及低分化6例。浸润深度在浆膜层以内16例,浸润深度达到或超过浆膜层24例。有淋巴结转移14例,无淋巴结转移26例。临床分期:按国际抗癌联盟(union international control cancer,UICC)提出的TNM分期法,Ⅰ期11例、Ⅱ期13例、Ⅲ11例、Ⅳ5例。40例患者35例行根治性切除,5例行姑息性切除。正常组织来源于大肠腺瘤切除的大体标本中。
1.2试剂与方法 对大肠正常组织及大肠癌组织进行普通HE染色,确定所有切片中均存在所需组织。免疫组织化学染色采用Envision两步法,兔抗人Hpa单克隆抗体购于武汉博士德生物工程有限公司;兔抗人VEGF-C多克隆抗体,购于北京中杉金桥生物技术有限公司。免疫组织化学通用型PV9000试剂盒和二氨基联苯胺(DAB)显色试剂盒购于北京中杉金桥生物技术有限公司。操作按说明书进行。
1.3结果判断 由2位病理专家单独阅片,结果再综合分析确定。Hpa和VEGF-C染色阳性信号为胞浆呈清晰棕黄色颗粒。每张切片在400倍显微镜下选定10个视野计算阳性细胞的百分数。表达强度判断,阴性(-):全部肿瘤细胞无显色或胞浆染色阳性的细胞数小于5%;(+):阳性细胞5%~24%;(++):阳性细胞25%~50%;(+++):阳性细胞大于50%。
1.4随访 随访时间11个月至6年。术后经书信随访到38例,失访2例,随访率为95%。生存5年以下者23例,生存5年或以上者15例。
1.5统计学处理 采用SPSS11.5统计软件包处理,采用χ2检验,以P<0.05为差异有统计学意义。
2 结 果
2.1Hpa和VEGF-C表达比较 大肠癌组织中Hpa和VEGF-C的阳性表达率明显高于大肠正常组织中的表达率(P<0.01),见表1,封2图1~2。
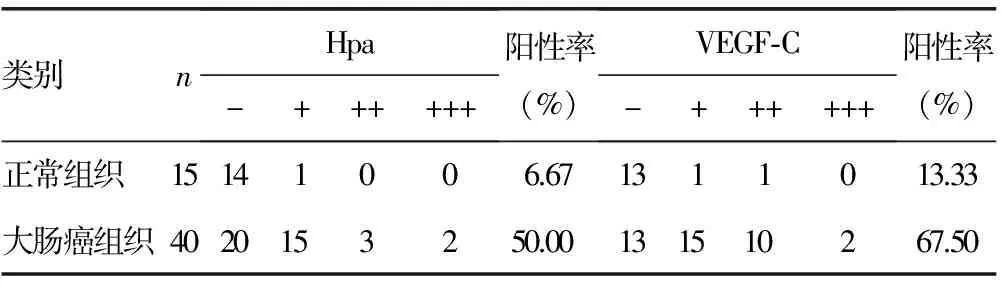
表1 Hpa与VEGF-C在大肠癌组织及正常组织中的表达
2.2Hpa和VEGF-C在大肠癌中的表达与临床病理特征的关系 Hpa和VEGF-C在性别、年龄、肿物大小、肿物位置及浸润深度方面的阳性表达比较,差异无统计学意义(P>0.05);在有无淋巴转移、Ⅲ、Ⅳ期与TNM Ⅰ、Ⅱ、生存期小于5年与大于或等于5年的阳性率比较,差异有统计学意义(P<0.01),见表2。

表2 Hpa和VEGF-C在大肠癌中的表达和临床病理特征的关系
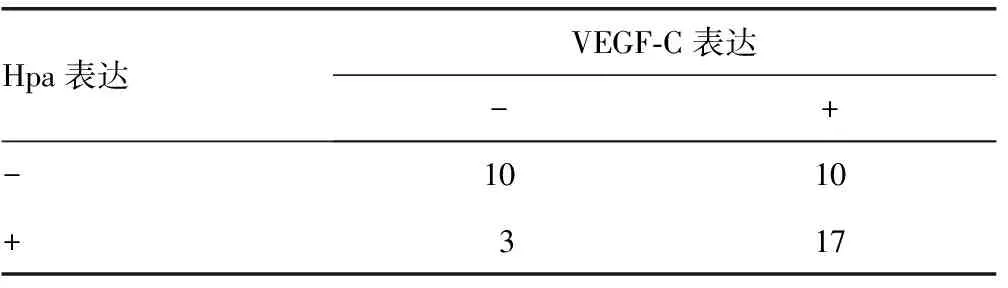
表3 Hpa和VEGF-C的表达在大肠癌中的相关性
2.3Hpa和VEGF-C的表达在大肠癌中的相关性 Hpa和VEGF-C在大肠癌中的表达呈正相关,相关系数为0.570,P<0.01,见表3。
3 讨 论
3.1Hpa和VEGF-C的表达与大肠癌发生、发展 侵袭和转移是恶性肿瘤的最重要特征,是影响肿瘤治愈率的主要因素。大多数学者研究发现,Hpa在肿瘤的侵袭及转移中发挥重要作用[9]。硫酸乙酰肝素(HS)是ECM和BM组成的屏障中的主要成分。Hpa是体内惟一能降解HS的酶,使ECM和BM组成的屏障受到破坏,是肿瘤的侵袭转移中的一个关键酶。Hpa可以释放和激活结合在HS上的碱性成纤维细胞生长因子(bFGF),bFGF能促进肿瘤细胞、内皮细胞和成纤维细胞增生迁移从而诱导肿瘤血管生成和使血管的通透性增强,促使肿瘤细胞的侵入血管和远处种植。许多研究已证实,Hpa在许多高转移恶性肿瘤细胞中表达水平很高[10-11]。VEGF-C属血管内皮生长因子和血小板生长因子家族,主要与分布在淋巴管内皮细胞上的VEGFR-3受体结合,诱导在肿瘤外周形成新的淋巴管,并使新的淋巴管与已存淋巴管融合,是肿瘤细胞从新生淋巴管进入淋巴结,发生淋巴结转移,通过淋巴系统向全身其他器官扩散[12]。VEGF-C与分布于血管内皮细胞上的受体 VEGFR-2结合,促进肿瘤血管增生,诱导新生血管形成,从而促进肿瘤细胞的血行转移。许多研究中 VEGF-C高表达的患者生存时间和生存率明显降低[13-14]。本实验结果显示,大肠癌患者中Hpa、VEGF-C的表达明显高于正常组织,大肠癌有淋巴转移、Ⅲ~Ⅳ期、生存时间小于5年者Hpa、VEGF-C的表达明显高于无淋巴转移、Ⅰ~Ⅱ期、生存时间大于或等于5年者,这与许多研究相一致。
3.2Hpa和VEGF-C 在大肠癌的临床病理学特征中的表达 本实验中Hpa和VEGF-C的表达与患者性别、年龄、肿物大小、肿物位置、肿瘤浸润深度和肿瘤的分化程度均无关(P>0.05)。这与临床上肿瘤的浸润和转移与性别、年龄、肿物大小、肿物位置无关相吻合。临床上大肠癌肿瘤浸润的深度、肿瘤分化程度与肿瘤转移有一定的相关性,浸润深度越深、肿瘤分化程度越差,发生转移的可能性越高,这与临床上分化程度与肿瘤转移有关的观点相矛盾,这可能说明肿瘤发生与转移是较复杂的,是受多种因素影响的。Hpa和VEGF-C在有淋巴结转移组明显高于无淋巴结转移组,这提示Hpa和VEGF-C表达与大肠癌组织的淋巴结转移密切相关。这可能与Hpa促进肿瘤血管生成及增加血管通透性,而VEGF-C能诱导肿瘤外周形成新的淋巴管和新的血管,从而使肿瘤细胞可通过淋巴-静脉连接进入淋巴管或直接侵入与血管伴行的淋巴管,促进淋巴转移有关。
3.3Hpa和VEGF-C在大肠癌中的相关性 Hpa和VEGF-C在大肠癌中的表达呈正相关,相关系数为0.570,P<0.01,说明Hpa和VEGF-C在大肠癌的发生、发展过程中发挥了重要作用,功能上可能具有互补性,Hpa能破坏ECM和BM组成的屏障,使肿瘤发生侵袭,VEGF-C使肿瘤所在位置形成淋巴管,使侵袭的肿瘤发生淋巴结转移成为可能。二者均能诱导新生血管形成,促进肿瘤发生血行转移。说明两者在肿瘤的发生、浸润及转移过程中相互促进、关系密切。
3.4Hpa和VEGF-C与大肠癌分期及预后的关系 临床上Ⅲ、Ⅳ期的大肠癌患者5年生存率明显低于Ⅰ、Ⅱ患者[15],Hpa和VEGF-C在Ⅲ、Ⅳ期大肠癌患者的阳性表达率明显高于TNM Ⅰ、Ⅱ期;在生存期小于5年大肠癌中的阳性表达率明显高于大于等于5年组(P<0.01)。提示Hpa和VEGF-C高表达的大肠癌患者肿瘤细胞侵袭和转移的能力越强,预后越差。
[1]刘宝善.大肠肛门肿瘤学[M].成都:四川科学技术出版社,2002:8-14.
[2]Van Cutsem E,Nordlinger B,Adam R,et al.Towards a pan-european consensus on the treatment of patients with colorectal liver metastases[J].Eur J Cancer,2006,42(17):2212-2221.
[3]Yoo PS,Lopez-Soler RI,Hulett MD,et al.Liver resection for mstastatic colorection cancer in the age of neoadjuvant chemotherapy and bevacizumab[J].Clin Colorectal Cancer,2006,6(2):202-207.
[4]Freeman C,Handorf BJ,Baker RT,et al.Cloning of mammalian heparanase,an important enzyme in tumor invasion and metastasis[J].Nat Med,1999,5(7):803-809.
[5]Jeltsch M,Kaipainen A,Joukov V,et al.Hyperplasia of lymphatic vessels in VEGF-C transgenic mice[J].Science,1997,276(10):1423-1425.
[6]Kinoshita J,Kitamura K,Kabashima A,et al.Clinical significance of vascular endothelial growth factor-C(VEGF-C) in breast cancer breast[J].Cancer Res Treat,2001,66(2):159-164.
[7]Kawakami M,Furuhata T,Kimura Y,et al.Quantification of vascular endothelial growth factor-C and its receptor-3 messenger RNA with real-time quantitative polymerase chain reaction as a predictor of lymph node metastasis in human colorectal cancer[J].Surgery,2003,133(3):300-308.
[8]Nakashima T,Kondoh S,Kitoh H,et al.Vascular endothelial growth factor-c in human gallbladder cancer and its relationship to lymph node metastasis[J].Int J Mol Med,2003,11(1):33-39.
[9]Eccles SA.Heparanase:breaking down barriers in tumors[J].Nat Med,1999,5(7):735-736.
[10]El-Assal ON,Yamanoi A,Ono T,et al.The clinicopathological significance of heparanase and basic fibroblast growth factor expressions in hepatocellular carcinoma[J].Clin Cancer Res,2001,7(11):1299-1305.
[11]Elkin M,Cohen I,Zcharia E,et al.Regulation of heparanase gene expression by estrogen in breast cancer[J].Cancer Res,2003,63(12):8821-8826.
[12]Yonemura Y,Endo Y,Fujita H,et al.Role of vascular endothelial growth factor-C expressin in the development of lymph node metastasis in gastric cancer[J].Clin Cancer Res,1999,5(7):1823-1829.
[13]Eggert A,Ikegakin N,Kwiat KJ.High-level expression of angiogenic factors is associated with advanced tumor stage in human neuroblastomas[J].Clin Cancer Res,2000,6(14):1900-1908.
[14]Ueda M,Terai Y,Yamashita Y.Correlation between vascular endothelial growth factor-C expression and invasion phenotype in cervical carcinomas[J].Int J Cancer,2002,98(5):335-343.
[15]O′Connell JB,Maggard MA,Ko CY.Colon cancer survival rates with the new American Joint Committee on Cancer sixth edition staging[J].J Natl Cancer Inst,2004,54(3):295-308.

